
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
4.1.4. Термодинамические константы трех- и четырехосновных кислот в органических растворителях
При взаимодействии кислоты с растворителем в зависимости от природы и физико-химических свойств самой среды образуются, как было отмечено ранее (раздел 1.1), либо молекулярные сольваты (а), либо сольватированные ионы (б), либо ассоциированные ионные пары (в), тройники и т.д.
![]() (а)
(а)
![]() (б)
(б)
![]() (в)
(в)
Так, в неполярных растворителях с низкими значениями диэлектрических проницаемостей (например, в бензоле) процесс взаимодействия заканчивается на стадии (а), тогда как в полярных растворителях с достаточно высокими диэлектрическими проницаемостями (например, в воде) доминирующим процессом является диссоциация на сольватированные ионы, а в полярных растворителях с относительно невысокими диэлектрическими проницаемостями, в молекулах которых имеются малоподвижные атомы водорода (например, в среде ацетона) превалирует процесс ассоциации сольватированных ионов (в).
Термодинамические константы диссоциации водных растворов монокислот могут быть определены при непосредственном измерении рН (активности ионов водорода), поэтому с оценкой рКособых трудностей не возникает, хотя константа диссоциации такой изученной кислоты, как хлористоводородная, определенная одним и тем же методом, в большинстве случаев отличается на порядок и более. Так, по одним сведениям рКHCl = -0.98, по данным других авторов показатель константы диссоциации равняется 1.0, разница в константах составляет два порядка.
Значительные трудности возникают при определении ступенчатых, последовательных констант диссоциации водных растворов многоосновных кислот, особенно при совместной нейтрализации кислотных групп, то есть при близости значений рК1, pK2. Выше было отмечено, что существующие методы расчета и определения констант диссоциации многоосновных кислот, предложенные Спикменом [24, 29], позднее Бейтсом [25], справедливы для водных растворов. В растворителях, отличных от воды, проблемы усугубляются неопределенностью, связанной с рН раствора в неводных средах. Рассмотрим диссоциацию поликислот и соответствующие константы диссоциации в любом растворителе в упрощенном виде по уравнениям (2.1) и (2.2).
Поэтому экспериментальное определение рК одно- и дикислот в органических растворителях, тем более многоосновных кислот, в связи с невозможностью прямого измерения активности лионий-ионов, представляет некоторую проблему.
Для определения термодинамических констант диссоциации поликислот воспользуемся методами прямой потенциометрии и потенциометрического титрования, как наиболее наглядными и оптимальными среди известных методов. При этом требуется учитывать основные количественные законы теории растворов электролитов: закон электронейтральности, закон сохранения материального баланса, правило стехиометрии и ряд других.
При потенциометрическом титровании слабой, двухосновной кислоты сильным, полностью диссоциированным, основанием (гидроксидом тетраалкиламмония, гуанидином и т.д.) в любой точке справедливо соотношение:
![]() (4.7)
(4.7)
а электронейтральность раствора при этом может быть записана в виде:
![]() (4.8)
(4.8)
Перемножив уравнения (4.7) и (4.8), подставляя активности различных частиц поликислоты из уравнений (2.1)-(2.2), получим общее уравнение для расчета термодинамических констант диссоциации любой многоосновной кислоты:
![]() (4.9)
(4.9)
В уравнениях (4.7), (4.8), (4.9): 2 – число моль эквивалентов сильного основания в каждой точке титрования поликислоты; ![]() - активность ионов лиония (сольватированного иона водорода) в каждой точке потенциометрического титрования многоосновной кислоты;
- активность ионов лиония (сольватированного иона водорода) в каждой точке потенциометрического титрования многоосновной кислоты;
![]() fo,
fo,![]() - коэффициенты активности молекул Н2A и ионов
- коэффициенты активности молекул Н2A и ионов ![]()
Равновесные концентрации всех частиц ![]() , образующихся при титровании трехосновных кислот, могут быть определены на диаграммах -log (активность лиония) – lоgC [20, 38]. Оценка значения коэффициентов активности f0, f1, f2 проводится по закону Дебая [8].
, образующихся при титровании трехосновных кислот, могут быть определены на диаграммах -log (активность лиония) – lоgC [20, 38]. Оценка значения коэффициентов активности f0, f1, f2 проводится по закону Дебая [8].
Полиэлектролиты, как правило, характеризуются близостью констант диссоциации. Поэтому определение значений последовательных констант равновесий затруднено.
Уравнение (4.11) позволяет определить константы диссоциации электролитов при дифференцированном титровании многоосновной кислоты, а также при совместной нейтрализации всех кислотных групп. Это становится возможным при экспериментальном определении стандартного потенциала E0 электрохимической цепи без переноса [26]
Cтеклянный электрод / НСlО4 / AgCl, Ag (II)
в соответствующих растворителях, величина которого используется для оценки активности иона лиония ![]() в каждой точке титрования полиэлектролита.
в каждой точке титрования полиэлектролита.
В табл. 4.3 приведены данные измерения ЭДС цепи (I) в среде ДМФ в зависимости от моляльности хлорной кислоты, а также результаты оценки степени диссоциации HClО4 и исходные величины для расчета стандартного потенциала цепи. ЭДС цепи (I) описывается уравнением Нернста
![]() (2.5)
(2.5)
где ![]() - активности сольватированных катиона (лиония) и аниона (перхлорат-иона).
- активности сольватированных катиона (лиония) и аниона (перхлорат-иона).
В уравнение (2.5) введем константу диссоциации кислоты
![]() (2.6)
(2.6)
и получим уравнение:
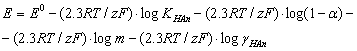 (2.7)
(2.7)
Если принять ![]() , то уравнение (2.7) может быть трансформировано в следующее:
, то уравнение (2.7) может быть трансформировано в следующее:
![]() (2.8)
(2.8)
Величину ![]() определяют по линейной регрессии при log m = 0 (компьютерная программа в Приложении I), получена величина 0.360 В (коэффициент регрессии r = 0.9905).
определяют по линейной регрессии при log m = 0 (компьютерная программа в Приложении I), получена величина 0.360 В (коэффициент регрессии r = 0.9905).
Здесь: a и![]() - степень диссоциации и коэффициент активности хлорной кислоты в растворе.
- степень диссоциации и коэффициент активности хлорной кислоты в растворе.
Степень диссоциации хлорной кислоты может быть оценена по уравнению (2.8) при допущении, что коэффициент активности нейтральной молекулы HClО4 в разбавленных растворах равен единице:
![]() (4.10)
(4.10)
Таблица 4.3
Моляльная концентрация хлорной кислоты в ДМФ (m, моль/кг), электродвижущая сила (Е) цепи (I), степень диссоциации HClО4 (a) и данные для расчета стандартного потенциала Е0
| m | Е, В | a (ур.4.10) | (ma)1/2 | E¢ |
| 0.078 | 0.347 | 0.869313 | 0.260397 | 0.414786 |
| 0.039 | 0.340 | 0.913724 | 0.188773 | 0.423991 |
| 0.0195 | 0.332 | 0.940736 | 0.135441 | 0.432717 |
| 0.00975 | 0.318 | 0.948341 | 0.096158 | 0.435974 |
| 0.004875 | 0.308 | 0.961583 | 0.068467 | 0.443084 |
| 0.002438 | 0.274 | 0.925920 | 0.047507 | 0.427496 |
| 0.001219 | 0.229 | 0.778882 | 0.030813 | 0.404306 |
Значение стандартного потенциала цепи (II) определяют по компьютерной программе (Приложение II) по приближению функции ![]() при
при ![]() .
.
Таким образом, получена величина стандартного потенциала цепи (I) в среде ДМФ, равная 0.4046 В.
Содержание воды, определенное модифицированным нами методом К.Фишера [39], не превышало для ДМФ ±0.02 вес.%.
Модификация метода К.Фишера [39] состояла в использовании в качестве растворителя реактива хлороформа, свободного от недостатков, присущих метанолу и ДМФ. Так, метанол, содержащийся в стандартном реактиве Фишера, является не только растворителем, но и активно вступает в реакцию с растворителями, в которых определяют содержание влаги, с образованием новых молекул воды. Определение термодинамических констант диссоциации моно- и дикислот в органических растворителях представляет значительную трудность в связи с невозможностью прямого измерения рН растворов электролитов [7, 27, 30]. Поэтому для приемлемой оценки активности лионий-ионов a(SH+), образующихся в органическом растворителе, необходимо предварительно экспериментально определить стандартный потенциал Ео цепи без переноса [26]:
стеклянный электрод/НА(S)/AgCl,Ag, (III)
с помощью которого по данным потенциометрического титрования (Е, V) кислот (HA, H2A) и уравнению Нернста можно рассчитать –lg a(SH+).
При потенциометрическом титровании двухосновных кислот функциональные кислотные группы нейтрализуются последовательно (в случае, когда ΔрК ≥ 3) в дифференцирующем растворителе, совместно – в нивелирующем растворителе (если ΔрК < 3).
4.1.4.1. Одно- и двухосновные кислоты
В данной работе приведены результаты модельных представлений и эксперимента по определению термодинамических констант диссоциации бензойной, пикриновой и сульфаниловой кислот, то есть кислот разной природы и кислотно-основных свойств в среде такого диполярного апротонного растворителя, как ДМФ [7, 30, 32, 33].
Стандартный потенциал цепи (I), определенный по методикам в работе [26], а также по компьютерной программе (Приложение II) [7], по данным табл. 4.3, равен Е0 = 0.4046 В. На рис. 4.3, 4.4, и 4.5 представлены кривые потенциометрического титрования перечисленных выше кислот раствором гуанидина в ДМФ: 0.02538М раствора бензойной, 0.0127 М раствора пикриновой и 0.01588 Мсульфаниловой кислот 0.06482 М раствором гуанидина.
Как видно, дифункциональная сульфаниловая кислота имеет два скачка потенциала, которые свидетельствуют о дифференцирующем действии ДМФ в отношении двух функциональных кислотных групп.
Рассмотрим диссоциацию двухосновной кислоты и соответствующие константы диссоциации в любом растворителе в упрощенном виде (без представления различных комплексов или сольватированных частиц, которые реально существуют в растворах):
![]() ,
, ![]() (4.2)
(4.2)
![]() ,
,![]() (4.3)
(4.3)
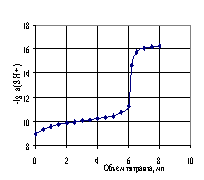
Рис. 4.3
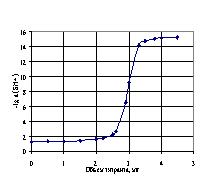
Рис. 4.4
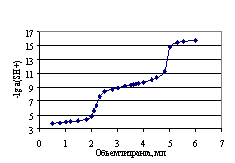
Рис. 4.5
Рис. 4.3, 4.4 и 4.5. Кривые потенциометрического титрования кислот раствором сильным основанием в ДМФ: 0.02538 М раствора бензойной кислоты 0.08321 М раствором гуанидина (рис. 4.3); 0.01270 М раствора пикриновой кислоты 0.08358 М раствором гуанидина (рис. 4.4); 0.01588 М сульфаниловой кислоты 0.06482 М раствором гуанидина (рис. 4.5).
Для определения термодинамических констант диссоциации кислот более приемлемы методы прямой потенциометрии и потенциометрического титрования. Равновесные концентрации всех частиц ![]() , образующихся при титровании кислоты, могут быть определены, как было отмечено ранее, на диаграммах -lg (активность лиония) – lg C (рис. 4.6, 4.7, 4.8) [7, 27, 30].
, образующихся при титровании кислоты, могут быть определены, как было отмечено ранее, на диаграммах -lg (активность лиония) – lg C (рис. 4.6, 4.7, 4.8) [7, 27, 30].
Оценка значения коэффициентов активности f0, f1, f2 проводится по более приемлемому уравнению Дэвиса [9]
-lgfi = [A·Zi·I0.5/(1+I0.5)]-0.1·I, (4.5)
исключающему неопределенный параметр наибольшего сближения ионов а по Дебаю-Хюккелю.
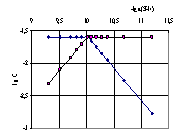
Рис.4.6
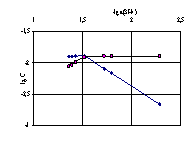
Рис. 4.7
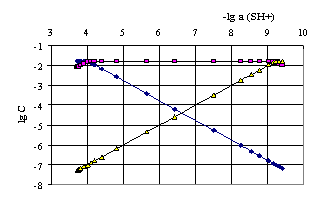
Рис. 4.8
Рис. 4.6, 4.7 и 4.8. Логарифмические диаграммы для определения равновесных концентраций частиц при титровании раствором гуанидина в среде ДМФ: рис.4.6 – бензойной кислоты и бензоат-иона, рис. 4.7 – пикриновой кислоты и пикрат-иона, рис. 4.8 – сульфаниловой кислоты, одно- и двухзарядных анионов сульфаниловой кислоты.
Таблица 4.4
Данные потенциометрического титрования, равновесные концентрации частиц в системе, ионная сила, коэффициенты активности для расчета показателя константы диссоциации бензойной кислоты по ур. (4.1)
| Vi | E, B | -lg a(SH+) | [HA] | [A-] | I 0,5 | f1 | pK |
| 0.5 | -0.1348 | 9.300 | 0.02541 | 0.00484 | 0.0492 | 0.8473 | 10.09 |
| 1 | -0.1473 | 9.516 | 0.02541 | 0.00796 | 0.0631 | 0.8136 | 10.11 |
| 1.5 | -0.1581 | 9.702 | 0.02541 | 0.01223 | 0.0782 | 0.7806 | 10.12 |
| 2 | -0.1650 | 9.820 | 0.02541 | 0.01604 | 0.0895 | 0.7578 | 10.14 |
| 2.5 | -0.1701 | 9.908 | 0.02541 | 0.01966 | 0.0991 | 0.7399 | 10.15 |
| 3 | -0.1763 | 10.017 | 0.02541 | 0.02521 | 0.1123 | 0.7171 | 10.16 |
| 3.5 | -0.1803 | 10.085 | 0.02186 | 0.02541 | 0.1127 | 0.7164 | 10.16 |
| 4 | -0.1857 | 10.173 | 0.01784 | 0.02541 | 0.1127 | 0.7164 | 10.16 |
| 4.5 | -0.1911 | 10.272 | 0.01423 | 0.02541 | 0.1127 | 0.7164 | 10.16 |
| 5 | -0.1974 | 10.379 | 0.01110 | 0.02541 | 0.1127 | 0.7164 | 10.16 |
| 5.5 | -0.2151 | 10.684 | 0.00551 | 0.02541 | 0.1127 | 0.7164 | 10.16 |
| 6 | -0.2446 | 11.194 | 0.00170 | 0.02541 | 0.1127 | 0.7164 | 10.16 |
Уравнения (4.1), (4.2) и (4.3) позволяют рассчитать термодинамические константы диссоциации одно- и двухосновных кислот в среде неводного растворителя [30]. В табл. 4.4, 4.5 и 4.6 представлены результаты эксперимента и расчетов рК бензойной, пикриновой и сульфаниловой кислот в среде диполярного апротонного растворителя ДМФ, а в табл. 4.7 – статистически обработанные величины. Как видно, метод характеризуется достаточно высокой воспроизводимостью.
Таблица 4.5
Данные потенциометрического титрования, равновесные концентрации частиц в системе, ионная сила, коэффициенты активности для расчета показателя константы диссоциации пикриновой кислоты по ур. (4.1)
| Vi, мл | E, B | -lg a(SH+) | [HA] | [A-] | I 0,5 | f1 | pK |
| 0.3 | 0.327 | 1.3578 | 0.01270 | 0.00870 | 0.06597 | 0.8071 | 1.61 |
| 0.4 | 0.326 | 1.3771 | 0.01270 | 0.00910 | 0.06745 | 0.8038 | 1.62 |
| 0.5 | 0.325 | 1.3867 | 0.01270 | 0.00930 | 0.06821 | 0.8021 | 1.62 |
| 0.6 | 0.324 | 1.3964 | 0.01270 | 0.00951 | 0.06897 | 0.8004 | 1.62 |
Продолжение табл.4.5
| Vi, мл | E, B | -lg a(SH+) | [HA] | [A-] | I 0,5 | f1 | pK |
| 0.7 | 0.323 | 1.4060 | 0.01270 | 0.00972 | 0.06974 | 0.7987 | 1.62 |
| 0.8 | 0.322 | 1.4156 | 0.01270 | 0.00994 | 0.07052 | 0.7970 | 1.62 |
| 0.9 | 0.321 | 1.4253 | 0.01270 | 0.01017 | 0.07130 | 0.7953 | 1.62 |
| 1.0 | 0.320 | 1.4349 | 0.01270 | 0.01040 | 0.07210 | 0.7935 | 1.62 |
| 1.1 | 0.319 | 1.4446 | 0.01270 | 0.01063 | 0.07291 | 0.7918 | 1.62 |
| 1.2 | 0.317 | 1.4639 | 0.01270 | 0.01111 | 0.07454 | 0.7883 | 1.62 |
| 1.3 | 0.316 | 1.4832 | 0.01270 | 0.01162 | 0.07622 | 0.7847 | 1.63 |
| 1.4 | 0.315 | 1.5025 | 0.01270 | 0.01215 | 0.07793 | 0.7812 | 1.63 |
| 1.5 | 0.314 | 1.5121 | 0.01270 | 0.01242 | 0.07880 | 0.7793 | 1.63 |
| 1.6 | 0.312 | 1.5603 | 0.01163 | 0.01270 | 0.07970 | 0.7775 | 1.63 |
| 1.7 | 0.308 | 1.5989 | 0.01064 | 0.01270 | 0.07970 | 0.7775 | 1.63 |
| 1.8 | 0.305 | 1.6375 | 0.00974 | 0.01270 | 0.07970 | 0.7775 | 1.63 |
| 1.9 | 0.304 | 1.6761 | 0.00890 | 0.01270 | 0.07970 | 0.7775 | 1.63 |
| 2.0 | 0.303 | 1.7147 | 0.00815 | 0.01270 | 0.07970 | 0.7775 | 1.63 |
| 2.1 | 0.301 | 1.7533 | 0.00746 | 0.01270 | 0.07970 | 0.7775 | 1.63 |
| 2.2 | 0.299 | 1.7919 | 0.00682 | 0.01270 | 0.07970 | 0.7775 | 1.63 |
| 2.3 | 0.288 | 1.8883 | 0.00546 | 0.01270 | 0.07970 | 0.7775 | 1.63 |
| 2.4 | 0.280 | 1.9848 | 0.00438 | 0.01270 | 0.07970 | 0.7775 | 1.63 |
Таблица 4.6
Данные потенциометрического титрования, равновесные концентрации частиц в системе, ионная сила, коэффициенты активности для расчета показателя константы диссоциации сульфаниловой кислоты по ур.(4.2) и (4.3)
| Vi | E, В | -lg a(SH+) | [H2An] | [HAn−] | [An2−] | I 0,5 | f1 | f2 | pK1 | pK2 |
| 0.2 | 0.185 | 3.7212 | 0.01587 | 0.0078 | 5.27E-08 | 0.06244 | 0.8152 | 0.4416 | 4.12 | 9.16 |
| 0.3 | 0.183 | 3.7501 | 0.01587 | 0.0083 | 5.64E-08 | 0.06456 | 0.8103 | 0.4311 | 4.12 | 9.19 |
| 0.4 | 0.181 | 3.7791 | 0.01587 | 0.0089 | 6.02E-08 | 0.06674 | 0.8053 | 0.4207 | 4.12 | 9.23 |
| 0.5 | 0.179 | 3.8176 | 0.01587 | 0.00974 | 6.58E-08 | 0.06978 | 0.7986 | 0.4067 | 4.13 | 9.28 |
| 0.8 | 0.173 | 3.9141 | 0.01587 | 0.01216 | 8.22E-08 | 0.07797 | 0.7810 | 0.3722 | 4.14 | 9.40 |
| 1.0 | 0.168 | 4.0106 | 0.01587 | 0.01518 | 1.03E-07 | 0.08713 | 0.7625 | 0.3382 | 4.15 | 9.53 |
| 1.2 | 0.162 | 4.1071 | 0.01329 | 0.01588 | 1.28E-07 | 0.08910 | 0.7587 | 0.3314 | 4.15 | 9.56 |
| 1.5 | 0.156 | 4.2035 | 0.01064 | 0.01588 | 1.60E-07 | 0.08910 | 0.7587 | 0.3314 | 4.15 | 9.56 |
| 1.8 | 0.145 | 4.3964 | 0.00682 | 0.01588 | 2.50E-07 | 0.08910 | 0.7587 | 0.3314 | 4.15 | 9.56 |
Продолжение табл. 4.6
| Vi | E, В | -lg a(SH+) | [H2An] | [HAn−] | [An2−] | I 0,5 | f1 | f2 | pK1 | pK2 |
| 2.0 | 0.121 | 4.8016 | 0.00268 | 0.01588 | 6.35E-07 | 0.08910 | 0.7587 | 0.3314 | 4.15 | 9.56 |
| 2.1 | 0.071 | 5.6505 | 0.00038 | 0.01588 | 4.48E-06 | 0.08915 | 0.7586 | 0.3313 | 4.15 | 9.56 |
| 2.2 | 0.025 | 6.4222 | 6.43E-05 | 0.01588 | 2.65E-05 | 0.08939 | 0.7581 | 0.3304 | 4.15 | 9.56 |
| 2.3 | -0.038 | 7.5123 | 5.23E-06 | 0.01588 | 0.000326 | 0.09268 | 0.7519 | 0.3196 | 4.15 | 9.57 |
| 2.5 | -0.082 | 8.2455 | 9.67E-07 | 0.01588 | 0.001763 | 0.10707 | 0.7259 | 0.2777 | 4.17 | 9.61 |
| 2.8 | -0.099 | 8.5445 | 4.86E-07 | 0.01588 | 0.003510 | 0.12230 | 0.7008 | 0.2413 | 4.18 | 9.66 |
| 3.0 | -0.112 | 8.7664 | 2.91E-07 | 0.01588 | 0.005851 | 0.14014 | 0.6742 | 0.2067 | 4.20 | 9.71 |
| 3.3 | -0.128 | 9.0365 | 1.56E-07 | 0.01588 | 0.010897 | 0.17243 | 0.6324 | 0.1600 | 4.23 | 9.79 |
| 3.5 | -0.136 | 9.1715 | 1.15E-07 | 0.01588 | 0.014872 | 0.19412 | 0.6081 | 0.1368 | 4.24 | 9.84 |
| 3.6 | -0.139 | 9.2198 | 1.03E-07 | 0.01517 | 0.015878 | 0.19834 | 0.6037 | 0.1328 | 4.27 | 9.85 |
| 3.7 | -0.145 | 9.3162 | 8.21E-08 | 0.01215 | 0.015878 | 0.19450 | 0.6077 | 0.1364 | 4.36 | 9.84 |
| 3.8 | -0.110 | 9.4127 | 6.58E-08 | 0.00973 | 0.015878 | 0.19136 | 0.6111 | 0.1394 | 4.45 | 9.84 |
Таблица 4.7
Статистическая обработка результатов определения констант диссоциации одно- и двухосновных кислот
| № пп | Объект исследования (кислота) | Число опытов | рК1 ± ΔрК | рК2 ± ΔрК |
| 01. | Бензойная | 5 | 10.15 ± 0.06 | |
| 02. | Пикриновая | 5 | 1.62 ± 0.01 | |
| 05. | Сульфаниловая | 4 | 4.19 ± 0.26 | 9.57 ± 0.41 |
4.1.4.2. Ароматические дикарбоновые кислоты
В опубликованных ранее работах по проблемам переноса [10, 11, 12] (электропроводность, теплопроводность, вязкость и диффузия в растворах электролитов) едва ли не самым важным параметром являлась степень диссоциации. В самом деле, можно проводить прецизионные измерения сигналов, точно рассчитывать кинетические свойства, но если некорректно введена степень диссоциации для учета ионной составляющей раствора, то разброс может быть таким, что потеряется всякий смысл в исследовании.
Например, если α = 1.0, то конечная величина равна условным 100 единицам при соблюдении всех мер предосторожности и предварительных точных расчетов или измерений. Если же степень диссоциации α = 0.5, получим конечную условную величину 50 единиц, то есть разброс конечных величин составит 200%.
В данной работе (несколько ранее) была показана возможность более приемлемого подхода к оценке ионной составляющей раствора электролита, которая представляет произведение общей концентрации на степень диссоциации. Степень диссоциации α дает прямой выход на термодинамические константы по известному уравнению (закону разбавления) Оствальда.
В качестве примера оценки ионных сил, применимости коэффициентов активности по Дэвису и определения термодинамических констант диссоциации ароматических двухосновных кислот [30, 33] в табл. 4.8, 4.9 и 4.10 приведены необходимые данные, включающие все фрагменты в буферных областях от 25 до 75% нейтрализации двухосновной о–фталевой (табл. 4.8), изофталевой (табл. 4.9) и терефталевой (табл. 4.10) кислот гуанидином в ДМФ: потенциал электродной системы в зависимости от объема добавленного титранта, логарифмы концентраций всех равновесных частиц, образующихся при диссоциации дикислоты, полный учет которых дает возможность объективной оценки ионной силы, коэффициентов активности по Дэвису и соответствующих величин показателей термодинамических констант диссоциации, определяемых соотношениями:
![]() ,
, ![]() (4.2)
(4.2)
![]() ,
,![]() (4.3)
(4.3)
На рис. 4.9, 4.11 и 4.13 представлены кривые потенциометрического титрования исследуемых кислот раствором гуанидина в среде ДМФ, характеризующихся совместной нейтрализацией обеих карбоксильных групп, кроме о-фталевой и терефталевой кислот, имеющих по два скачка титрования. На рис. 4.10, 4.12 и 4.14 нанесены упомянутые выше логарифмические диаграммы «lg a(SH+) − lg C», позволяющие оценить равновесные концентрации всех заряженных и незаряженных частиц (сольватированных нейтральных молекул и ионов), образующихся при диссоциации кислоты и при титровании ее сильным основанием.
Таблица 4.8
Данные для определения ионной силы, коэффициентов активности и термодинамических констант диссоциации 0.03718 н. раствора о–фталевой кислоты титрованием гуанидином в среде ДМФ
| Vi | E, B | -lg a(SH+) | lg [H2An] | lg [HАn−] | lg [An2−] | I 0,5 | f1 | f2 | pK1 | pK2 |
| 0.4 | 0.055 | 6.027 | -1.730 | -2.253 | -6.633 | 0.0528 | 0.8254 | 0.4632 | 6.63 | 10.65 |
| 0.6 | 0.046 | 6.183 | -1.730 | -2.097 | -6.477 | 0.0631 | 0.8132 | 0.4362 | 6.64 | 10.85 |
| 0.8 | 0.040 | 6.286 | -1.730 | -1.994 | -6.374 | 0.0711 | 0.8003 | 0.4090 | 6.66 | 10.99 |
| 1.0 | 0.038 | 6.321 | -1.730 | -1.960 | -6.340 | 0.0740 | 0.7935 | 0.3954 | 6.66 | 11.04 |
| 1.2 | 0.036 | 6.355 | -1.730 | -1.925 | -6.305 | 0.0770 | 0.7831 | 0.3749 | 6.66 | 11.08 |
| 1.4 | 0.029 | 6.476 | -1.730 | -1.804 | -6.184 | 0.0885 | 0.7723 | 0.3545 | 6.68 | 11.25 |
| 1.5 | 0.025 | 6.545 | -1.730 | -1.735 | -6.115 | 0.0958 | 0.7649 | 0.3409 | 6.69 | 11.35 |
| 1.8 | 0.023 | 6.579 | -1.730 | -1.730 | -6.081 | 0.0964 | 0.7534 | 0.3208 | 6.72 | 11.36 |
| 2.0 | 0.021 | 6.614 | -1.794 | -1.730 | -6.046 | 0.0964 | 0.7416 | 0.3009 | 6.69 | 11.36 |
| 2.2 | 0.020 | 6.631 | -1.811 | -1.730 | -6.029 | 0.0964 | 0.7334 | 0.2877 | 6.69 | 11.36 |
| 2.4 | 0.018 | 6.665 | -1.846 | -1.730 | -5.995 | 0.0964 | 0.7334 | 0.2876 | 6.69 | 11.36 |
| 2.5 | 0.015 | 6.717 | -1.897 | -1.730 | -5.943 | 0.0964 | 0.7333 | 0.2876 | 6.69 | 11.36 |
| 2.7 | 0.011 | 6.786 | -1.966 | -1.730 | -5.874 | 0.0964 | 0.7333 | 0.2875 | 6.69 | 11.36 |
| 2.8 | 0.005 | 6.889 | -2.070 | -1.730 | -5.771 | 0.0964 | 0.7333 | 0.2875 | 6.69 | 11.36 |
| 2.9 | -0.005 | 7.062 | -2.242 | -1.730 | -5.598 | 0.0964 | 0.7333 | 0.2875 | 6.69 | 11.36 |
| 3.0 | -0.020 | 7.320 | -2.501 | -1.730 | -5.340 | 0.0964 | 0.7332 | 0.2874 | 6.69 | 11.36 |
| 3.1 | -0.100 | 8.700 | -3.880 | -1.730 | -3.960 | 0.0975 | 0.7331 | 0.2873 | 6.69 | 11.36 |
| 3.2 | -0.150 | 9.562 | -4.742 | -1.730 | -3.098 | 0.1043 | 0.7331 | 0.2872 | 6.70 | 11.39 |
| 3.3 | -0.165 | 9.820 | -5.001 | -1.730 | -2.840 | 0.1104 | 0.7330 | 0.2870 | 6.71 | 11.41 |
| 3.5 | -0.178 | 10.04 | -5.225 | -1.730 | -2.615 | 0.1189 | 0.7326 | 0.2864 | 6.72 | 11.45 |
| 3.6 | -0.184 | 10.14 | -5.329 | -1.730 | -2.512 | 0.1242 | 0.7323 | 0.2859 | 6.73 | 11.47 |
| 3.7 | -0.190 | 10.25 | -5.432 | -1.730 | -2.409 | 0.1307 | 0.7314 | 0.2845 | 6.73 | 11.49 |
| 3.8 | -0.195 | 10.33 | -5.518 | -1.730 | -2.322 | 0.1371 | 0.7207 | 0.2680 | 6.74 | 11.52 |
| 3.9 | -0.200 | 10.42 | -5.604 | -1.730 | -2.236 | 0.1445 | 0.6889 | 0.2233 | 6.75 | 11.55 |
| 4.0 | -0.205 | 10.51 | -5.691 | -1.730 | -2.150 | 0.1531 | 0.6318 | 0.1572 | 6.76 | 11.58 |
| 4.2 | -0.215 | 10.68 | -5.863 | -1.730 | -1.977 | 0.1741 | 0.5995 | 0.1270 | 6.79 | 11.65 |
| 4.4 | -0.225 | 10.85 | -6.035 | -1.730 | -1.805 | 0.2014 | 0.5813 | 0.1119 | 6.82 | 11.75 |
| 4.6 | -0.235 | 11.02 | -6.208 | -1.828 | -1.730 | 0.2112 | 0.5657 | 0.1001 | 6.93 | 11.78 |
| 4.8 | -0.245 | 11.20 | -6.380 | -2.000 | -1.730 | 0.2053 | 0.5617 | 0.0972 | 7.09 | 11.76 |
| 5.0 | -0.255 | 11.37 | -6.553 | -2.173 | -1.730 | 0.2013 | 0.5576 | 0.0944 | 7.26 | 11.75 |
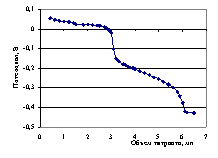
Рис.4.9. Кривая потенциометрического титрования 0.03718 н. раствора о-фталевой кислоты 0.1549 н. раствором гуанидина в среде ДМФ.
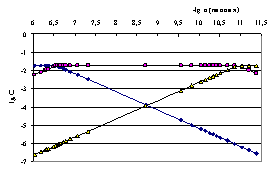
Рис.4.10. Логарифмическая диаграмма оценки равновесных концентраций при взаимодействии о-фталевой кислоты с гуанидином в среде ДМФ (◊ - концентрация кислоты Н2Аn, ? - иона HAn−, ? - иона An2−)
Статистическая обработка (Приложение IV) определенных экспериментально термодинамических констант диссоциации ароматических дикарбоновых кислот в среде ДМФ приводит к доверительным интервалам, внутри которых с вероятностью 0.95 находятся экспериментальные величины рК1 и рК2 (табл. 4.11),
Таблица 4.9
Данные для определения ионной силы, коэффициентов активности и термодинамических констант диссоциации 0.01687 н. раствора изофталевой кислоты титрованием гуанидином в среде ДМФ
| Vi | E, B | -lg a(SH+) | lg [H2An] | lg [HAn−] | lg [An2−] | I 0,5 | f1 | f2 | pK1 | pK2 |
| 0.1 | -0.137 | 9.3584 | -2.0740 | -2.2356 | -2.6156 | 0.0880 | 0.7385 | 0.2959 | 9.65 | 10.13 |
| 0.2 | -0.140 | 9.4111 | -2.0740 | -2.1829 | -2.5629 | 0.0935 | 0.7259 | 0.2760 | 9.66 | 10.21 |
| 0.3 | -0.142 | 9.4462 | -2.0740 | -2.1477 | -2.5277 | 0.0974 | 0.7172 | 0.2630 | 9.66 | 10.26 |
| 0.4 | -0.143 | 9.4638 | -2.0740 | -2.1302 | -2.5102 | 0.0994 | 0.7129 | 0.2565 | 9.66 | 10.28 |
| 0.5 | -0.144 | 9.4814 | -2.0740 | -2.1126 | -2.4926 | 0.1014 | 0.7085 | 0.2501 | 9.66 | 10.31 |
| 0.6 | -0.145 | 9.4989 | -2.0740 | -2.0950 | -2.4750 | 0.1035 | 0.7040 | 0.2438 | 9.67 | 10.33 |
| 0.7 | -0.146 | 9.5165 | -2.0740 | -2.0775 | -2.4575 | 0.1056 | 0.6995 | 0.2375 | 9.67 | 10.36 |
| 0.8 | -0.147 | 9.5341 | -2.0881 | -2.0740 | -2.4399 | 0.1071 | 0.6963 | 0.2332 | 9.67 | 10.37 |
| 0.9 | -0.148 | 9.5516 | -2.1056 | -2.0740 | -2.4223 | 0.1085 | 0.6934 | 0.2292 | 9.68 | 10.38 |
| 1.0 | -0.149 | 9.5692 | -2.1232 | -2.0740 | -2.4048 | 0.1099 | 0.6904 | 0.2253 | 9.68 | 10.38 |
| 1.1 | -0.150 | 9.5868 | -2.1408 | -2.0740 | -2.3872 | 0.1114 | 0.6873 | 0.2213 | 9.68 | 10.39 |
| 1.2 | -0.151 | 9.6044 | -2.1584 | -2.0740 | -2.3696 | 0.1129 | 0.6842 | 0.2173 | 9.68 | 10.39 |
| 1.3 | -0.152 | 9.6219 | -2.1759 | -2.0740 | -2.3520 | 0.1145 | 0.6811 | 0.2133 | 9.68 | 10.40 |
| 1.4 | -0.153 | 9.6395 | -2.1935 | -2.0740 | -2.3345 | 0.1161 | 0.6779 | 0.2092 | 9.69 | 10.41 |
| 1.5 | -0.154 | 9.6571 | -2.2111 | -2.0740 | -2.3169 | 0.1177 | 0.6746 | 0.2051 | 9.69 | 10.41 |
| 1.6 | -0.155 | 9.6746 | -2.2286 | -2.0740 | -2.2993 | 0.1194 | 0.6713 | 0.2010 | 9.69 | 10.42 |
| 1.7 | -0.156 | 9.6922 | -2.2462 | -2.0740 | -2.2818 | 0.1211 | 0.6679 | 0.1969 | 9.69 | 10.43 |
| 1.8 | -0.157 | 9.7098 | -2.2638 | -2.0740 | -2.2642 | 0.1229 | 0.6644 | 0.1928 | 9.69 | 10.43 |
| 1.9 | -0.158 | 9.7273 | -2.2813 | -2.0740 | -2.2466 | 0.1247 | 0.6609 | 0.1887 | 9.70 | 10.44 |
| 2.0 | -0.160 | 9.7625 | -2.3165 | -2.0740 | -2.2115 | 0.1285 | 0.6537 | 0.1805 | 9.70 | 10.45 |
| 2.1 | -0.163 | 9.8152 | -2.3692 | -2.0740 | -2.1588 | 0.1345 | 0.6424 | 0.1682 | 9.71 | 10.48 |
| 2.2 | -0.166 | 9.8679 | -2.4219 | -2.0740 | -2.1061 | 0.1410 | 0.6306 | 0.1560 | 9.72 | 10.50 |
| 2.3 | -0.170 | 9.9382 | -2.4922 | -2.1122 | -2.0740 | 0.1440 | 0.6254 | 0.1508 | 9.76 | 10.51 |
| 2.4 | -0.175 | 10.0260 | -2.5800 | -2.2001 | -2.0740 | 0.1415 | 0.6297 | 0.1551 | 9.84 | 10.50 |
| 2.5 | -0.180 | 10.1139 | -2.6679 | -2.2879 | -2.0740 | 0.1394 | 0.6334 | 0.1588 | 9.93 | 10.50 |
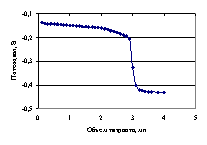
Рис. 4.11. Кривая потенциометрического титрования 0.01687 н. раствора изофталевой кислоты 0.1381 н. раствором гуанидина в среде ДМФ
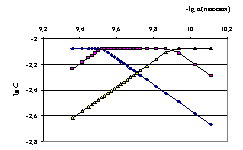
Рис. 4.12. Логарифмическая диаграмма оценки равновесных концентраций при взаимодействии изофталевой кислоты с гуанидином в среде ДМФ (◊ - концентрация кислоты Н2Аn, ? - иона HAn−, ? - иона An2−).
Таблица 4.10
Данные для определения ионной силы, коэффициентов активности и термодинамических констант диссоциации 0.03250 н. раствора терефталевой кислоты титрованием гуанидином в среде ДМФ
| Vi | E, B | -lg a(SH+) | lg [H2An] | lg [HAn−] | lg [An2−] | I 0,5 | f1 | f2 | pK1 | pK2 |
| 0.4 | -0.044 | 7.7345 | -1.789 | -2.237 | -5.444 | 0.0538 | 0.8254 | 0.4632 | 8.26 | 11.19 |
| 0.5 | -0.048 | 7.8034 | -1.789 | -2.168 | -5.375 | 0.0583 | 0.8132 | 0.4362 | 8.27 | 11.28 |
| 0.6 | -0.052 | 7.8724 | -1.789 | -2.100 | -5.306 | 0.0631 | 0.8002 | 0.4090 | 8.28 | 11.37 |
| 0.7 | -0.054 | 7.9069 | -1.789 | -2.065 | -5.272 | 0.0656 | 0.7935 | 0.3954 | 8.28 | 11.41 |
Продолжение табл. 4.10
| Vi | E, B | -lg a(SH+) | lg [H2An] | lg [HAn−] | lg [An2−] | I 0,5 | f1 | f2 | pK1 | pK2 |
| 0.8 | -0.057 | 7.9586 | -1.789 | -2.013 | -5.220 | 0.0697 | 0.7831 | 0.3749 | 8.28 | 11.48 |
| 0.9 | -0.060 | 8.0103 | -1.789 | -1.962 | -5.168 | 0.0740 | 0.7723 | 0.3545 | 8.29 | 11.55 |
| 1.0 | -0.062 | 8.0448 | -1.789 | -1.927 | -5.134 | 0.0770 | 0.7649 | 0.3409 | 8.29 | 11.60 |
| 1.1 | -0.065 | 8.0965 | -1.789 | -1.875 | -5.082 | 0.0817 | 0.7534 | 0.3208 | 8.30 | 11.67 |
| 1.2 | -0.068 | 8.1483 | -1.789 | -1.824 | -5.031 | 0.0867 | 0.7416 | 0.3009 | 8.31 | 11.74 |
| 1.3 | -0.070 | 8.1827 | -1.789 | -1.789 | -4.996 | 0.0902 | 0.7334 | 0.2877 | 8.31 | 11.79 |
| 1.4 | -0.073 | 8.2345 | -1.840 | -1.789 | -4.944 | 0.0902 | 0.7334 | 0.2876 | 8.31 | 11.79 |
| 1.5 | -0.075 | 8.2690 | -1.875 | -1.789 | -4.910 | 0.0902 | 0.7333 | 0.2876 | 8.31 | 11.79 |
| 1.6 | -0.077 | 8.3034 | -1.909 | -1.789 | -4.875 | 0.0903 | 0.7333 | 0.2876 | 8.31 | 11.79 |
| 1.7 | -0.079 | 8.3379 | -1.944 | -1.789 | -4.841 | 0.0903 | 0.7333 | 0.2875 | 8.31 | 11.79 |
| 1.8 | -0.081 | 8.3724 | -1.978 | -1.789 | -4.806 | 0.0903 | 0.7333 | 0.2875 | 8.31 | 11.79 |
| 1.9 | -0.084 | 8.4241 | -2.030 | -1.789 | -4.755 | 0.0903 | 0.7332 | 0.2874 | 8.31 | 11.79 |
| 2.0 | -0.087 | 8.4758 | -2.082 | -1.789 | -4.703 | 0.0903 | 0.7331 | 0.2873 | 8.31 | 11.79 |
| 2.1 | -0.090 | 8.5276 | -2.133 | -1.789 | -4.651 | 0.0904 | 0.7331 | 0.2872 | 8.31 | 11.79 |
| 2.2 | -0.094 | 8.5965 | -2.202 | -1.789 | -4.582 | 0.0904 | 0.7330 | 0.2870 | 8.31 | 11.79 |
| 2.3 | -0.105 | 8.7862 | -2.392 | -1.789 | -4.393 | 0.0906 | 0.7326 | 0.2865 | 8.31 | 11.79 |
| 2.4 | -0.112 | 8.9069 | -2.513 | -1.789 | -4.272 | 0.0907 | 0.7323 | 0.2859 | 8.31 | 11.79 |
| 2.5 | -0.125 | 9.1310 | -2.737 | -1.789 | -4.048 | 0.0911 | 0.7314 | 0.2845 | 8.32 | 11.80 |
| 2.6 | -0.170 | 9.9069 | -3.513 | -1.789 | -3.272 | 0.0959 | 0.7206 | 0.2680 | 8.32 | 11.81 |
| 2.7 | -0.204 | 10.4931 | -4.099 | -1.789 | -2.686 | 0.1106 | 0.6889 | 0.2233 | 8.34 | 11.87 |
| 2.8 | -0.230 | 10.9414 | -4.547 | -1.789 | -2.237 | 0.1403 | 0.6318 | 0.1572 | 8.38 | 11.99 |
| 2.9 | -0.240 | 11.1138 | -4.720 | -1.789 | -2.065 | 0.1591 | 0.5995 | 0.1270 | 8.40 | 12.06 |
| 3.0 | -0.245 | 11.2000 | -4.806 | -1.789 | -1.979 | 0.1706 | 0.5813 | 0.1119 | 8.41 | 12.10 |
| 3.1 | -0.249 | 112689 | -4.875 | -1.789 | -1.910 | 0.1809 | 0.5657 | 0.1001 | 8.43 | 12.14 |
| 3.2 | -0.250 | 112862 | -4.892 | -1.789 | -1.893 | 0.1836 | 0.5617 | 0.0972 | 8.43 | 12.15 |
| 3.3 | -0.251 | 11.3034 | -4.909 | -1.789 | -1.875 | 0.1864 | 0.5576 | 0.0944 | 8.43 | 12.16 |
| 3.4 | -0.252 | 11.3207 | -4.927 | -1.789 | -1.858 | 0.1893 | 0.5535 | 0.0915 | 8.44 | 12.17 |
| 3.5 | -0.253 | 11.3379 | -4.944 | -1.789 | -1.841 | 0.1922 | 0.5493 | 0.0887 | 8.44 | 12.18 |
| 3.6 | -0.254 | 11.3552 | -4.961 | -1.789 | -1.824 | 0.1952 | 0.5451 | 0.0860 | 8.44 | 12.19 |
| 3.7 | -0.255 | 11.3724 | -4.978 | -1.789 | -1.806 | 0.1983 | 0.5408 | 0.0833 | 8.45 | 12.20 |
| 3.8 | -0.256 | 11.3896 | -4.995 | -1.789 | -1.789 | 0.2015 | 0.5365 | 0.0806 | 8.45 | 12.21 |
| 3.9 | -0.257 | 11.4067 | -5.013 | -1.806 | -1.789 | 0.2008 | 0.5375 | 0.0812 | 8.46 | 12.21 |
| 4.0 | -0.259 | 11.4414 | -5.047 | -1.840 | -1.789 | 0.1993 | 0.5395 | 0.0824 | 8.50 | 12.20 |
Продолжение табл. 4.10
| Vi | E, B | -lg a(SH+) | lg [H2An] | lg [HAn−] | lg [An2−] | I 0,5 | f1 | f2 | pK1 | pK2 |
| 4.1 | -0.261 | 11.4759 | -5.082 | -1.875 | -1.789 | 0.1979 | 0.5414 | 0.0836 | 8.53 | 12.20 |
| 4.2 | -0.263 | 11.5103 | -5.116 | -1.909 | -1.789 | 0.1966 | 0.5432 | 0.0848 | 8.56 | 12.19 |
| 4.3 | -0.265 | 11.5448 | -5.151 | -1.944 | -1.789 | 0.1954 | 0.5448 | 0.0858 | 8.60 | 12.19 |
| 4.4 | -0.268 | 11.5965 | -5.202 | -1.995 | -1.789 | 0.1938 | 0.5471 | 0.0873 | 8.65 | 12.18 |
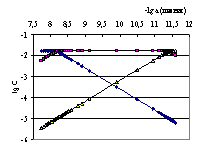
Рис. 4.13. Кривая потенциометрического титрования 0.03250 н. раствора терефталевой кислоты 0.1635 н. раствором гуанидина в среде ДМФ
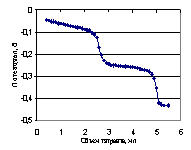
Рис. 4.14. Логарифмическая диаграмма оценки равновесных концентраций при взаимодействии терефталевой кислоты с гуанидином в среде ДМФ (◊ - концентрация кислоты Н2Аn, ? - иона HAn−, ? - иона An2−).
Таблица 4.11
Статистическая обработка определенных величин показателей термодинамических констант диссоциации дикарбоновых ароматических кислот в среде ДМФ
| № | Кислота | Число точек | Доверительный интервал |
| 3. | о – Фталевая | 30 | рК1 = 6.95 ± 0.31 |
| 4. | Изофталевая | 25 | рК1 = 9.79 ± 0.14 |
| 5. | Терефталевая | 41 | рК1 = 8.46 ± 0.19 |
