
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
5.1. Термодинамические константы диссоциации протонированных четырехкислотных оснований
Термодинамические константы диссоциации протонированного основания определяются следующими соотношениями [44, 45]:
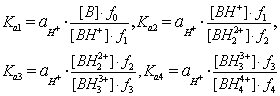 (5.1)
(5.1)
В уравнении (5.1) ![]() - активность ионов лиония, то есть сольватированного иона водорода, в последующем примем обозначение а(SH+), в любой точке потенциометрического титрования;
- активность ионов лиония, то есть сольватированного иона водорода, в последующем примем обозначение а(SH+), в любой точке потенциометрического титрования; ![]() ,
, ![]() - равновесные концентрации нейтрального и протонированного четырехкислотного основания в процессе титрования сильной кислотой;
- равновесные концентрации нейтрального и протонированного четырехкислотного основания в процессе титрования сильной кислотой; ![]() - коэффициенты активности нейтральной и протонированных форм полиоснования.
- коэффициенты активности нейтральной и протонированных форм полиоснования.
Как отмечалось ранее [31, 45], известные методы оценок ионной силы при кислотно-основном равновесии [9, 24, 25, 29] основаны на использовании концентрации первой ионизированной частицы, например, [ВH+] для двухкислотного основания. Было показано [7, 31, 40, 44], что в расчетах констант диссоциации не следует пренебрегать равновесными концентрациями остальных ионов, так как их величины в различных точках титрования сопоставимы с концентрацией первого протонированного иона, а из данных табл. 5.2 и рис. 5.1 видно, что в процессе протонирования концентрации последующих ионов (например, даже ![]() ) превышают таковые иона [ВH+].
) превышают таковые иона [ВH+].
Наиболее приемлемым способом оценки ионной силы, определяемой с учетом равновесных концентраций всех заряженных частиц, является представление кривой титрования основания в логарифмических координатах [7, 31, 44, 45]. При этом равновесные концентрации всех частиц, образующихся при титровании четырехкислотного основания сильной одноосновной хлорной кислотой ![]() ,
,![]() , могут быть определены на диаграммах -lg а(SH+)– lgC. Оценка значений коэффициентов активности f0, f1, f2, f3 и f4 проводится по более оптимальному методу Дэвиса [9]:
, могут быть определены на диаграммах -lg а(SH+)– lgC. Оценка значений коэффициентов активности f0, f1, f2, f3 и f4 проводится по более оптимальному методу Дэвиса [9]:
![]() (4.5)
(4.5)
Измерения ЭДС и потенциометрическое титрование в среде диметилформамида (ДМФ) осуществляли при 25.0 ± 0.20С на рН-метре-милливольтметре METROHM-632 (Швейцария). Растворитель очищен и обезвожен по известным методикам [39, 41]. Содержание воды, определенное модифицированным методом К.Фишера [39], не превышало для ДМФ ±0.02 мас.%.
В табл. 5.1 приведены данные измерения ЭДС цепи (I) в среде ДМФ в зависимости от моляльной концентрации хлорной кислоты, а также результаты оценки степени диссоциации HClО4 и исходные величины для расчета стандартного потенциала цепи.
Таблица 5.1
Изменение ЭДС цепи (I) в зависимости от моляльной концентрации хлорной кислоты (m, моль HClO4/1000г ДМФ) и данные для определения Е0 цепи (I)
| m | E, B | α (HClO4) | −0.0581×lg (mα) | (m×α)0.5 | E’ |
| 0.1371 | 0.340 | 0.3694 | 1.2954 | 0.2250 | 0.4164 |
| 0.06855 | 0.330 | 0.5342 | 1.4363 | 0.1913 | 0.4147 |
| 0.03427 | 0.320 | 0.6559 | 1.6482 | 0.1499 | 0.4172 |
| 0.01713 | 0.309 | 0.7358 | 1.8995 | 0.1123 | 0.4211 |
| 0.008565 | 0.295 | 0.7719 | 2.1797 | 0.0813 | 0.4236 |
| 0.004282 | 0.275 | 0.7511 | 2.4927 | 0.0567 | 0.4221 |
Степень диссоциации хлорной кислоты может быть оценена по уравнению (5.2) [7, 26, 31, 44, 45].
![]() (4.10)
(4.10)
Величина ![]() , равная разности
, равная разности ![]() (
(![]() ), определена по программе для выполнения расчета нормального потенциала цепи без переноса Е* (Приложение I) по зависимости
), определена по программе для выполнения расчета нормального потенциала цепи без переноса Е* (Приложение I) по зависимости ![]() при lg m = 0. Получена величина
при lg m = 0. Получена величина ![]() = 0.3791 с коэффициентом регрессии r = 0.9895.
= 0.3791 с коэффициентом регрессии r = 0.9895.
Значение стандартного потенциала цепи (I) определено по авторской компьютерной программе расчета параболической функции y = a0×xn + a1×xn-1 + ... + an для определения стандартных потенциалов Е0 (стандартных ЭДС) электрохимических цепей (Приложение II) по приближению функции ![]() при
при ![]() , где
, где ![]() .
.
![]() , r = 0.9090.
, r = 0.9090.
Таким образом, получена величина стандартного потенциала цепи (I) в среде ДМФ, равная Ео = 0.4272 В.
Стандартный потенциал цепи (I), наряду с равновесными концентрациями нейтральной молекулы основания и заряженных частиц ![]() ,
, ![]() , образующихся в процессе титрования основания, оцененных по табл. 5.2 и рис. 5.1, и их коэффициентами активностей
, образующихся в процессе титрования основания, оцененных по табл. 5.2 и рис. 5.1, и их коэффициентами активностей ![]() и f4 дают возможность определения термодинамических констант кислотности протонированных полиоснований в среде органических растворителей [45].
и f4 дают возможность определения термодинамических констант кислотности протонированных полиоснований в среде органических растворителей [45].
Оценка активности лионий-ионов в процессе титрования основания возможна по уравнению Нернста:
![]() .
.
Рассматриваемая методика, отличающаяся от известных применением логарифмических зависимостей при оценке ионной силы и коэффициентов активности ионов, как отмечалось в [45], была апробирована на примере 1,3-дифенилгуанидина (ДФГ) в среде ДМФ. В литературе [43] известна величина рКа (ДФГ/ДМФА) = 9.1. Нами было [44] получено значение рКа (ДФГ/ДМФА) = 9.15 ± 0.03, свидетельствующее о достаточной надежности и воспроизводимости предлагаемого метода.
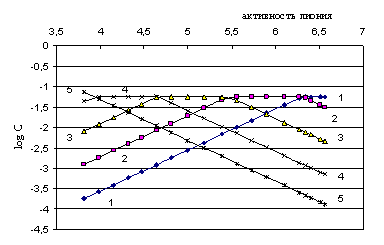
Рис. 5.1. Логарифмическая диаграмма процесса титрования 0,05652н. раствора 3,3’4,4’-тетрааминодифенилоксида 0.1295 н. раствором хлорной кислоты в среде ДМФ, дающая возможность определения концентраций равновесных частиц: 1-1: lg [B], 2-2: lg[BH+], 3-3: lg[BH22+], 4-4: lg[BH33+], 5-5: lg[BH44+]
В табл. 5.2 сведены все исходные данные для расчета констант диссоциации по уравнениям (5.1) и (5.2) при титровании 0.01413М (0.05652н.) раствора 3,3’4,4’-тетрааминодифенилоксида, широко применяемого в синтезе полибензимидазолов, 0.1295 н. раствором хлорной кислоты в среде ДМФ [45].
Как видно из табл. 5.2 и рисунка, равновесные концентрации частиц, находящихся в титруемом растворе, вполне сопоставимы.
Поэтому подчеркнем, что в расчетах рКа все концентрации должны быть учтены. Протонированные четырехкислотные основания характеризуются близостью констант кислотности, подтверждаемой одним совместным скачком потенциала на кривой потенциометрического титрования, которую мы здесь не приводим.
Рассчитанные в соответствующих буферных областях величины термодинамических констант диссоциации протонированного 3,3’4,4’-тетрааминодифенилоксида в среде ДМФ равны: рК1 = 6.03 ± 0.05, рК2 = 5.01 ± 0.08, рК3 = 4.03 ± 0.06, рК4 = 3.27 ± 0.12.
Разработанная методика определения термодинамических констант кислотности полиоснований в среде органических растворителей вполне приемлема при экспериментальном определениирКа любых четырехкислотных оснований при многостадийном протонировании (равно как и трехкислотных оснований [45]).
Таблица 5.2
Расчет констант диссоциации протонированного 3,3’4,4’-тетрааминодифенилоксида в среде ДМФ по ур.(5.1) и (5.2)
| V,мл | E, B | -lgа(SH+) | [B] | [BH+] | [BH22+] | [BH33+] | [BH44+] |
| 0.3 | 0.040 | 6.5593 | 0.05652 | 0.03183 | 0.00460 | 0.00071 | 0.00013 |
| 0.5 | 0.043 | 6.5085 | 0.05652 | 0.03578 | 0.00517 | 0.00080 | 0.00015 |
| 1.0 | 0.053 | 6.3390 | 0.05652 | 0.05287 | 0.00764 | 0.00118 | 0.00022 |
| 1.5 | 0.067 | 6.1017 | 0.03498 | 0.05652 | 0.01319 | 0.00204 | 0.00038 |
| 2.0 | 0.079 | 5.8983 | 0.02190 | 0.05652 | 0.02108 | 0.00326 | 0.00061 |
| 2.5 | 0.089 | 5.7288 | 0.01482 | 0.05652 | 0.03114 | 0.00482 | 0.00090 |
| 3.0 | 0.099 | 5.5593 | 0.01003 | 0.05652 | 0.04601 | 0.00713 | 0.00132 |
| 3.5 | 0.109 | 5.3898 | 0.00679 | 0.04699 | 0.05652 | 0.01053 | 0.00196 |
| 4.0 | 0.121 | 5.1864 | 0.00425 | 0.02942 | 0.05652 | 0.01681 | 0.00313 |
| 4.5 | 0.132 | 5.0000 | 0.00276 | 0.01915 | 0.05652 | 0.02583 | 0.00481 |
| 5.0 | 0.143 | 4.8135 | 0.00180 | 0.01246 | 0.05652 | 0.03968 | 0.00740 |
| 5.5 | 0.153 | 4.6440 | 0.00122 | 0.00844 | 0.05448 | 0.05652 | 0.01091 |
| 6.0 | 0.163 | 4.4745 | 0.00082 | 0.00571 | 0.03688 | 0.05652 | 0.01613 |
| 6.5 | 0.172 | 4.3220 | 0.00058 | 0.00402 | 0.02595 | 0.05652 | 0.02291 |
| 7.0 | 0.182 | 4.1525 | 0.00039 | 0.00272 | 0.01757 | 0.05652 | 0.03385 |
| 7.5 | 0.192 | 3.9830 | 0.00026 | 0.00184 | 0.01189 | 0.05652 | 0.05002 |
| 8.0 | 0.202 | 3.8135 | 0.00018 | 0.00124 | 0.00805 | 0.04322 | 0.07390 |
| 8.5 | 0.213 | 3.6271 | 0.00012 | 0.00081 | 0.00524 | 0.02814 | 0.11352 |
Продолжение табл. 5.2
| V,мл | f1 | f2 | f3 | f4 | рК1 | рК2 | рК3 | pK4 |
| 0.3 | 0.5801 | 0.3342 | 0.1925 | 0.1109 | 6.073 | − | − | − |
| 0.5 | 0.5644 | 0.3162 | 0.1771 | 0.0992 | 6.061 | − | − | − |
| 0.8 | 0.5327 | 0.2811 | 0.1483 | 0.0782 | 6.036 | − | − | − |
| 1.0 | 0.5114 | 0.2586 | 0.1308 | 0.0661 | 6.019 | − | − | − |
| 1.2 | 0.4965 | 0.2434 | 0.1193 | 0.0585 | 6.006 | − | − | − |
| 1.5 | 0.4682 | 0.2158 | 0.0995 | 0.0458 | 5.980 | − | − | − |
| 2.0 | 0.4280 | 0.1794 | 0.0752 | 0.0315 | − | 5.092 | − | − |
| 2.5 | 0.3905 | 0.1484 | 0.0563 | 0.0214 | − | 5.049 | − | − |
| 3.0 | 0.3513 | 0.1189 | 0.0402 | 0.0136 | − | 4.999 | − | − |
| 3.5 | 0.3271 | 0.1022 | 0.0319 | 0.0100 | − | 4.964 | − | − |
| 4.0 | 0.3116 | 0.0921 | 0.0272 | 0.0080 | − | 4.941 | − | − |
| 4.5 | 0.2905 | 0.0792 | 0.0216 | 0.0059 | − | − | 4.095 | − |
| 5.0 | 0.2652 | 0.0648 | 0.0158 | 0.0038 | − | − | 4.048 | − |
| 5.5 | 0.2434 | 0.0534 | 0.0117 | 0.0025 | − | − | 4.001 | − |
| 6.0 | 0.2425 | 0.0529 | 0.0115 | 0.0025 | − | − | 3.999 | − |
| 6.5 | 0.2370 | 0.0501 | 0.0106 | 0.0022 | − | − | 3.985 | − |
| 7.0 | 0.2265 | 0.0451 | 0.0090 | 0.0018 | − | − | − | 3.229 |
| 7.5 | 0.2131 | 0.0388 | 0.0071 | 0.0013 | − | − | − | 3.191 |
| 8.0 | 0.2028 | 0.0342 | 0.0057 | 0.0010 | − | − | − | 3.273 |
| 8.5 | 0.1893 | 0.0282 | 0.0042 | 0.0006 | − | − | − | 3.405 |
