
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

ПАРАТГОРМОН-РОДСТВЕННЫЙ ПРОТЕИН. 2-е издание переработанное и дополненное
Курзанов А. Н., Ледванов М. Ю., Быков И. М., Медведев В. Л., Стрыгина Е. А., Бизенкова М. Н., Заболотских Н. В., Ковалев Д. В., Стукова Н. Ю.,
5.2.1.1. Роль сигнального пути ПТГрП-Ihh в хондрогенезе
Существующая информация убедительно свидетельствуют о важной роли ПТГрП в регуляции созревания хондроцитов. Хондроциты зоны эпифизарного роста, проходят через упорядоченную программу дифференциации, которая регулируется при участии белков Ihh и ПТГрП. Эндохондральная оссификация является одним из событий развития, в которых передача сигналов Hedgehog (Hh) действует как главный регулятор. Среди трех белков Hh у млекопитающих индийский еж – Indian Hedgehog (Ihh), как известно, работает как основной вход Hh, который индуцирует биологические эффекты передачи сигналов Hh на эндохондральные события. Ihh продуцируется в прегипертрофированных и гипертрофированных хондроцитах развивающихся эндохондральных костей. Ihh-опосредованная активация передачи сигналов Hh синхронизирует хондрогенез косвенным образом через ПТГрП. Ihh, продуцируемый прегипертрофированными и гипертрофированными хондроцитами, индуцирует секрецию ПТГрП в периартикулярных областях, включая периартикулярные хондроциты и перихондрий. ПТГрП затем подавляет переход столбчатых пролиферирующих хондроцитов в гипертрофированные хондроциты через рецептор PTH1R, который сильно экспрессируется в прегипертрофированных хондроцитах и слабо в пролиферирующих хондроцитах. Подавление гипертрофии поддерживает хондроциты и увеличивает расстояние между клетками, продуцирующими ПТГрП, и клетками, продуцирующими Ihh. Чтобы измененить это расстояния, индуцируется изменение продукции ПТГрП. Пролиферация и созревание хондроцитов в пластине роста регулируется контуром обратной межклеточной связи, опосредованным секретируемыми сигнальными молекулами ПТГрП и Ihh (Lanske B. et al., 1996; Vortkamp A. et al., 1996). ПТГрП синтезируется и секретируется периартикулярными перихондриальными клетками и хондроцитами позже в развитии. Он функционирует как паттерн-молекула, ингибируя гипертрофию хондроцитов вблизи суставных концов развивающейся кости, тем самым сохраняя пул пролиферирующих клеток (St-Jacques B. et al., 1999). Уменьшенная экспрессия ПТГрП уменьшает ширину пластины роста (Karp S.J. et al., 2000). Ihh, член семейства лигандов, связанных с клеточной поверхностью, экспрессируется в постмитотических, догипертрофных клетках и обеспечивает сигнал для поддержания экспрессии ПТГрП на концах развивающейся кости (Vortkamp A. et al., 1996). Путем ингибирования созревания хондроцитов ПТГрП подавляет Ihh в клетках около концов кости. Ihh способствует пролиферации хондроцитов и влияет на рост длины кости через ПТГрП-зависимые и ПТГрП-независимые механизмы (Karp S.J. et al., 2000). Экспрессия Ihh может быть модулирована биохимическими факторами, такими как костные морфогенетические белки и ростовые факторы (Kronenberg H.M., 2003; Minina et al., 2002; Stevens, Williams, 1999) и механической нагрузкой (Wu Q. et al., 2001) (рис. 12). Связанный Ihh секретируется в хряще, а в пластине роста он колокализуется с костным морфогенетическим белком-6 (BMP-6) в области постпролиферативных хондроцитов, прилегающих к гипертрофическим клеткам (Vortkamp A. et al., 1996; Bitgood M.J., McMahon A.P., 1995). Показано, что чрезмерная экспрессия ПТГрП, сверхэкспрессия Ihh или Shh задерживает гипертрофию хондроцитов и мизэкспрессию Ihh внутри кости, что нарушает эндохондральную оссификацию. Vortkamp et al. (1996) на этом основании предложили модель, в которой ПТГрП взаимно ингибирует экспрессию Ihh, формируя таким образом петлю отрицательной обратной связи, чтобы уменьшить скорость гипертрофии хондроцитов в пластине роста. Они также продемонстрировали, что чрезмерная экспрессия Ihh блокирует экспрессию BMP-6. Способность Ihh индуцировать как ПТГрП, так и BMP обеспечивает строго контролируемое прогрессирование созревания в пластине роста. Авторы привели доказательства того, что добавление BMP индуцирует экспрессию Ihh на высоком уровне даже в присутствии ПТГрП. Поэтому они заключили, что ингибирование в контуре обратной связи этих двух регуляторов созревания является косвенным и, что BMP-6 является положительным медиатором экспрессии Ihh в гипертрофических хондроцитах (рис. 11).
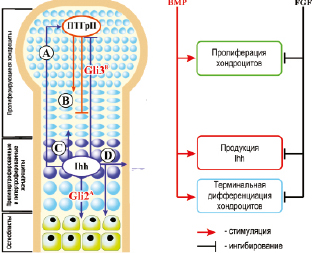
Рис. 11. Взаимодействия ПТГрП, Ihh, факторов транскрипции Gli, костных морфогенных белков и фактора роста фибробластов в ростовой пластине. ПТГрП и Ihh действуют как часть цикла отрицательной обратной связи, регулирующего пролиферацию и дифференцировку хондроцитов. Программа дифференцировки хондроцитов происходит от недифференцированных хондроцитов в конце кости
до пролиферирующих столбчатых хондроцитов, а затем до гиперпертрофированных и терминально дифференцированных гипертрофических хондроцитов. ПТГрП секретируется перихондриальными клетками и хондроцитами на концах длинных костей (B). ПТГрП действует на рецепторы на пролиферирующих хондроцитах, чтобы поддерживать пролиферацию хондроцитов и замедлять продукцию Ihh. Когда источник продукции ПТГрП достаточно удален, образуется Ihh, воздействующий на свой рецептор на хондроцитах, чтобы увеличить скорость пролиферации (C),
и, используя не вполне понятный механизм, стимулирует продукцию ПТГрП на концах костей (A). Синтез Ihh гипертрофическими хондроцитами начинается, когда сигнал ПТГрП уже не в состоянии достигнуть этих клеток. Ihh увеличивает пролиферацию и ускоряет дифференцировку в прегипертрофированных хондроцитах, способствует формированию остеобластов. Ihh воздействует на перихондриальные клетки для преобразования этих клеток в остеобласты костного воротника (D). ПТГрП влияет на прогрессирование хондроцитов ростовой пластинки от пролиферативной до гипертрофической зоны, регулируя активность факторов транскрипции – активатора Gli2 и репрессора Gli3 в качестве эффекторов Ihh- сигнализации в развитии эндохондральной кости. Фактор роста фибробластов (FGF) ингибирует пролиферацию хондроцитов, продукцию Ihh и дифференциацию гипертрофических хондроцитов в терминально дифференцированные хондроциты. Костные морфогенные белки (BMP) на каждом из этих этапов индуцируют эффекты, противоположным действию FGF
Способность BMP-6 индуцировать Ihh может быть прямой или косвенной, стимулируя созревания клетки и, в свою очередь, увеличивая Ihh. Minina E. et al. (2001) в экспериментах на органной клеточной культуре эксплантатов конечностей мышиных и куриных эмбрионов исследовали дифференцировку хондроцитов, добавляя в эти культуры BMP2, ПТГрП и Sonic hedgehog в качестве активаторов, либо белок ноггин в качестве ингибитора сигналов BMP (Kawabata M. et al., 1998; Zimmerman L.B. et al., 1996) и стероидный алкалоид циклопамин для ингибирования передачи сигнала Ihh в клетках-мишенях и сигнального пути Ihh/ПТГрП (Incardona J.P. et al., 1998; Cooper M.K. et al., 1998; Taipale J. et al., 2000). Сверхэкспрессия Ihh в хрящевых элементах трансгенных мышей приводила к усилению экспрессии ПТГрП и задержке начала гипертрофической дифференцировки. Введение ноггина в культуральную средумышей не привело к антагонизму эффектов сверхэкспрессии Ihh. И наоборот, стимулирование созревания хондроцитов, вызванное циклопамином, которое блокирует передачу сигналов Ihh, не отменялось BMP2. Таким образом, сигнализация BMP не действует как вторичный сигнал Ihh для индуцирования экспрессии ПТГрП или для задержки начала гипертрофической дифференцировки. Применение ноггина привело к расширенной дифференциации терминально гипертрофических клеток, что подразумевало участие сигнализацим BMP в задержке самого процесса гипертрофической дифференциации. Эта роль сигнализации BMP не зависит от пути Ihh/ПТГрП. Установлено, что сигналы BMP действуют на разных этапах во время процесса эндохондральной оссификации, регулируя пролиферацию хондроцитов, экспрессию Ihh и процесс терминальной гипертрофической дифференцировки. Поскольку две сигнальные системы действуют на разных этапах процесса развития хондроцитов, они не взаимодействуют в истинном эпистатическом отношении. Однако сигналы Ihh и BMP взаимно индуцируют продукцию сигнальных факторов другого пути, тем самым координируя регулирование различных этапов процесса дифференциации. Сигнализация BMP и Ihh/ПТГрП контролирует различные аспекты гипертрофической дифференциации: система Ihh/ПТГрП регулирует начало гипертрофической дифференциации, тогда как сигнализация BMP контролирует темпы самого процесса дифференциации. ПТГрП не только блокирует дифференцировку хондроцитов, но одновременно определяет компетентность хондроцитов реагировать на сигналы BMP с повышением экспрессии Ihh. Кроме того, сигнализация BMP отрицательно регулирует дифференцировку терминальных гипертрофических хондроцитов. Эта задержка в терминальной гипертрофической дифференцировке может потребоваться для того, чтобы хондроциты приобрели увеличенный размер гипертрофических клеток и подверглись сопровождающим изменениям в экспрессии генов и матричной композиции. Регулируя пролиферацию хондроцитов, экспрессию Ihh и темп гипертрофической дифференциации, сигнализация BMP может таким образом сохранить общие темпы развития хряща (Minina E. et al., 2001). Концепция Kronenberg et al. (1997) о локальной цепи обратной связи, в которой постпролиферативные хондроциты секретируют Ihh, что увеличивает секрецию ПТГрП для замедления гипертрофии и тем самым замедляет производство клеток, которые секретируют Ihh была модифицирована Grimsrud C.D. et al. (1999). Взаимодействие ПТГрП-Ihh в системе обратной связи было дополнено участием BMP-6: ПТГрП подавляет BMP-6 и гипертрофию, низкий BMP подавляет экспрессию Ihh, а низкий Ihh приводит к уменьшению ПТГрП, что позволяет индуцировать BMP и гипертрофию до тех пор, пока уровни Ihh не повысятся. Авторы исследовали взаимосвязь этих трех факторов роста в культуре хондроцитов и подтвердили, что ПТГрП способен ингибировать параметры созревания, включая индукцию мРНК коллагена X типа, активность щелочной фосфатазы, увеличение размера хондроцитов и снижение пролиферации. Кроме того, они показали, что ПТГрП также отменяет экспрессию мРНК BMP-6. Ингибирующее действие на созревание хондроцитов может быть быстро отменено путем удаления ПТГрП из культур, и, кроме того, экзогенный BMP-6 может обойти ингибирующее действие ПТГрП на созревание. Хотя многие BMP, включая BMP-6, могут авторегулировать экспрессию мРНК, BMP-6 не смог индуцировать свою собственную продукцию в присутствии ПТГрП, несмотря на его способность индуцировать другие параметры созревания. Эти наблюдения составили основу для вывода о том, что подавление гипертрофии хондроцитов под воздействием ПТГрП происходит путем ингибирования уровней BMP-6 и что гипертрофия может иметь место в присутствии экзогенного BMP, не смотря на индуцированное ПТГрП подавление эндогенного BMP-6. (Grimsrud C.D. et al., 1999). Потеря функции Ihh путем нацеливания генов у мышей приводит к уменьшению пролиферации хондроцитов, потере экспрессии ПТГрП и аномальному позиционированию гипертрофических хондроцитов, близких к суставной поверхности (StJacques B. et al., 1999). Ihh также необходим для сигнализации между постмитотическими хондроцитами и перихондрием для установления и продвижения локуса остеогенеза (Chung U.I. et al., 2001). ПТГрП секретируется в основном незрелыми хондроцитами в верхней части колонны под воздействием гена Ihh, который является важным фактором, связанным с эндохондральной оссификацией (Worthley D.L. et al., 2015). Показано, что Ihh может позитивно регулировать транскрипцию и экспрессию коллагена типа X через взаимодействия Runx2/Smad с помощью факторов транскрипции GLI (Amano K. et al., 2014). Передача сигналов Ihh и ПТГрП играет решающую роль в регулировании возникновения гипертрофии хондроцитов. Vortkamp et al. (1996) обнаружили, что Ihh стимулирует секрецию ПТГрП прегипертрофированными хондроцитами, что, в свою очередь, ускоряет пролиферацию периартикулярных клеток и предотвращает начало гипертрофии хондроцитов, тем самым удерживая хондроциты в пролиферирующем состоянии. Этот цикл обратной связи регулирует баланс между пролиферацией и созреванием хондроцитов, обеспечивая упорядоченное формирование кости. С другой стороны, покоящиеся хондроциты на концах длинных костей выделяют ПТГрП, впоследствии подавляя продукцию Ihh в зоне пролиферации. Передача сигналов ПТГрП через рецептор регулирует дифференцировку хондроцитов для поддержания определенной длины ростовой пластинки через взаимодействие с геном IHH, экспрессированным в прегипертрофических и гипертрофических хондроцитах. Взаимодействие ПТГрП с Ihh регулирует пролиферацию, начало и темп гипертрофической дифференцировки хондроцитов, который является одним из критических моментов, связывающих пролиферацию хондроцитов с оссификацией во время формирования кости (Karp S.J. et al., 2000; Kawashima-Ohya Y. et al., 1998; Lanske B., 1999). Таким образом, Ihh и ПТГрП определяют, когда прекращается пролиферация клеток и начинается их гипертрофическая стадия (St-Jacques B. et al., 1999; Chen X. et al., 2008). Van Donkelaar C.C., Huiskes R. (2006) исследовали контур управления ПТГрП-Ihh на пластине эмбрионального роста с использованием простой математической модели. Авторы оценивали относительную важность ПТГрП и Ihh в контроле пролиферации и гипертрофии в пластине роста и в результате констатировали что Ihh и ПТГрП не оказывают равного влияния на пролиферацию и гипертрофию. Параметры, связанные с Ihh, преимущественно определяют пролиферацию, а параметры, связанные с ПТГрП, выборочно контролируют гипертрофию. Что касается временной динамики, то было установлено, что Ihh является более быстрым регулятором, чем ПТГрП. Ihh стимулирует пролиферацию в пролиферативной зоне, которая примыкает к ранней гипертрофической зоне, где продуцируется Ihh. Эффект ПТГрП, напротив, является вторичным по отношению к восходящей или нисходящей регуляции Ihh. Следовательно, эффект передачи сигналов ПТГрП задерживается переносом Ihh, временем экспрессии белка ПТГрП и его транспортировки в гипертрофическую зону на значительное расстояние от перихондрия. Использованная авторами математическая модель позволила предположить, что скорость пролиферации и ширина пролиферативной зоны зависят от параметров, связанных с Ihh, тогда как связанные с ПТГрП параметры определяют скорость гипертрофии, а не пролиферацию. Модель также показала, почему механорегуляция может быть более эффективной для Ihhсвязанных аспектов, в отличие от ПТГрП-связанных явлений и позволила пересмотреть критический уровень ПТГрП для поддержания пролиферации клеток Цикл отрицательной обратной связи Ihh-ПТГрП имеет центральное значение для правильного эндохондрального роста скелета (Ohba S., Chung U., 2014). Во время формирования эндохондральной кости ПТГрП-Ihh-сигнализация, ингибирующая гипертрофию хондроцитов, является доминирующей, тем самым нивелируя стимулирующий эффект ПТГрП-независимой передачи сигналов Ihh. Другие исследователи сообщили, что Ihh также может функционировать независимо от ПТГрП для развития гипертрофии хондроцитов (Mak K.K. et al., 2008). Механизмы, с помощью которых под влиянием гена Ihh увеличивается экспрессия ПТГрП на концах пластинки роста не совсем ясны, но этот процесс, вероятно, частично опосредован за счет прямого воздействия Ihh и отчасти косвенно посредством передачи сигналов трансформирующего фактора роста TGF β2 (Kronenberg H.M., 2006; Alvarez J. et al., 2002; Hilton M.J. et al., 2005). Показано также, что Ihh повышает экспрессию ПТГрП в пластине роста влияя антагонистически на активность фактора транскрипции Gli3 (Hilton M.J. et al., 2007; Koziel L. et al., 2005). ПТГрП действует на хондроциты через рецепторы PTH1R, в первую очередь за счет стимулирования производства цАМФ и модулирования активности протеинкиназы, которая, в свою очередь, опосредует ряд последующих событий, в том числе фосфорилирование SOX9, ингибирование экспрессии p57, индукцию Bcl-2 и продукцию циклина D1 и, в конечном счете, фосфорилирование и деградацию факторов транскрипции Runx2 и Runx3, которые необходимы для дифференцировки хондроцитов (Kronenberg H.M., 2006; Marino R., 2011). Показано также, что ПТГрП модулирует дифференциацию хондроцитов путем регулирования транспортировки гистондезацетилазы 4 (HDAC4) в ядро, которое, в свою очередь, регулирует активность сети транскрипционных факторов, таких как Zfp521, MEF2 и Runx2 (Correa D. et al., 2010; Kozhemyakina E. et al., 2009). ПТГрП отрицательно контролировал Gli-опосредованную транскрипцию в клеточных культурах и регулировал уровень репрессорной формы Gli3 протеин-киназы зависимым образом. Это показывает, что ПТГрП регулирует пролиферацию и дифференцировку хондроцитов ростовой пластины частично за счет активности Gli3, что указывает на значительную роль этого белка в хондрогенезе (Mau E. et al., 2007). Вышеприведенная информация о решающей роли сигнализации Ihh-ПТГрП в регулировании начала процесса гипертрофии хондроцитов в последующем была дополнена сведениями о том, что передача сигналов Ihh может способствовать гипертрофии хондроцитов независимо от ПТГрП (Kobayashi T. et al., 2005). Эти результаты показывают, что точная роль контура отрицательной обратной связи ПТГрП-Ihh более сложна, чем первоначально предлагалось, и что регуляция экспрессии ПТГрП определяется многими факторами. Основываясь на своих результатах, Mak K.K. et al. (2008) также обнаружили новый уровень Ihh в регуляции гипертрофии хондроцитов без влияния ПТГрП. При формировании эндохондрального кольца сигнализация ПТГрП-Ihh, ингибирующая гипертрофию хондроцитов, является доминирующей, тем самым скрывая стимулирующий эффект ПТГрП-независимого Ihh сигнала. Более того, они предположили, что каноническая передача сигналов Wnt и костного морфогенетического белка может также способствовать этому неканоническому пути. Кроме того, на эффекты ПТГрП могут влиять другие факторы. Amano K. et al. (2009) сообщили, что члены семейства фактора транскрипции SOX9 ингибировали поздние стадии хондрогенеза путем повышения регуляции экспрессии ПТГрП. Показано, что члены семейства Sox9 участвуют не только в развитии дифференцировки хондроцитов, но и в регуляции экспрессии ПТГрП. Обнаружено, что избыточная экспрессия Sox9 увеличивает экспрессию ПТГрП в первичных хондроцитах наряду с повышением регуляции экспрессии коллагена II типа, SOX5 и SOX6. Кроме того, избыточная экспрессия SOX5 или SOX6 сама по себе также значительно увеличивала экспрессию ПТГрП в клетках. Кроме того, сверхэкспрессия доминантно-отрицательной SOX9 подавляла экспрессию ПТГрП в первичных мышиных хондроцитах. Эти результаты показали, что SOX9 контролирует дифференцировку хондроцитов через ПТГрП. Человеческие мезенхимальные стволовые клетки, трансфицированные геном SOX9, демонстрировали усиленную экспрессию ПТГрП вместе с уменьшением гипертрофических маркеров (Venkatesan J.K. et al., 2012). Однако регуляторный эффект SOX9 на экспрессию ПТГрП различен в зависимости от органов-мишеней in vivo (Yan Y.L. et al., 2012). SOX9 является мишенью передачи сигналов ПТГрП в пластине роста и повышенная активность SOX9 может опосредовать эффект ПТГрП в поддержании клеток в стадии негипертрофированных хондроцитов (Huang W. et al., 2000). ПТГрП может блокировать гипертрофию хондроцитов, стимулируя NK2-гомеоблок 2 (Nkx3,2) (Provot S. et al., 2006) и предотвращая экспрессию RUNX2 (Zhang M. et al., 2009). Представлены доказательства того, что гормоны щитовидной железы регулируют дифференцировку гипертрофических хондроцитов и экспрессию ПТГрП, а также его рецептора во время формирования эндохондральной кости. (Stevens D.A. et al., 2000). Авторы установили, что при гипотиреозе эндохондральные ростовые пластины были сильно дезорганизованы, содержали аномальную матрицу, богатую гепарансульфатом, и гипертрофическая дифференциация хондроцитов не развивалась. Эти эффекты коррелировали с отсутствием экспрессии коллагена X типа и повышенной экспрессии мРНК рецептора ПТГрП. Рецепторы тиреоидных гормонов локализуются в областях пластинки роста, в которых экспрессируются ПТГрП и рецептор PTH1R. Морфофункциональный статус хондроцитов очень чувствителен к изменениям локальных концентраций гормонов щитовидной железы. Колокализация экспрессии тиреоидных рецепторов, ПТГрП и его рецептора в хондроцитах ростовой пластины подтверждает, что эпифизарная пластина роста является первичной зоной их воздействия. В развивающейся конечности Ihh секретируется прегипертрофическими хондроцитами и стимулирует продуцирование ПТГрП из периартикулярной области эпифизиса. Это приводит к сокращению производства Ihh и завершает регуляторный цикл обратной связи, в котором ПТГрП ингибирует гипертрофическую дифференцировку хондроцитов. Предполагается, что повышенная экспрессия ПТГрП в пластинах роста при гипотиреозе сильно ингибирует гипертрофическую дифференцировку хондроцитов, что приводит к остановке линейного роста костей. Таким образом, дисрегуляция активности сигнального пути Ihh- ПТГрП может быть ключевым механизмом, который лежит в основе расстройств роста при гипотиреозе у детей.