
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

ПАРАТГОРМОН-РОДСТВЕННЫЙ ПРОТЕИН. 2-е издание переработанное и дополненное
Курзанов А. Н., Ледванов М. Ю., Быков И. М., Медведев В. Л., Стрыгина Е. А., Бизенкова М. Н., Заболотских Н. В., Ковалев Д. В., Стукова Н. Ю.,
14.3.2.1. Роль взаимодействия сигнальных путей ПТГрП- PTH1R и CA-CASR в регуляции изменений метаболизма костной ткани связанных с лактацией
Известно, что пищевого кальция недостаточно для поддержания концентрации кальция в материнской крови во время лактации, и млекопитающие используют механизм резорбции кости для поддержания нормокальциемии. Мета-анализ 60 исследований, сообщающих об изменениях костного обмена и гомеостаза кальция во время беременности и кормления грудью у 14 видов млекопитающих показал, что все виды имеют сходную картину физиологических изменений во время беременности и кормления грудью, которые включают:
1) снижение концентрации кальция в сыворотке крови;
2) потерю костной ткани;
3) снижение сывороточных концентраций кальцитонина и паратгормона;
4) повышение концентрации кальцитриола в сыворотке независимо от изменений концентрации гормона околощитовидной железы (Torres D.A. et al., 2018).
Во время беременности концентрация минеральных веществ, в частности кальция и фосфора, поддерживается на высоком уровне в крови плода, так что развивающийся скелет может накапливать достаточное количество минералов. Для этого плацента активно транспортирует минералы. Кишечная абсорбция у матери увеличивается, чтобы удовлетворить потребность плода в кальции, который лишь частично зависит от кальцитриола. Минеральная регуляция в основном зависит от паратиреоидного гормона ПТГ и ПТГрП. Было установлено, что взаимодействие сигнальных путей ПТГрП-PTH1R и Ca-CaSR поддерживает гомеостаз системного внеклеточного ионизированного кальция (Ca2+). Поддержание нормального гомеостаза Ca2+ необходимо для всех клеточных функций организма. Наземные позвоночные формируют большой костный скелет для хранения избыточного Ca2+ в форме гидроксиапатита [Ca10(PO4)6(OH)2] и высвобождают его для удовлетворения системных потребностей во время дефицита Ca2+ или увеличения потребности в минерале во время беременности и лактации, что было подтверждено рядом превосходных обзоров (Goltzman D., Hendy G.N., 2015; Santa Maria C. et al., 2016; VanHouten J.N., Wysolmerski J.J., 2013). Эти два сигнальных каскада взаимодействуют, чтобы контролировать и поддерживать метаболизм скелета в физиологических и патологических условиях. Материнский скелет служит источником обеспечения существенного количества кальция в молоке. Это генетически запрограммировано и происходит независимо от потребления кальция с пищей или кишечной абсорбции кальция. Рандомизированные и обсервационные исследования показали, что высокое и низкое потребление кальция с пищей не изменяет потерю МПК во время лактации (Kovacs C.S. 2016; Cross N.A. et al., 1995b; Kalkwarf H.J. et al., 1997). Кальций-чувствительный рецептор участвует в регуляции выработки ПТГ и ПТГрП. Если потребность в кальции возрастает, материнский скелет подвергается резорбции под влиянием ПТГрП. После рождения абсорбция кальция становится прогрессивно активной и зависит от кальцитриола. Потеря содержания трабекулярного минерала происходит во время кормления грудью, чтобы обеспечить ребенка кальцием. Эта запрограммированная потеря костной массы зависит от взаимодействия «мозг-грудь-кость» (Kovacs C.S., 2005; Salles J.P., 2016) (рис. 19).
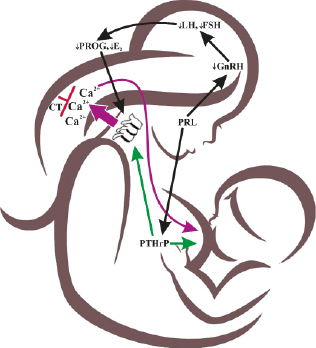
Рис. 19. Участие паратгормон-родственного протеина в контроле деминерализации скелета во время лактации
Сосание вызывает выброс пролактина. Как сосание, так и пролактин ингибируют продукци. гонадотропин-рилизинг гормона (GnRG) в гипоталамусе, который, в свою очередь, подавляет гонадотропины: лютеинизирующий гормон (LH) и фолликулостимулирующий гормон (FSH), что приводит к снижению уровня половых стероидов яичников (эстрадиола и прогестерона). Производство и высвобождение ПТГрП (PTHrP) из молочной железы контролируется несколькими факторами, включая сосание, пролактин и рецептор кальция. ПТГрП поступает в кровоток и сочетается с системно низкими уровнями эстрадиола, что заметно усиливает резорбцию кости. Повышенная способность к резорбции костей индуцирует поступление кальция и фосфата в кровоток, из которого минералы затем попадают в грудные протоки и в грудное молоко. ПТГрП также поступает в молоко в высоких концентрациях, но неизвестно, играет ли ПТГрП роль в регуляции физиологии кальция новорожденного. Кальцитонин (CT) модулирует чувствительность скелета, о чем свидетельствует удвоение минеральных потерь в скелете у мышей, у которых отсутствует ген, кодирующий кальцитонин.
Физиологическая резорбция кости во время циклов репродукции обычно не вызывает переломов или персистирующего остеопороза. Первым четко определенным механизмом является усиление остеокласт-опосредованной резорбции кости. Гистоморфометрический анализ кости лактирующих грызунов и приматов выявил увеличение числа и активности остеокластов с эрозией губчатой кости и потерей губчатого числа (Kovacs C.S., 2016). Вторым механизмом потери скелетных минералов во время лактации является остеоцитарный остеолиз – процесс, посредством которого остеоциты функционируют как остеокласты, чтобы резорбировать минерал из окружающей среды (Teti A., Zallone A., 2009; Wysolmerski J.J., 2013). Остеоциты резорбируют минеральный и белковый матрикс из окружающих их лакун и экспрессируют гены и ферменты, связанные с остеокластами (включая катепсин K (Qing H, et al., 2012). Экспрессия катепсина К остеоцитами является функционально важной, поскольку селективная абляция гена катепсина К из остеоцитов тормозит лакунарную резорбцию и потерю минералов во время лактации, а также предотвращает индуциванное лактацией увеличение числа и функций остеокластов, что снижает остеокласт-опосредованную резорбцию кости (Lotinun S. et al., 2019). Показано, что остеоциты могут реконструировать свой перилакунарный и периканаликулярный матрикс и что они участвуют в освобождении скелетных запасов кальция во время репродуктивных циклов координируя метаболизм костей и минералов во время лактации, а также восстановления костной массы после отлучения от груди (Wysolmerski J.J., 2013). Низкий уровень эстрадиола и ПТГрП синергически стимулирует опосредованную остеокластами резорбцию кости и остеоцитарный остеолиз и, таким образом, обеспечивают поступление кальция в молоко. В клинических исследованиях более высокие уровни циркулирующего ПТГрП коррелировали с более высоким лактационным снижением МПК в поясничном отделе позвоночника и шейке бедра лактирующих женщин (Sowers M.F. et al., 1996). Иногда увеличение ПТГрП во время лактации вызывает более выраженную резорбцию скелета и симптоматическую гиперкальциемию, состояние, называемое псевдогиперпаратиреозом, которое обычно проходит при отлучении от груди. После того, как ребенка отнимают от груди, происходит процесс восстановления костной ткани материнского организма. Через шесть-двенадцать месяцев после прекращения лактации, показатели МПК поясничного отдела позвоночника и бедер женщин вернулись к значениям до беременности или выше (Kovacs C.S., 2016). То же самое происходит у грызунов в течение двух-четырех недель (Gillies B.R. et al., 2018).