
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

ПАРАТГОРМОН-РОДСТВЕННЫЙ ПРОТЕИН. 2-е издание переработанное и дополненное
Курзанов А. Н., Ледванов М. Ю., Быков И. М., Медведев В. Л., Стрыгина Е. А., Бизенкова М. Н., Заболотских Н. В., Ковалев Д. В., Стукова Н. Ю.,
14.3.3. Роль паратгормон-родственного белка в метаболизме кальция в период лактации
Во время лактации секреция кальция в молоко эпителиальными клетками молочной железы резко возрастает. Регулирование уровня кальция в материнской крови в период лактации, достигаемое за счет молекулярных и физиологических изменений в гомеостазе кальция, имеет решающее значение для поддержания синтеза молока и удовлетворения потребностей матери в кальции (Kovacs C.S., Kronenberg H.M., 1997; Kovacs, C.S., 2014). Поддержание гомеостаза кальция у матери в период лактации является сложным процессом, который эффективно регулируется взаимодействием молочной железы с костной, кишечной и почечной тканями.
Несколько групп исследователей продемонстрировали, что циркулирующие уровни ПТГрП повышаются во время лактации (VanHouten J.N., Wysolmerski J.J. 2003; Lippuner K. et al., 1996; Yamamoto M. et al., 1991; Dobnig H. et al., 1995) и было высказано предположение, что ПТГрП может способствовать мобилизации скелетных запасов кальция в течение этого времени. Также было высказано предположение, что ПТГрП в молоке может оказывать влияние на метаболизм кальция в кишечнике новорожденных и/или новорожденных (Philbrick W.M. et al., 1996; Kovacs C.S., Kronenberg H.M., 1997). Представляет значительный интерес тот факт, что неповрежденная лактирующая молочная железа регулирует выработку ПТГрП в ответ на системную концентрацию кальция. Это подразумевает, что ПТГрП может действовать как часть петли обратной связи, которая координирует метаболизм кальция у матери и/или новорожденного с количеством кальция, доступным для производства молока.
Однако, несмотря на значительное увеличение уровней мРНК ПТГрП в железе, не было обнаружено увеличение концентрации ПТГрП в кровообращении у мышей с ограниченным содержанием кальция. Эксперименты in vivo показали (VanHouten J. et al., 2004), что кальций влияет на собственный транспорт в молоко через эпителиальные клетки молочной железы. Для проверки этой гипотезы разработали модель трансэпителиального транспорта кальция in vitro, которая была бы свободна от потенциально смешанных системных эффектов гипокальциемии. Данные из культивируемых маммосфер подтверждают, что активация базолатерального кальций чувствительного рецептора действительно стимулирует транспорт кальция через эпителий молочной железы (Van Houten J. et al., 2004). В лактирующей молочной железе также экспрессируется кальций чувствительный рецептор (CaSR), активация которого индуцирует подавление секреции ПТГрП в ответ на поступление кальция в железу (Van Houten J.N., Wysolmerski J.J. 2003). Экспрессия ПТГрП и перенос кальция в эпителиальных клетках молочной железы регулируются внеклеточным кальцием, действуя через CaSR. В этой системе регуляции стимуляция CaSR ингибирует секрецию ПТГрП, а гипокальциемия индуцируемая диетическими ограничениями увеличивает продукцию ПТГрП в молочной железе в естественных условиях (Van Houten J. et al., 2004). Эти взаимодействия определяют классическую петлю обратной связи, при которой клетки молочной железы выделяют ПТГрП для мобилизации кальция из кости, а мобилизованный из скелета кальций, поступая с кровотоком в молочную железу ингибирует дальнейшую секрецию ПТГрП. Таким образом во время лактации молочная железа и костная ткань взаимодействуют в мобилизации скелетного кальция для обеспечения должного его количества, необходимого для секреции молока. Кальциевый рецептор экспрессируется в ткани молочной железы во время лактации, где он регулирует выработку ПТГрП, а также содержание кальция и воды в молоке. Рецептор кальция контролирует системную концентрацию кальция, чтобы контролировать синтез ПТГрП и, тем самым, поступление кальция в молочную железу (Kovacs C.S., 2005) (рис. 20).

Рис. 20. Роль взаимодействия кальциевого рецептора и паратгормон-родственного протеина в поступлении кальция в молочные железы
Кальциевый рецептор (CaSR) экспрессируется в период лактации при грудном вскармливании, при этом он выполняет несколько ключевых функций. Рецептор кальция контролирует системную концентрацию кальция, чтобы контролировать синтез паратгормон-родственного протеина (PTHrP) и, тем самым, поступление кальция в грудь. Увеличение системного кальция ингибирует экспрессию PTHrP, тогда как снижение системной концентрации кальция стимулирует экспрессию PTHrP. Рецептор кальция также непосредственно регулирует содержание кальция и воды в молоке.
Предполагается, что, активация CaR ингибирует экструзию базолатерального кальция путем ингибирования активности кальция-АТФазы плазматической мембраны (PMCA). Было показано, что изоформа PMCA2b высоко экспрессируется в молочной железе во время лактации (Reinhardt T.A., Horst R.L., 1999). В эпителиальных клетках молочной железы функционирует сеть транспортеров и насосов, которые обеспечивают транспорт кальция из крови в молоко (Faddy H.M. et al., 2008).
Это прежде всего кальций чувствительный рецептор, который описан, как главный регулятор системного метаболизма кальция, в значительной степени ответственный за поступление кальция в молочную железу (VanHouten J.N., Wysolmerski J.J., 2007), селективный канал ионов кальция Ca(2+) (кальций релиз-активированный протеин кальциевых каналов 1-ORAI-1), ответственный за передачу сигналов кальция в клетках млекопитающих. Он локализован в базолатеральных доменах плазматической мембраны эпителиоцитов молочной железы и участвует во входе кальция в клетку (Cross B.M. et al., 2013), обеспечивая перемещение кальция из кровотока в эпителиальные клетки молочной железы (Gudlur A., Hogan P.G., 2017; Ross D.G.F., et al., 2013). В ткани молочных желез эпителиальные клетки экспрессируют транспортные белки плазматической мембраны кальций – АТФазы 1 и 2 (PMCA1, 2), участвующие в регуляции потоков кальция из клеток. PMCA2 ответственен за более чем 60 % транспорта кальция через апикальную поверхность клеток в молоко (Reinhardt T.A., et al., 2004 (рис. 21).
Регулирование мобилизации кальция из кости является одной из ключевых функций молочных желез. Во время лактации женщины и другие млекопитающие теряют значительную часть костной массы, которая восстанавливается после прекращения лактации (Ardeshirpour L. et al., 2007; Kovacs C.S., 2005; Wysolmerski J.J., 2010). Чтобы стимулировать мобилизацию кальция, молочные железы становятся эндокринными органами и выделяют ПТГрП, в кровоток (Kovacs C.S., Chik C.L., 1995; Stewart A.F., 2002). Повышенная продукция ПТГрП в молочных железах является причиной увеличения циркулирующего ПТГрП во время лактации (Thiede M.A., 1994; Wysolmerski J.J. et al., 1995; Wysolmerski J.J., 2010; VanHouten J.N. and Wysolmerski J.J., 2013). Уровни ПТГрП в плазме, измеренные с помощью иммунорадиометрического анализа через 2–3 дня после родов, были повышены по сравнению с контролем. ПТГрП оставался значительно повышенным, но постепенно уменьшался в течение 6 месячного периода лактации (Dobnig H., et al., 1995). Было показано, что циркулирующие уровни ПТГрП повышаются во время лактации и было высказано предположение, что циркулирующий ПТГрП в этот период может вызывать повышенную резорбцию кости (Sowers M.F. et al., 1996; Dobnig H. et al., 1995; Ratcliffe W.A., 1992). Также было продемонстрировано, что сосание увеличивает выработку ПТГрП в молочной железе и увеличивает выработку нефрогенного цАМФ и уровень фосфата в моче у кормящих крыс (Yamamoto M. et al., 1991).
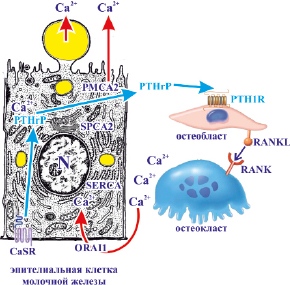
Рис. 21. Участие паратгормон-родственного протеина в регуляции материнского гомеостаза кальция в период лактации
Движение кальция в молочную железу регулирует материнский гомеостаз кальция в период лактации. Поток кальция в молочную железу через канал белка 1 (ORAI1) кальциевого канала, активированного высвобождением кальция, увеличивается во время лактации для поддержки синтеза молока. Кальций в основном экспортируется из молочной железы через транспортер плазматической мембраны кальциевой АТФазы 2 (РМСА2) на апикальной мембране. Концентрации кальция измеряются чувствительным к кальцию рецептором (CaSR) на базолатеральной стороне эпителия молочной железы. Кальций также хранится в эндоплазматической сети и поглощается кальциевой АТФазой сарко/эндоплазматической сети (SERCA). Кальций поступает в аппарат Гольджи посредством кальциевой АТФазы секреторного пути (АТФазы типа 2С – SPCA2). По мере того, как концентрации кальция в молоке увеличиваются, а концентрации кальция в материнской крови уменьшаются, синтез и секреция паратгормон-родственного протеина (PTHrP) эпителием молочной железы увеличивается. Затем PTHrP связывается с рецептором паратиреоидного гормона 1 (PTH1R) в клетках остеобластов. Это, в свою очередь, увеличивает дифференцировку и активность остеокластов и впоследствии увеличивает резорбцию кальция в кости. Это происходит посредством продуцирования остеобластами активируемого рецептором ядерного фактора каппа-B-лиганда (RANKL), который связывается со своим рецептором, активируемым рецептором ядерного фактора каппа B (RANK) на остеокластах. Этот путь позволяет восстановить материнский гомеостаз кальция.