
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

ПАРАТГОРМОН-РОДСТВЕННЫЙ ПРОТЕИН. 2-е издание переработанное и дополненное
Курзанов А. Н., Ледванов М. Ю., Быков И. М., Медведев В. Л., Стрыгина Е. А., Бизенкова М. Н., Заболотских Н. В., Ковалев Д. В., Стукова Н. Ю.,
14.4.2.2. Роль паратгормон-родственного протеина в развитии метастазов рака молочной железы в кости
Несмотря на интенсивные усилия, прогресс в понимании основных механизмов метастатического рака в целом явно недостаточен (Klein C.A., 2009; Riggi N. et al., 2018). Более века назад английский хирург Стивен Пейджет разработал концепцию метастазирования, в значительной степени основанную на наблюдениях, что рак молочной железы преимущественно распространяется в костные структуры. (Paget S., 1889; Fidler I.J., 2003). Выводы С. Пейджета были основаны на обширном исследовании вскрытий у женщин с раком молочной железы, в котором он отметил значительную частоту вторичных отложений на концах бедренной кости и в черепе. Это привело его к разработке гипотезы «семени и почвы» о метастатическом росте. Гипотеза «семени и почвы» подчеркивает, что выбор места для вторичного развития опухоли осуществляется не только опухолевой клеткой (или «семенем»), но также зависит от свойств органа-мишени (или «почвы»). Кость стала благоприятной почвой для «семени» метастатических клеток рака молочной железы. Эта гипотеза по-прежнему отражает современные представления о метастатическом процессе: чтобы образоваться и расти в отдаленных органах, опухолевые клетки нуждаются в специфических условиях, которые подходят им в этих органах (Nicolson G.L., 1988). Эта концепция была далее расширена в модели «метастатической ниши» которая объясняла взаимосвязь между распространяющимся «семенем» (опухолью) и «метастатической нишей» (костью) за счет постоянного поступления факторов роста из микроокружения, потери апоптотических сигналов и рекрутирования эндотелиальных клеток-предшественников (Psaila B., Lyden D., 2009).
Метастазирование – это многоэтапный процесс, требующий участия различных факторов, а кость является ведущим участком метастазирования
рака молочной железы (Awolaran O. et al., 2016). Механизмы, лежащие в основе этого остеотропизма, являются сложными и включают в себя некоторые характеристики как клеток рака молочной железы, так и костного матрикса, в который метастазируют эти опухоли. Клетки рака молочной железы должны обладать определенным свойства, которые позволяют им расти в кости, а костный матрикс обеспечивать подходящую микросреду, которая способствует росту этих клеток. Костный матрикс считается уникальным среди тканей-мишеней метастазирования рака, так как он постоянно обогащается костными факторами роста и цитокинами, которые могут привлекать и поддерживать рост циркулирующих опухолевых клеток, способствуя тем самым формированию и росту костных метастазов (Bussard K.M. et al., 2007; Guisse T.A. et al., 2006). В отличие от других тканей, кость в основном состоит из твердых минерализованных структурных компонентов и; следовательно, более устойчива для инвазии и разрушения раковыми клетками по сравнению с другими метастатическими сайтами (Guise T.A., Mundy G.R., 1998). Остеокласты были описаны как наиболее эффективные клетки для индукции резорбции кости (Roodman G.D., 1999). Поэтому для того, чтобы расти внутри костного матрикса, раковые клетки должны обладать способностью вызывать остеокластическую активацию, которая является основным клеточным механизмом для разрушения костной ткани, индуцированного раком (Roodman G.D., 2001; Li Y.M. et al., 2004). Усиление остеокластической резорбции кости затем обеспечивает пространство, в котором раковые клетки могут расти и вызывать дальнейшие молекулярные взаимодействия с различными цитокинами в костной микросреде.
На всех этапах в развитии метастазов участвуют различные молекулы, в том числе: молекулы инициации метастазирования, такие как TWIST1, матриксные металлопротеиназы (MMPs), HIF1A и фактор роста эндотелия сосудов (VEGF) (Scully O.J. et al., 2012; Vanharanta S., Massague J., 2013; Wan L. et al., 2013); молекулы прогрессирования метастазирования, такие как PTGS2, EREG, LOX, ANGPLTL4 и CLDN2 (Kang Y. et al., 2003; Minn A.J. et al., 2005b; Bos P.D. et al., 2009; Tabaries S., et al., 2011) и молекулы вирулентности метастазирования, такие как ПТГрП, интерлейкин 8 (IL-8), молекула 1 адгезии сосудистых клеток (VCAM-1) (Bendre M.S. et al., 2002; Lu X. et al., 2011; Guise T.A. et al., 1996). Среди этих молекул IL-8, VCAM-1 и ПТГрП являются факторами, участвующими в формировании и развитии костных метастазов. После прохождения общих стадий метастазирования определенные особенности раковых клеток во взаимодействии с микроокружением костного мозга считаются необходимыми для установления метастатического поражения кости. Одна из наиболее важных необходимых возможностей – это способность вырабатывать ПТГрП (Mundy G.R., 2002; Yoneda T., Hiraga T. 2005; Kremer R, et al., 2011). Существуют убедительные доказательства того, что ПТГрП способствует метастазированию в кости (Guise T.A. et al., 1996). ПТГрП был обнаружен у 92 % пациентов с метастатическим поражением костей при раке молочной железы (Powell G.J. et al., 1991; Yoshida A. et al., 2000). Клинические и экспериментальные данные указывают на то, что опухолевый ПТГрП является основным фактором индуцирующим остеокластическую резорбцию кости, в локусах метастатического рака молочной железы (Powell G.J. et al., 1991; Bouizar Z. et al., 1993). Многочисленные исследования зафиксировали продукцию ПТГрП клетками рака молочной железы, которые метастазировали в кости. ПТГрП был обнаружен иммуногистохимией (Powell G.J. et al., 1991) и гибридизацией in situ (Vargas S.J. et al., 1992) в 92 % костных метастазов рака молочной железы, по сравнению только с 17 % метастазов, локализованных вне кости. Это наблюдение позволило предположить, что выработка ПТГрП в качестве резорбирующего кости агента может способствовать возникновению остеолитических метастазов рака молочной железы.
Костный матрикс содержит множество факторов роста, таких как инсулиноподобный фактор роста (IGF), трансформирующий фактор роста β
(TGF- β), фактор роста фибробластов (FGF), фактор роста, полученный из тромбоцитов (PDGF), и Ca2+. Эти факторы высвобождаются при резорбции кости. Среди них TGF- β и Ca2+ связываются с рецептором TGF- β и кальций-чувствительным рецептором раковых клеток, соответственно, чтобы стимулировать выработку ПТГрП (Yin J.J. et al., 1999; Sanders J.L. et al., 2000). Затем ПТГрП стимулирует остеобласты активировать лиганд рецепторного активатора экспрессии ядерного фактора κ β (RANKL). RANKL, связанный с RANK, экспрессируется в преждевременных остеокластах и способствует дифференцировке в зрелые остеокласты (Suda T., Takahashi N., 1999). Наконец, резорбция кости активируется зрелыми остеокластами, завершая «порочный круг», который ускоряет резорбцию кости, что совпадает с ростом метастатического поражения кости, стимулируемого другими факторами роста (Wong M.H., Pavlakis N., 2011; Li B.T. et al., 2014) (рис. 22).
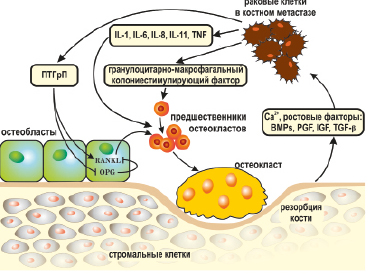
Рис 22. Роль паратглрмон-родственного протеина в развитии остеолитических костных метастазов по механизму «порочный круг» при раке молочной железы
Костный метастаз может развиваться через ряд взаимодействий в мнкроокружении опухоли, известные как «порочный круг»: в этом цикле ПТГрП играет важную роль. Опухолевые клетки секретируют факторы, которые стимулируют активацию остеобластов и остеокластов. Активированные остеокласты деградируют матрицу кости и продуцируют факторы, которые стимулируют клетки опухоли. Метастатические опухолевые клетки взаимодействуют с костной микросредой для облегчения остеолитической колонизации. Опухолевые клетки секретируют ПТГрП, который стимулирует остеобласты, чтобы производить как один из ключевых активаторов остеокластов мембранно-связанный цитокин RANKL, так и растворимый рецептор приманку для RANKL остеопротогерин (OPG). Это соотношение RANKL к OPG определяет активацию остеокластов через его рецептор для RANKL. Активированные остеокласты деградируют матрицу кости, продуцируя в местное микроокружение факторы роста, стимулирующие опухолевые клетки для продолжения секреции ПТГрП и тем самым замыкая «порочный круг» и возобновляя цикл взаимодействий в мнкроокружении опухоли.
Микроокружение кости богато факторами роста, такими как инсулиноподобный фактор роста 1 (IGF1) и морфогенетические белки кости (BMPs), а также цитокины, такие как IL6, IL8 и IL11 (Hadjidakis D.J., Androulakis I.I., 2006). Опухолевые клетки могут инициировать резорбцию кости и вызывать «порочный круг», в котором различные факторы роста высвобождаются из костного матрикса, чтобы способствовать дальнейшей резорбции кости (Weilbaecher K.N., 2011). В порочном цикле трансформирующий фактор роста бета (TGF β) костного матрикса секретируемый макрофагами, играет ключевую роль во взаимодействиях опухоль-кость (Chiechi A. et al., 2013). TGF β стимулирует выработку ПТГрП, в опухолевых клетках, что повышает экспрессию рецепторного активатора ядерного фактора каппа β (RANKL) в костеобразующих остеобластах и активирует остеокласты, резорбирующие кости (Azim H.A. et al., 2012).
Pratap J. et al., (2008) исследовали влияние ключевого фактора транскрипции, связанного с дифференцировкой остеобластов Runx2 на основные компоненты «порочного цикла» роста опухоли и резорбции кости, который включает перепроизводство ПТГрП клетками рака молочной железы, оказывающего глубокое влияние на активность и выживаемость опухолевых клеток и, если они присутствуют в микроокружении кости, приводят к резорбции костной ткани. Резорбированная кость высвобождает TGF β, который стимулирует пролиферацию опухолевых клеток и, следовательно, увеличивает секрецию ПТГрП, тем самым продолжая порочный круг (Yin J.J. et al., 1999). Кроме того, ПТГрП регулируется Gli, сигнальным фактором Hedgehog, и этот путь приводит к патологическим последствиям в различных опухолях человека (Sterling J.A. et al., 2006; Katoh Y., Katoh M., 2005). Runx2 высоко экспрессируется в костных метастатических раковых клетках, но не в клетках первичной опухоли (Barnes G.L. et al., 2004). Runx2, ключевой фактор для формирования кости, активирует несколько генов (p21, RANKL, MMP2, MMP9, MMP13, VEGF, OP и BSP), необходимых для развития и оборота кости (Komori T., 2008). Эти гены регулируемые Runx2 в метастатических клетках рака молочной железы (Selvamurugan N. et al., 2004; Pratap J. et al., 2005) были идентифицированы как маркеры прогрессирования роста опухоли и опухолевого генеза и в качестве существенных медиаторов инвазии опухолей и метастазов (Blyth K. et al., 2005; Pratap J. et al., 2006). Runx2 связывается с промотором сигнальной молекулы IHH и активирует ее экспрессию в раковых клетках и эта регуляция дополнительно увеличивает уровни ПТГрП, приводя в действие порочный цикл в раковых клетках. Исследования Pratap J. et al., (2008) показали, что Runx2 напрямую влияет на остеолитический процесс, регулируя путь IHH-ПТГрП в клетках рака молочной железы, что приводит к остеокластогенезу in vivo. Метастатические раковые клетки, имея более высокие уровни Runx2, способны активировать компоненты порочного цикла и целевые гены, которые увеличивают потерю кости и способствуют прогрессированию опухоли в кости, приводя к развитию метастазов.
Большинство доказательств указывает на то, что клетки рака молочной железы могут вызывать остеокластическую активацию через высвобождение растворимых медиаторов: IL-1, IL-6, 1L-8, простагландин E2, TNF и ПТГрП (Roodman G.D., 2004; Guise T.A., Mundy G.R., 1998). Было показано, что ПТГрП, продуцируется примерно в 50 % случаев первичного рака молочной железы (Kohno N, et al., 1994; Bundred N.J. et al., 1992) и играет важную роль в патогенезе остеолитических метастазов, обусловленных раком молочной железы (Roodman G.D., 2004; Guise T.A. et al., 1996; Simonet W.S. et al., 1997).
Остеолитические метастатические поражения очень сильно снижают качество и продолжительность жизни пациентов. Метастазы вызывают более 90 % смертей пациентов с раком молочной железы (Gilkes D.M., 2016) и у примерно 70 % пациентов с метастатическим раком молочной железы развиваются костные метастазы в течение их заболевания (Coleman R.E. et al., 1998; Manders K. et al., 2006). ПТГрП связан с прогрессированием скелетных метастазов, и его нерегулируемая экспрессия при распространенных формах рака вызывает гиперкальциемию, связанную со злокачественными новообразованиями. Хотя ПТГрП часто экспрессируется опухолями молочной железы и другими солидными раками, его влияние на прогрессирование опухоли неясно. Анализ экспрессии ПТГрП в образцах рака молочной железы показал, что 60 % первичных опухолей молочной железы и 90 % метастатического рака молочной железы в костях экспрессируют ПТГрП, что указывает на важность ПТГрП для прогрессирования метастазирования в кости (Southby J. et al., 1990; Powell G.J. et al., 1991). Положительное иммуногистохимическое окрашивание на ПТГрП было обнаружено в 56 % образцах ткани первичных опухолей молочной железы от женщин с нормокальциемией,
а экспрессия ПТГрП положительно коррелировала с развитием метастазов в кости и эпизодами гиперкальциемии (Davicco M.J. et al., 1993). Пациенты с первичным раком молочной железы, у которых впоследствии развиваются костные метастазы, имели повышенные концентрации мРНК ПТГрП в плазме (Bouizar Z. et al., 1993; 1999). МРНК ПТГрП выявлялась гибридизацией in situ чаще при костных метастазах, чем при не костных метастазах (Vargas S. et al., 1992). Несколько клинических исследований показали, что клетки костных метастазов рака молочной железы экспрессируют ПТГрП чаще или в более высоких количествах, чем клетки не скелетных метастазов или первичной опухоли (Kohno N. et al., 1994a; 1994b; Linforth R., et al., 2002; Bouizar Z. et al., 1993). Полагают, что способность клеток рака молочной железы продуцировать ПТГрП в пределах костного метастаза и микроокружение костей более важны для развития метастазов в скелет, чем экспрессия ПТГрП первичными клетками рака молочной железы (Kohno N. et al., 1994a; Bundred N.J. et al., 1992; Henderson M. et al., 2006). Показано, что ПТГрП может участвовать в метастазировании рака молочной железы независимо от его роли в усилении остеокластической функции. ПТГрПиграет важную роль в модулировании ангиогенного и костного остеолитического действия VEGF (Isowa S. et al., 2010). Кроме того, ПТГрП усиливает экспрессию в клетках рака молочной железы матриксной металлопротеиназы-13 которая может разрушать костный матрикс, таким образом добавляя дополнительные инвазивные признаки метастатическому процессу в кости (Ibaragi S. et al., 2010). Эти данные демонстрируют, что ПТГрП представляет собой рациональную цель для исследования возможностей лечения метастазов в кости при раке молочной железы. В мышиной модели, нейтрализующие антитела против ПТГрП, уменьшали как размер остеолитических повреждений, так и площадь опухоли в кости (Guise T.A. et al., 2006). Гуманизированное моноклональное антитело, нацеленное на ПТГрП, находилось в разработке в Японии (Onishi T. et al., 2010). Jun A.Y. et al. (2014) в экспериментах с использованием линии клеток рака молочной железы человека MDA-MB-231показали, что лигнаны тетрагидрофурофуранового типа, полученные из цветков магнолий, обычно используемые в традиционной азиатской медицине для лечения воспалительных заболеваний, могут блокировать опосредованную раком молочной железы потерю костной массы. Асхатин, фаргезин, диметиловый эфир лириорезинола B и магнолин в нецитотоксических концентрациях подавляли экспрессию мРНК и секрецию ПТГрП в метастатических клетках рака молочной железы человека MDA-MB-231. Асхатин, фаргезин, диметиловый эфир лириорезинола В и магнолин существенно снижали остеорезорбирующую активность остеокластов, ингибируя активность ММР-9 и катепсина К. Асхатин, фаргезин, диметиловый эфир лириорезинола В, и магнолин блокировали инициацию и прогрессирование «порочного цикла» между метастазами рака молочной железы и микроокружением кости путем ингибирования продукции ПТГрП в клетках рака молочной железы и остеокластической резорбции кости. Следовательно, эти лигнаны тетрагидрофурофуранового типа могут служить полезными агентами для предотвращения и лечения вызванного раком разрушения кости у пациентов с раком молочной железы. В другом исследовании с использованием той же клеточной культуры продемонстрировано, что нокдаун экспрессии ПТГрП в клетках рака молочной железы поразительно ингибирует образование опухолей у мышей (Zheng L. et al., 2013). Нокдаун ПТГрП резко снизил уровни циклинов D1 и A1 и остановил прогрессию клеточного цикла на стадии G1 и индуцировал апоптоз опухолевых клеток и способствовал формированию автофагосомы. Ингибирование продукции ПТГрП значительно уменьшило способности клеток рака молочной железы для торможения дифференцировки остеобластов и образование костной ткани. В совокупности эти исследования показали, что таргетинг ПТГрП в опухолевых клетках может быть потенциальной терапевтической стратегией для рака молочной железы, особенно с костными метастазами.
Другие факторы, такие как M-CSF, IL-11, VEGF, способствуют остеолитическим поражениям посредством активации RANKL остеобластами и стромальные клетки (Guisse T.A. et al., 2006). IL-8, который, по-видимому, действует как RANKL-зависимый, а также RANKL-независимый фактор, который может напрямую стимулировать остеокластическую резорбцию кости (Bendre M.S. et al., 2002). Предполагают, что IL-8 может участвовать в самая ранней стадии остеокластической резорбции кости, которая будет сопровождаться доминирующим действием ПТГрП на более поздней стадии разрушения кости (Kominsky S., Davidson N.A., 2006). В этой модифицированной модели костного метастазирования рака молочной железы экспрессия ПТГрП индуцируется позже, чтобы стимулировать порочный круг разрушения кости (Bendre M. et al., 2003).
Свидетельство того, что образование метастазов в костях может быть связано с продукцией ПТГрП при раке молочной железы, было получено в результате ретроспективного анализа первичного рака молочной железы и метастазов в кости и мягких тканях (Powell G.J., et al., 1991). Было показано, что продукция ПТГрП опухолевыми клетками в микроокружении кости путем стимуляции активности остеокластов способствует расширению остеолитических метастазов в кости (Akhtari M. et al., 2008; Yin J.J. et al., 1999).
Экспериментальные данные, подтверждающие роль ПТГрП в формировании метастазирования в кости, получены в исследованиях с использованием внутрисердечной инъекции раковых клеток человека, которые формируют литический рост в кости мыши. Исследования с использованием мышиной модели костных метастазов подтвердили роль ПТГрП в установлении и росте костных метастазов (Guise T.A. et al., 1996; Yin J.J. et al., 1999; Thomas R.J. et al., 1999). Линия клеток рака молочной железы человека MDA-MB-231, экспрессировавшая ПТГрП, была использована для моделирования остеолитических метастазов in vivo. У мышей, инокулированных клетками MDA-MB-231, развился остеолитический метастаз в кости без гиперкальциемии или повышенных концентраций ПТГрП в плазме. Концентрации ПТГрП в плазме костного мозга из бедренных костей, пораженных остеолитическими поражениями, увеличились в 2,5 раза по сравнению с соответствующими концентрациями ПТГрП в плазме. В отдельном эксперименте мышей обрабатывали моноклональным антителом, направленным против ПТГрП (1–34), до введения клеток опухоли MDA-MB-231. Общая площадь остеолитических поражений была значительно ниже у мышей, получавших антитела к ПТГрП, по сравнению с контрольными мышами. Гистоморфометрический анализ кости выявил снижение количества остеокластов на миллиметр границы раздела опухоль / кость и увеличение площади кости, а также уменьшение площади опухоли у животных с опухолями, получавших антитела к ПТГрП, по сравнению с соответствующими контролями. Эти результаты показали, что ПТГрП, продуцируемый опухолью, может вызывать локальное разрушение кости при метастатическом раке молочной железы и таким образом играть важную патогенетическую роль в создании остеолитических поражений костей при раке молочной железы. Нейтрализующие антитела к ПТГрП могут уменьшить развитие деструктивных поражений костей, а также рост опухолевых клеток в кости (Guise T.A., et al., 1996). Кроме того, увеличенный рост опухоли в кости был зафиксирован даже с менее инвазивными клетками MCF-7, когда они были трансфицированы для сверхэкспрессии ПТГрП (Guise T.A. et al., 2002).
Gallwitz W.E. et al., (2002) установили, что единственными антиметаболитами, которые ингибировали экспрессию ПТГрП, были те, которые были связаны с гуанозином. Эти аналоги гуанозина также продемонстрировали значительную специфичность к промотору ПТГрП. Идентифицированы аналоги гуанин-нуклеотидов как соединения, которые ингибируют экспрессию ПТГрП опухолевыми клетками человека при остеолитических поражениях, связанными с метастазированием клеток рака молочной железы человека. Существует значительный потенциал для использования метаболитов гуанозина у пациентов с заболеванием костей, вызванным раком молочной железы (Gallwitz W.E. et al., 2002).
Приведенные выше экспериментальные данные, свидетельствующие о роли ПТГрП в возникновении и росте рака в кости, иллюстрируют важность образования и активации остеокластов в процессе метастазирования кости. Однако Gregory L.S. et al., (2013) сообщили, что изменения в формировании кости и активности резорбции кости были различными на ранних и поздних стадиях во время развития повреждения кости после интрабиальной инъекции клеток рака молочной железы человека MDA-MB-231 в голени бестимусных голых мышей. Авторы обнаружили, что ранняя потеря костной массы на мышиной модели обусловлена значительным снижением образования новой кости остеобластами, а не повышением уровня резорбции кости остеокластами, что указывает на то, что остеобласты играют критическую роль в раннем патогенезе костного метастазирования рака молочной железы.
Для проникновения и роста в кости, как и в любой другой ткани, раковые клетки нуждаются в общих инвазивных свойствах, которые позволяют им разрушать стенки сосудов, разрушать соединительную ткань и стимулировать ангиогенез. Специфическими требованиями являются способность адгезии к костной ткани и, что наиболее важно, способность индуцировать образование активных остеокластов из предшественников в кости хозяина, тем самым инициируя резорбцию и позволяя опухоли формироваться и увеличиваться (Mundy G.R., Martin T.J., 1993; Clohisy D.R. et al., 2000; Mundy G.R., 2002). Таким образом, хотя ПТГрП был тщательно исследован, ясно, что есть другие продукты раковых клеток молочной железы, которые могут влиять на костное метастазирование, способствуя образованию остеокластов, включая простагландины, IL-6, IL-8 (Bendre M.S. et al., 2002) и макрофагальный колониестимулирующий фактор (Murray L.J. et al., 2003). Клетки рака молочной железы продуцируют различные остеолитические медиаторы, из которых IL-8 и ПТГрП вызывают разрушение кости, вызывая дифференцировку и активацию остеокластов.
Опухолево-костные молекулярные взаимодействия, опосредованные различными факторами, управляют циклом, который формирует скелетные метастазы (Peng Y. et al., 2013). Исследование роли транскрипционного фактора Osterix (Osx/SP7), являющегося одним из важнейших регуляторов дифференцировки остеобластов и формирования кости в содействии инвазии рака молочной железы и метастазирования костей позволило установить, что активация Osx была связана с метастазами в лимфатических узлах и негативным прогнозом для общей выживаемости. Нокдаун Osx ингибировал инвазию рака молочной железы и остеолитических метастазов путем подавления MMP9, MMP13, VEGF, IL-8 и ПТГрП, которые участвуют в инвазии, ангиогенезе и остеолизе, а избыточная экспрессия Osx усиливала экспрессию мРНК этих факторов. Учитывая роль этих факторов в ангиогенезе, дифференцировке и активации остеокластов и при инвазии, Yao B. et al., (2019) констаировали, что Osx может способствовать метастазированию кости при раке молочной железы путем регуляции белков, участвующих в метастатическом каскаде.
Появляется все больше доказательств того, как факторы роста, происходящие из кости, особенно трансформирующий фактор роста β (TGF- β), могут влиять на фенотип раковых клеток, усиливая их рост в кости (Mundy G.R., 2002; Yin J.J. et al., 1999; Martin T.J., 2002). TGF-b, который откладывается в костном матриксе остеобластами и высвобождается во время остеокластической резорбции играет значительную роль в прогрессировании остеолитических метастазов (Fox S., Lovibond A., 2005). Активный TGF- β, высвобождаемый из костного матрикса во время резорбции кости, индуцирует продуцирование клетками рака молочной железы остеолитических факторов, включая ПТГрП и IL-11. В доклинических моделях убедительно доказана роль TGF- β в стимуляции выработки ПТГрП клетками рака молочной железы и усилении их роста в кости (Kiriyama T. et al., 1992; Kingsley L. et al., 2007). TGF- β связывается с поверхностным клеточным гетеродимерным рецептором и его эффекты опосредуются через внутриклеточные медиаторы, известные как семейство белков Smad (цитоплазматические медиаторы большинства сигналов TGF- β ), и митоген-активируемую протеинкиназу (MAP Kinase), которая усиливает секрецию ПТГрП клетками рака молочной железы (Kingsley L. et al., 2007). Дальнейший потенциальный вклад TGF- β локально обусловлен его способностью усиливать RANKL-индуцированное образование остеокластов (Sells Galvin R.J. et al., 1999) и ангиогенеза (Duivenvoorden W.C. et al., 1999). Кроме того, повышение уровня кальция в окружающей среде значительно увеличивало выработку ПТГрП клетками рака молочной железы человека (MCF 7) in vitro, а также усиливало индуцированное TGF- β повышение ПТГрП (Duivenvoorden W.C. et al., 2000). Совместные эффекты ПТГрП и TGF- β усиливают локальные события в кости в пользу роста опухоли, иллюстрируя основное влияние на поведение рака в микроокружении кости (Mundy G.R., 2002). В доклинических исследованиях сигнальная блокада TGF- β ингибирует секрецию ПТГрП клетками рака молочной железы и подавляет развитие метастазов в костях (Bandyopadhyay A. et al., 2006; Ganapathy V. et al., 2010).
Членами суперсемейства TGF- β являются костные морфогенетические белки (BMPs), которые регулируют клеточную дифференцировку, пролиферацию, апоптоз и подвижность, особенно в эмбриональном развитии и гомеостазе тканей (Ye L. et al., 2009; Davis H.R. et al., 2016). Участие BMPs в остеогенезе и костном метаболизме привлекло внимание к потенциальной роли BMPs в костном метастазировании опухоли. Это особенно относится к раку молочной железы, который обычно метастазирует в кость, и в ходе которого были выявлены нарушения как экспрессии, так и передачи сигналов BMP, которые клинически коррелируют с прогрессированием рака молочной железы (Zabkiewicz C. et al., 2017). BMPs способны регулировать рост клеточных линий рака молочной железы: BMP-2, BMP4, BMP-6, BMP-9, BMP-10, BMP-15 и GDF9a препятствуют пролиферации клеток рака молочной железы (Hanavadi S. et al., 2007; Du J. et al., 2008; Alarmo E.L., Kallioniemi A. 2010; Ye L. et al., 2010; Ren W. et al., 2014). BMP имеют двунаправленное действие при раке молочной железы, например BMP-4, который не только подавляет рост клеток рака молочной железы, но также способствует инвазии и миграции (Alarmo E.L. et al., 2013). Различие клинических результатов может отражать гетерогенность рака молочной железы и перекрестную связь передачи сигналов BMP с множеством других сигнальных путей, критических для опухолевого процесса молочной железы. BMP могут по-разному влиять на инвазию опухоли путем регулирования баланса MMP, компонентов внеклеточного матрикса, цитокинов и иммунных или воспалительных клеток в микроокружении опухоли (Zabkiewicz C. et al., 2017). При метастазировании рака молочной железы ПТГрП, высвобождаемый из опухолевых клеток, усиливает экспрессию RANKL в преостеобластах, одновременно подавляя экспрессию остеопротегерина, приводя к стимуляции остеокластов и последующей резорбции кости. Остеокластическая активность, в свою очередь, увеличивает выработку факторов, которые увеличивают продукцию ПТГрП, включая TGF β, инсулиноподобный фактор роста (IGF), тромбоцитарный фактор роста (PDGF) и BMPs, и это поддерживает выживание опухоли (Suvannasankha A., Chirgwin J.M., 2014; Yardley D.A., 2016).
Исследования клеточных линий рака молочной железы, генетически измененных мышей и клинических серий показали противоречивые результаты относительно влияния ПТГрП на клеточный обмен, рост опухоли или клинический исход (Wysolmerski J.J., 2012; Cheung V. et al., 2013; Henderson M.A. et al., 2006; Shen X. et al., 2004; Li J. et al., 2011). Предполагают, что изменения в экспрессии ПТГрП или сигнализации способствуют инициации рака молочной железы и/или его прогрессированию (Garcia-Closas M. et al., 2013; Michailidou K. et al., 2013).
Злокачественная трансформация ткани молочной железы может повлечь за собой изменение нормальной отрицательной обратной связи, которая существует между CaSR и ПТГрП, что приводит к стимуляции, а не ингибированию продукции ПТГрП, когда внеклеточный кальций повышен. Было показано, что клетки рака молочной железы экспрессируют CaSR, который затем участвует в стимулировании производство ПТГрП опухолевыми клетками в костном матриксе, таким образом индуцируя процесс остеокластической активации (Mihai R., 2008).
Kim W. et al., (2016) изучили взаимодействие между CaSR и ПТГрП в опухолях молочной железы у человека и грызунов, в клеточных линиях рака молочной железы и в трансгенной модели рака молочной железы. Полученные результаты подтверждают, что передача сигналов CaSR стимулирует продукцию ПТГрП in vitro и in vivo. Установлено, что активация CaSR усиливает выработку ПТГрП, стимулирует пролиферацию клеток рака молочной железы и защищает от апоптоза. Эффекты передачи сигналов CaSR на пролиферацию клеток и апоптоз in vitro опосредованы ПТГрП, действующим в ядре клеток. Предполагают, что активация оси CaSR-ПТГрП позволяет клеткам рака молочной железы противостоять апоптозу путем ингибирования ядерного накопления фактора, индуцирующего апоптоз (AIF), представляющего собой митохондриальный белок, высвобождаемый в цитоплазму в ответ на клеточную перегрузку кальцием (Sevrioukova I.F., 2011; Hangen E. et al., 2010). Активация CaSR также защищала клетки рака молочной железы от каспазо-независимой гибели клеток, опосредованной AIF. Следовательно, активация пути CaSR-ПТГрП защищает клетки от апоптоза путем предотвращения высвобождения AIF из митохондрий и / или путем предотвращения его накопления в ядре.
Снижение экспрессии CaSR в трансгенных опухолях молочной железы и в клеточных линиях рака молочной железы ингибировало продукцию ПТГрП и замедляло рост опухолевых клеток. Следовательно, ингибирование оси CaSR-ПТГрП, по-видимому, преобразует ответ клеток рака молочной железы на внеклеточный кальций из поддержки роста опухоли в торможение роста опухоли. В совокупности эти данные свидетельствуют о том, что активация CaSR способствует росту рака молочной железы, по крайней мере частично, благодаря интракринному действию ПТГрП. Эти результаты убедительно показывают, что активация CaSR стимулирует выработку ПТГрП раком молочной железы при физиологических концентрациях кальция. В отличие от этого, активация CaSR снижает выработку ПТГрП нормальными эпителиальными клетками молочной железы в культуре (Mamillapalli R. et al., 2008; Li H. et al., 2015; VanHouten J. et al., 2004), а условная абляция гена CaSR в лактирующей молочной железе увеличивает выработку ПТГрП (Mamillapalli R. et al., 2013). В нормальных эпителиальных клетках молочной железы активация CaSR во время лактации ингибирует синтез и секрецию ПТГрП, тем самым регулируя материнский кальций и метаболизм кости. Напротив, в клетках рака молочной железы Ca2+, высвобождаемый при разрушении костного матрикса, связывается с CaSR и стимулирует секрецию ПТГрП (Kim W., Wysolmerski J.J., 2016). Это противоречивая функция возможна благодаря способности CaSR связывать и активировать различные G белковые субъединицы в нормальных эпителиальных клетках молочной железы и в клетках опухоли специфичным для различного типа клеток образом (Mamillapalli R. et al., 2008).
Таким образом, злокачественная трансформация эпителиальных клеток молочной железы перестраивает отношения между CaSR и ПТГрП, так что внеклеточный кальций, который подавляет продукцию ПТГрП в нормальных клетках, вместо этого становится стимулом для производства ПТГрП злокачественными клетками. Поскольку ПТГрП активирует периопухолевый остеолиз, это изменение в продукции ПТГрП может способствовать развитию костных метастазов. Убедительно продемонстрирована положительная корреляция между экспрессией CaSR при первичном раке молочной железы и наличием метастазов в костях (Mihai R. et al., 2006).
Вышеприведенная информация позволила установить взаимосвязанную последовательность событий определяющих развитие скелетного метастазирования рака молочной железы. Первичные опухоли молочной железы экспрессируют CXCR4 (Luker K.E., Luker G.D., 2006), один из маркеров метастазирования, и секретируют ПТГрП. Стромальные клетки костного мозга и остеобласты секретируют много хемокинов, включая CXCL12 (Bussard K.M. et al., 2010), который привлекает CXCR4-положительные клетки рака молочной железы, возвращаясь и колонизируя в кости. В ответ на воздействие костного микроокружения клетки рака молочной железы, метастазирующие в скелет, продуцируют больше ПТГрП, чем клетки первичной опухоли (Powell G.J. et al., 1991). Стромальные клетки и остеобласты костного мозга, но не остеокласты, экспрессируют PTH1R. ПТГрП связывается с PTH1R главным образом для индукции секреции RANKL, который связывается со своим рецептором RANK на клетках-предшественниках остеокластов и индуцирует дифференцировку и созревание остеокластов. Активированные остеокласты стимулируют резорбцию кости и последующее разрушение костного матрикса. Повышенный внеклеточный Ca2+, высвобождаемый из резорбированной кости, связывается с CaSR на метастатических клетках рака молочной железы в микроокружении кости. В отличие от нормальных клеток молочной железы, активация CaSR индуцирует G αs/цАМФ сигнализацию в клетках рака молочной железы и вызывает продукцию дополнительного ПТГрП (Mamillapalli R. et al., 2008). Кроме того, факторы роста, такие как трансформирующий фактор роста β и инсулиноподобный фактор роста 1, которые накапливаются во время формирования кости, высвобождаются в местах резорбции кости и взаимодействуют с эффектами Ca2+.на CaSR, чтобы облегчить секрецию ПТГрП и усилить остеолиз (Sanders J.L. et al., 2000; Guise T.A., Chirgwin J.M., 2003). ПТГрП может также действовать как интракринный фактор, способствующий пролиферации опухоли (Kim W. et al., 2016), который не зависит от PTH1R, а затем усиливает метаболизм костной ткани, тем самым управляя порочным кругом опухоли. Таким образом, взаимодействие ПТГрП-PTH1R инициирует порочный цикл, и последующая передача сигналов Ca2+-CaSR усиливает проявление метастазов в костях, что, в свою очередь, регулирует выработку ПТГрП, тем самым обостряя остеолитическую болезнь. Следовательно, согласованное взаимодействие PTH1R и CaSR, вызывает разрушение кости и прогрессирующий рост опухоли (Yang Y., Wang B., 2018).
Предположение о том, что ПТГрП может оказывать протективное действие на одной стадии рака и играть патогенетическую роль на другой, достаточно аргументировано, учитывая, что роль этого белка в формировании метастазирования кости, по существу, заключается в обеспечении специфической способности стимулировать резорбцию кости, дополняя тем самым общие инвазивные свойства раковых клеток, и, кроме того, производство ПТГрП может быть легко увеличено местными условиями в кости (Henderson M.A. et al., 2006). Другим примером белка с дивергентным эффектом при раке является TGF- β, который на ранней стадии действует как супрессор опухолей, ингибируя пролиферацию эпителиальных, эндотелиальных и кроветворных клеток. Вывод о том, что ПТГрП-позитивность опухоли независимо предсказывает улучшение выживаемости пациентов с уменьшением метастазов во всех участках, включая кость, никоим образом не исключает критической роли ПТГрП в облегчении образования метастазов в костях (Henderson M.A. et al., 2006). Важным следствием этих результатов является то, что продукция ПТГрП клетками рака молочной железы придает им менее злокачественный фенотип, менее инвазивный и менее вероятный в результате образования метастазов. Таким образом, это предполагает, что ПТГрП-негативный рак молочной железы может быть относительно обогащен общими инвазивными свойствами, которые необходимы для метастазирования. Достигнув костного мозга и проявив эти общие инвазивные свойства, раковые клетки подвергаются воздействию факторов окружающей среды, благодаря которым они приобретают особые свойства, необходимые для проникновения в кость, то есть повышенное производство ПТГрП, приводящее к увеличению образования остеокластов и резорбции кости (Henderson M.A. et al., 2006).
Продуцируемый опухолевой тканью ПТГрП, по-видимому, является важнейшим компонентом цепи сигнальных событий среди клеток микроокружения кости, которыей способствует как разрушению кости, так и росту опухолевых клеток (Guise T.A. et al., 1996; Kozlow W., Guise T.A., 2005). Во многих клинических исследованиях изучалось влияние ПТГрП на первичные метастатические опухоли. Ретроспективное исследование RT-PCR показало увеличение транскриптов ПТГрП в первичных опухолях пациентов, у которых впоследствии развились метастазы в кости (Bouizar Z. et al., 1993). Результаты распространения этого исследования на большую когорту показали, что транскрипты, кодирующие изоформу 139 остатков, были сверхэкспрессированы в опухолях, которые метастазировали в кости (Bouizar Z. et al., 1999; Guise T.A. et al., 2002). ПТГрП, продуцируемый клетками рака молочной железы, может способствовать развитию метастазов скелета за счет повышения выживаемости опухолевых клеток в кости или путем стимулирования инвазии кости опухолевыми клетками (Brundred N.J. et al., 1992).
Клетки рака молочной железы часто распространяются в кости, где они образуют остеолитические метастазы. Обнаружено, что 69 % пациентов, умерших от рака молочной железы, имели метастазы в кости (Coleman R.E., Rubens R.D., 1987). Предполагается, что ПТГрП оказывает непосредственное влияние на рост опухоли как на скелетных, так и на нескелетных участках (Rabbani S.A. et al., 2005). Другие взаимодействия между опухолью и костью, такие как стимуляция появления опухоли через хемокиновый рецептор CXCR4 с помощью его фактора-1-альфа альфа-стромальной клетки, происходящего из кости (SDF-1), могут быть ответственны за сайт-специфическую склонность рака молочной железы к метастазированию в кости (Kozlow W., Guise T.A., 2005).
ПТГрП может опосредовать локальное разрушение кости в отсутствие повышенного циркулирующего ПТГрП (Rong H. et al., 1999). Недавняя работа показывает, что ПТГрП оказывает свое влияние на клеточную адгезию, миграцию, инвазию и экспрессию интегрина через интракринный путь (Shen X. et al., 2004). Рецептор PTH1R часто экспрессируется в скелетных метастазах при раке молочной железы и это указывает на то, что избыточная экспрессия рецептора стимулирует пролиферацию посредством аутокринных сигналов (Hoey R.P. et al., 2003). Нейтрализующие антитела против ПТГрП ингибируют как развитие, так и прогрессирование костного метастазирования клетками линии рака молочной железы
человека MDA-MB-231 у мышей (Burtis W. et al., 1990; 1992). ПТГрП, продуцируемый клетками рака молочной железы, может дать им возможность расти и проникать в кости, стимулируя остеокластическую активность и резорбцию кости (Kozlow W., Guise T.A., 2005; Martin T.J., Johnson R.W., 2019). Большинство (65 %) пациентов с гиперкальциемией с метастазированием рака молочной железы в кости имели повышенные концентрации ПТГрП в плазме (Powell G.J. et al., 1991). Исследования с использованием ОТ-ПЦР, которые являются значительно более точными, чем иммунохимия, показали, что мРНК ПТГрП присутствовала в 82 % случаев первичного рака молочной железы (Bouizar Z. et al., 1993). мРНК ПТГрП выявлен у 97 % пациентов с первичным раком молочной железы, у которых впоследствии развились метастазы в кости (Bouizar Z. et al., 1993, 1999). Полагают, что различные молекулярные механизмы объясняют различие в фенотипе остеобластических и остеолитических костных метастазов. Так, при раке молочной железы в формирование остеолитических метастазо вовлечены ПТГрП, трансформирующий фактор роста β
, в то время как в остеобластических поражениях (при раке предстательной железы) участвуют эндотелин-1 и морфогенетические белки и ряд других биоактивных молекул (Fang J., Xu Q., 2015).
Показано, что ПТГрП негативно регулирует гены покоя опухолевых клеток молочной железы. В эксперименте на иммунодефицитных мышей, которым внутрисердечно инокулировали клетки рака молочной железы человека линии MCF7, зафиксировано, что эти клетки «живут» в костях, но не растут, что подтверждено иммуногистохимической оценкой индекса пролиферативной активности KI 67 и таким образом, служат моделью покоя рака молочной железы in vivo (Johnson R.W. et al., 2018). Ранее эти же исследователи показали, что сверхэкспрессия ПТГрП в клетках MCF7 преодолевает этот спящий фенотип, вызывая их рост в виде остеолитических образований, и что клетки MCF7 со сверхэкспрессией ПТГрП демонстрируют значительно более низкую экспрессию генов, связанных с покоем, по сравнению с контролем (Johnson R.W. et al., 2016). Полученные данные свидетельствуют об отсутствии ответа цАМФ в клетках MCF7 на полноразмерный ПТГрП (1–141) и ПТГ (1–34) в широком диапазоне доз, хотя мРНК PTHR1 была обнаружена в клетках MCF7 и в восьми других клеточных линиях рака молочной железы человека. Избыточная экспрессия ПТГрП в клетках MCF7 изменила уровни экспрессии многих генов, однако анализ RNAseq показал, что PTHR1
не был изменен. Вместо этого избыточная экспрессия ПТГрП в клетках MCF7 приводила к значительной активации сигнального пути кальция, что подтверждает ранее полученные данные о роли чувствительного к кальцию рецептора CaSR, активация которого стимулировала выработку ПТГрП клетками рака молочной железы in vitro и in vivo и способствует пролиферации клеточных линий рака молочной железы человека (Kim W. et al., 2016). Результаты исследования позволили предположить, что PTHR1 в клетках рака молочной железы MCF7 функционально не связан с активацией пути цАМФ, а реакции генной экспрессии на избыточную продукцию ПТГрП являются результатом аутокринного или интракринного действия ПТГрП, независимо от взаимодействия с PTHR1, через сигналы, исходящие от других доменов в молекуле ПТГрП. В недавней публикации (Martin T.J., Johnson R.W., 2019) сообщено о результатах исследования во многом поддерживающих вышеприведенное предположение. В этой работе ПТГрП также был идентифицирован как фактор, способствующий появлению клеток рака молочной железы в состоянии покоя в кости. В этом случае ПТГрП не функционировал посредством активации PTH1R, несмотря на то, что он оказывал очень существенное влияние на транскрипционную активность клеток рака молочной железы. Это указывает на действия ПТГрП, которые не являются каноническими, то есть опосредованы доменами, отличными от аминоконцевых и сделан вывод о том, что эффекты ПТГрП в патофизиологии рака молочной железы индуцируются другими доменами этого белка.
Множественные эффекты ПТГрП при метастазировании рака молочной железы в кость были установлены, в частности, когда ПТГрП также был идентифицирован как фактор, способствующий появлению клеток рака молочной железы в состоянии покоя в кости. В этом случае ПТГрП не функционирует посредством активации PTH1R, несмотря на то, что он оказывает очень существенное влияние на транскрипционную активность клеток рака молочной железы. Это указывает на действия ПТГрП, которые не являются каноническими, то есть опосредованы доменами, отличными от аминоконцевых. Сделан вывод о том, что ПТГрП обладает несколькими различными паракринными, аутокринными и внутрикринными действиями в ходе патофизиологии рака молочной железы. Некоторые опосредованы действием на PTH1R, другие контролируются другими доменами внутри ПТГрП (Martin T.J., Johnson R.W., 2019).
Несмотря на развитие как противораковой, так и остеотропной терапии в последние годы, новые терапевтические стратегии продолжают активно развиваться. Факторы, взаимодействующие специфически с PTH1R или CaSR влияют на пути передачи сигналов ПТГрП-PTH1R и Ca2+-CaSR в порочном цикле и могут использоваться для предотвращения метастазов в кости и связанного с ними разрушения кости. Как PTH1R, так и CaSR участвуют в развитии опухоли в кости и влияют на метастатическую нишу скелета. Терипаратид и абалопаратид успешно применяются при остеопорозе. Агонист CaSR Цинакальцет (Cinacalcet) эффективно использовался для снижения уровня кальция в крови у пациентов с раком молочной железы с гиперкальциемией. Цинакальцет ослабил ПТГрП-опосредованное повышение уровня ионизированного кальция в крови, что сопровождалось повышением уровня кальцитонина в плазме (Colloton M. et al., 2013). Агонист CaSR второго поколения Этелкальцетид (Etelcalcetide) (AMG 416) был недавно одобрен для лечения вторичного гиперпаратиреоза. Дихлорид радия-223 является кальцимиметиком, который связывается преимущественно с новообразованной костью в областях метастазов, является первым альфа-излучающим радионуклидом, разработанным для клинического применения, и одобрен для лечения симптоматических метастазов в кости (Coleman R., 2016).