
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
5.1.6. Изучение структуры рассолов
В настоящее время структура таких концентрированных растворов, какими являются рассолы, достоверно не изучена. Исследовав структуру растворителя и раствора, возможно использовать полученные данные для эффективного использования гидроминерального сырья. До сих пор неизвестно, что будет происходить в рассоле при понижении температуры, а также возможно ли селективное разделение компонентов рассола при вымораживании.
Метод ядерного магнитного резонанса (ЯМР) занимает одно из ведущих мест среди других физико-химических методов в изучении состава, строения сложных систем природного и синтетического происхождения.
Основу применения спектроскопии ЯМР для определения структуры неизвестных веществ составляют эмпирически найденные корреляции между химическим сдвигом и спин-спиновым взаимодействием, с одной стороны, и строением образца - с другой. Ядерный магнитный момент оказался очень чувствительным показателем для получения обширной информации. По значениям химического сдвига можно судить о химическом окружении ядра. Спин-спиновое взаимодействие дает возможность определить положение ядер относительно друг друга. Еще одна область возможных применений спектроскопии ЯМР основана на том, что спектры ЯМР многих соединений зависят от температуры. Для большого числа молекул форма сигнала ЯМР зависит от динамических процессов, и скорости таких процессов можно изучать с помощью спектроскопии ЯМР [80]. Порядок величины констант скоростей, которые можно определить этим методом, лежит между 10-1 и 105с-1 . Также метод ЯМР может показать как изменяется тип гидратации в зависимости от температуры, определить подвижность воды в гидратных оболочках.
Результаты многочисленных исследований действия ионов на структуру воды можно суммировать следующим образом (Таблица 7):
Таблица 7. Действие ионов на структуру воды
|
Ионы, понижающие структурную температуру |
Ионы, повышающие структурную температуру |
|
(положительная гидратация) |
(отрицательная гидратация) |
|
Mg2+ > Y+> Са2+ > Na+ |
K+>Rb+>Cs+ |
|
OH-> F- |
ClO4 >> Вг->N03- >Сl- |
Существует предельная температура, при которой в результате структурных изменений воды происходит компенсация упорядочивающего и разупорядочивающего влияния ионов и смена одного вида ближней гидратации на другой (переход положительной гидратации в отрицательную при Т<Тпред и наоборот). Смена эффекта с разупорядочивающего на упорядочивающий для катионов связывается с положением их в Периодической системе с увеличением периода, а следовательно, и радиуса иона. В табл.8 даны значения предельных температур для основных компонентов рассолов.
Таблица 8. Значения предельных температур гидратации ионов
|
Ион |
Тпред, К [81] |
Тпред, К [82] |
Стехиометрическая смесь |
Тпред, К [83] |
Тпред, К [84] |
|
Na+ |
293,15 |
293,15 |
Na+ - Cl- |
304 |
300,15 |
|
K+ |
370 |
343,15 |
K+ - Cl- |
343 |
325,15 |
|
Rb+ |
373 |
365,15 |
Rb+ - Cl- |
354 |
336,15 |
|
Li+ |
261 |
- |
Li+ - Cl- |
278 |
|
|
Cl- |
318 |
308,5 |
Sr2+ - 2Cl- |
282 |
|
|
|
|
|
Ca2+ - Cl- |
275 |
|
В работе [47] представлены результаты измерений химического сдвига
(d 17O) и скорости релаксации ядер кислорода 17О (Dn 17O) для систем "вода - соли" при изменении концентрации электролитов 10-3 - 5 моль/л, где в качестве солей выступают KCl, NaCl. Полученные результаты приводятся с целью охарактеризовать механизм образования гидратных оболочек катионами в водных растворах и возможность изоморфного замещения в структуре воды. Обнаружены существенные различия во влиянии катионов K+, Na+ на упорядоченность воды (рис. 35).
Установлено[1] изменение состояния воды в зависимости от природы и концентрации неорганических солей и обнаружены существенные различия во влиянии катионов калия и натрия на упорядоченность воды (натрий является структурообразующим ионом, калий обладает бинарными свойствами - структуроразрушающими и структурообразующими).
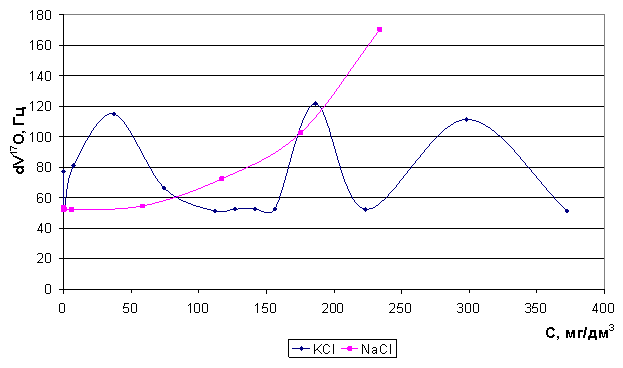
Рис. 35.Зависимость Δν17О от концентрации ионов калия и натрия
Проведены эксперименты по изучению влияния температуры воды на её спектральные характеристики. Структура воды с ростом температуры существенно разрушается. Повышение температуры приводит к разрушению разрыву водородных связей, снижению координационного числа молекул воды, с дальнейшим переходом воды в газообразное состояние. Увеличение температуры от 0 до 75оС приводит к значительному уменьшению количества водородных связей. Воздействие температуры на структуру воды отражается в изменении её спектральных характеристик [85].
Эксперименты по изучению влияния температуры на изменение ширины линии воды, а, следовательно, и на ее спектральные характеристики показывают, что повышение температуры до 75оС существенно понижает ширину линии (≈ 30 Гц) в спектре ЯМР 17О (рис. 36).
На основании этих экспериментальных данных можно сделать однозначный вывод о существенном разрушении структуры воды, проявляющемся в значительном увеличении времени спин-спиновой релаксации с ростом температуры. С увеличением температуры образца воды происходит смещение значений d 17O в более сильное поле, что отражает увеличение электронной плотности на ядрах кислорода воды из-за разрушения мостиковых водородных связей между молекулами H2O.
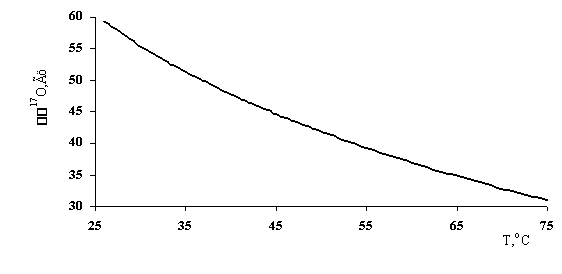
Рис. 36. Зависимость Δv17О от температуры
Эксперименты, проведенные по изучению диапазона изменений релаксации в рассолах Удачнинского ГОКа, показали, что для проб рассолов, отобранных с различных глубин, этот диапазон лежит в пределах 216 - 223 Гц (к примеру, для воды этот диапазон 70-90 Гц). Это означает, что как таковой воды в рассолах не содержится, она вся находится в кластерах, в связанном состоянии (распределена между ионами) и вода имеет сильно структурированный характер. При повышении температуры исходных образцов также была определена величина химического сдвига, диапазон изменений релаксации при повышении температуры до 75°С составил 105-106 Гц - вода высвобождается из ионных комплексов, структура воды разрушается. Нами была установлена корреляция между содержанием ионов калия и хлора и величиной химического сдвига при снижении общей минерализации растворов методом разбавления.
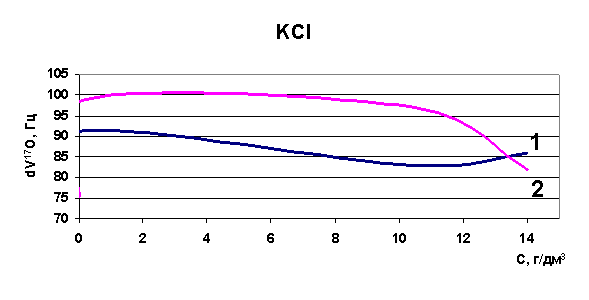
Рис. 37. Зависимость скорости релаксации ядер кислорода от концентрации калия
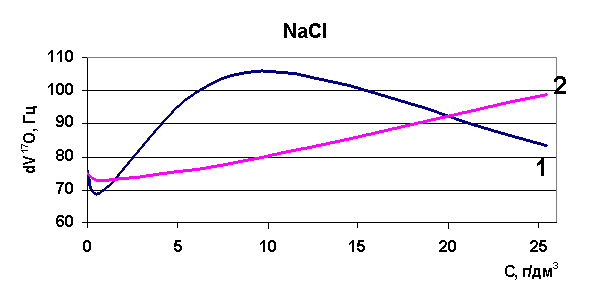
Рис. 38. Зависимость скорости релаксации ядер кислорода от концентрации натрия
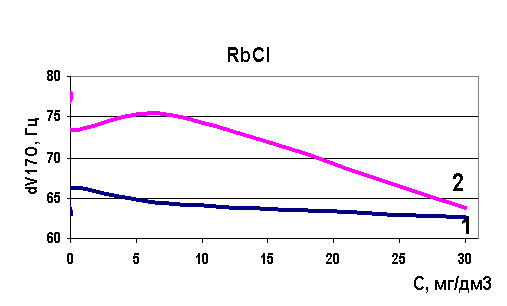
Рис. 39. Зависимость скорости релаксации ядер кислорода от концентрации рубидия
Определена величины релаксации модельных растворов 2-валентных ионов - Sr, Ca; аддитивность влияния ионов на химический сдвиг. Ранее исследование 2-валентных ионов не проводилось.
Определены величины изменения релаксации в модельных растворах рассольных концентраций для растворов натрия, калия, стронция, лития и рубидия. Выявлено, что в изобарно-изотермических условиях для индивидуальных растворов Sr, Na, K, Li разной концентрации наблюдается то разрушение (минимум скорости релаксации на рисунках) структуры растворителя, то упрочнение (максимум скорости релаксации на рисунках). Ранее считалось, что различные ионы обладают либо структурирующим действием на воду, либо разрушающим, инверсия гидратация могла происходить при достижении раствором предельной температуры Тпред. Наши результаты явно говорят о наличии бинарных свойств у одних и тех же ионов при разных концентрациях (рис. 37-40). Кривая 1 - результаты ЯМР на свежеприготовленных растворах, кривая 2 - результаты ЯМР через 24 часа.
По литературным данным [86] тип гидратации не меняется для двухвалентных катионов II группы Периодической системы, но их стехиометрические смеси с анионом изменяют вид гидратации при температурах меньших, чем для катиона.
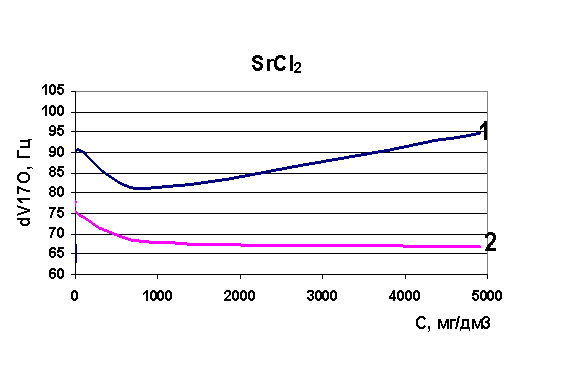
Рис. 40. Зависимость скорости релаксации ядер кислорода от концентрации стронция
На основе изучения химического сдвига в растворах индивидуальных солей различных концентраций (моделирующих природные рассолы) установлены области концентраций, характеризующиеся резким изменением структуры воды в растворах и соотношением ионных и ассоциированных форм компонентов. Установлена корреляция концентрационных интервалов изменения свойств по результатам ЯМР с расчетными величинами, полученными на основе термодинамических расчетов (см. раздел 3,4).
[1] Исследования выполнены на химическом факультете ГОУ ВПО ИГУ. Авторы выражают благодарность д.х.н., профессору, заведующему кафедрой Иркутского государственного университета Д.Ф.Кушнареву за проведение исследований по ЯМР спектроскопии рассолов и растворов и научные консультации.
