
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
6.3.1. Влияние температурного режима на кристаллизацию солей
Температурный режим определяет в первую очередь скорость протекания процесса вымораживания.
Температура в области положительных и отрицательных значений влияет на скорость реакций, растворимость соединений, скорость растворения, коагуляции, а также на концентрацию недиссоциированных ионных пар. Различают несколько разновидностей температуры в растворах: структурная, температура замерзания. Температура начала кристаллизации (температура замерзания) - температура, при которой в результате охлаждения раствора начинается образование кристаллов. Понижение температуры замерзания ΔТз - разность между температурой замерзания чистого растворителя и раствора. Температура замерзания рассола всегда ниже температуры замерзания чистой воды и зависит от концентрации растворенных солей. Эта зависимость для рассолов может быть выражена уравнением:
ΔТз = KC,
где К - коэффициент пропорциональности; С - концентрация растворённого вещества в растворе.
В менее разбавленных растворах температура начала кристаллизации определяется по диаграмме состояния соответствующей системы. Поскольку температура замерзания морских вод и высокоминерализованных природных рассолов будет различной, то мы предполагаем, что расчёт этой температуры следует вести по разным формулам.
Нами была произведена аппроксимация экспериментальных данных по температурам замерзания растворов поваренной соли, морской воды и используемых в работе природных рассолов. Зависимости изменения температур замерзания в графической и аналитической формах представлены на рисунках 41-43.
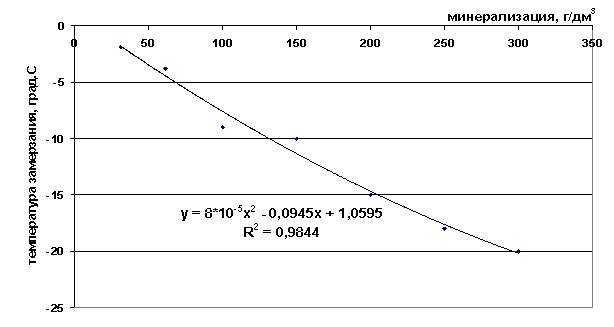
Рис. 41. Зависимость температуры замерзания от минерализации раствора поваренной соли
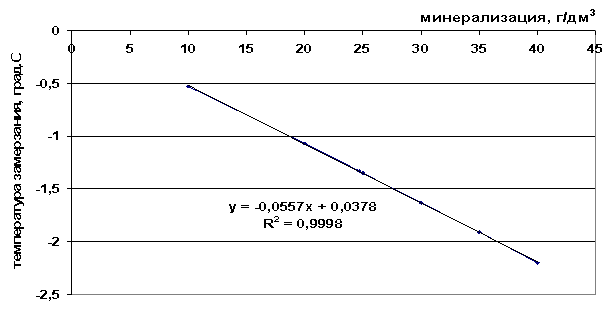
Рис. 42. Зависимость температуры замерзания морской воды от минерализации
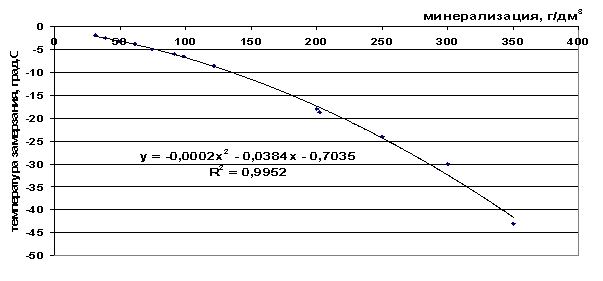
Рис. 43. Зависимость температуры замерзания рассола от минерализации
Из представленных значений температур замерзания (табл. 9) видно, что температура замерзания понижается по мере увеличения общей минерализации раствора и по мере увеличения числа компонентов, входящих в замораживаемую систему - ΔТз(NaCl) < ΔТз(морск.вода) < ΔТз(рассол).
Таблица 9. Анализ построенных графических зависимостей
|
Собщ, г/дм3 |
Температура замерзания, °С |
||
|
раствор NaCl |
морская вода |
рассол |
|
|
t=8∙10-5M2-0.0945M+1.0595, *R2 = 0,9844 |
t= -0.0557M+0.0378, *R2 = 0,9998 |
t=-2∙10-4M2-0.0384M-0.7035, *R2 = 0,9952 |
|
|
10 |
0,12 |
-0,52 |
-1,11 |
|
20 |
-0,8 |
-1,08 |
-1,55 |
|
30 |
-1,7 |
-1,63 |
-2,04 |
|
40 |
-2,59 |
-2,19 |
-2,56 |
|
50 |
-3,47 |
-2,75 |
-3,12 |
|
100 |
-7,59 |
- |
-6,54 |
|
150 |
-11,32 |
- |
-10,96 |
|
200 |
-14,64 |
- |
-16,38 |
|
250 |
-17,57 |
- |
-22,80 |
|
300 |
-20,09 |
- |
-30,22 |
|
350 |
-22,22 |
- |
-38,64 |
|
400 |
-23,94 |
- |
-48,06 |
|
450 |
-25,27 |
- |
-58,48 |
|
500 |
-26,19 |
- |
-69,90 |
|
550 |
-26,72 |
- |
-82,32 |
|
600 |
-26,84 |
- |
-95,74 |
*R2 - достоверность аппроксимации
Известно, что вымораживание индивидуальных солей из опресняемой воды происходит при различных температурах, - так, при температуре -2°С выпадает углекислый кальций. При - 3,5°С сернокислый натрий. При понижении температуры до -20°С выпадает поваренная соль, до - 25,5-26°С хлориды магния и при очень низких температурах - 40-55°С выпадают хлориды калия и кальция [60]. Для отрицательных температур специфичен процесс образования кристаллогидратов, неустойчивых при температурах ниже 0°С. Например, гидрогалит NaCl*2H2O образуется при -0,15°С, MgCl2*12H2O стабилен при -15°С, а MgCl2*8H2O - ниже 0°С, Na2CO3*7H2O формируется только при -10°С. KCl кристаллизуется при 0°С в виде KCl, при -6,6°С сосуществуют уже две фазы - KCl и KCl*H2O, при -10,6°С осаждается лишь KCl*H2O. При отрицательной температуре формируются индивидуальные кристаллогидраты с максимально возможным количеством молекул кристаллизационной воды соответственно координационным числам при данном её значении и их смеси (но не смешанные кристаллы). Следует отметить аномальное понижение температур замерзания концентрированных растворов.
