
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
6.4. Исследование распределения компонентов в процессе фракционной кристаллизации
Благодаря избирательному вовлечению в первом кристаллическом слое оказывается больше тех ионов, которые обладают большим коэффициентом распределения К+ или К-. Их величина зависит от подвижности ионов, и, возможно, от их структурирующего действия на замерзающий раствор.
Таблица 11. Подвижность ионов
|
Li+ |
Na+ |
Rb+ |
Mg2+ |
Ca2+ |
Sr2+ |
|
3,5-7 |
2-4 |
-1,1 |
10,5-13 |
7,5-10,5 |
5 |
|
4,5 |
-0,1 |
- |
12 |
10 |
10 |
|
7 |
5 |
- |
- |
- |
- |
Исходя из данных таблицы 11, подвижность ионов можно расположить в следующий ряд:
Mg2+ > Ca2+ > Sr2+ > Li+ > Na+ > Rb+
Подвижность двухзарядных катионов значительно превышает подвижность однозарядных катионов. Магний, кальций и натрий являются для рассолов Удачнинского ГОКа макрокомпонентами, в отличие от стронция, лития и рубидия. Если подвижность будет вносить значительный вклад в распределение ионов между фазами при замораживании рассолов, то возможно разделение микро- и макрокомпонентов непосредственно при этом процессе.
Возникновение на границе рассол-лёд разности потенциалов влечёт за собой дифференциацию катионов и анионов между твёрдой и жидкой фазами. Концентрация компонентов химического состава и суммарное содержание их во льду ниже, чем в льдообразующем рассоле. К такому распределению приводят уже отмеченные ранее адсорбция, адсорбционная окклюзия, окклюзия льдообразующей воды, дифференциация ионов под влиянием электрических потенциалов. Основная масса веществ остаётся в жидкой фазе, концентрация в которой по мере кристаллизации льда возрастает.
Суммарное воздействие этих процессов на распределение растворимых веществ между льдом и водой может быть описано через величину коэффициента вовлечения Кв:
Кв= М(лёд)/ М(рассол),
где М(лёд) и М(рассол) - соответственно концентрации веществ во льду и в льдообразующей воде (замораживаемом исходном рассоле).
Исследованные нами пробы рассолов Удачнинского ГОКа характеризуются значительным содержанием кальция (70 г/дм3), магния (11 г/дм3), натрия (21 г/дм3), а также наличием промышленно-ценных компонентов - лития (300 мг/дм3), рубидия (8 мг/дм3), стронция (1 г/дм3). При замораживании исходные пробы были разбавлены в несколько раз. Общая минерализация исходного рассола - 400 г/дм3. Минерализация разбавленных проб следующая: 200; 130; 90; 20 г/дм3. Пробы помещали в стаканы и замораживали наполовину в морозильной камере. Затем методом декантации отделяли ледяную фазу от жидкой, определяли концентрацию элементов в обеих фазах, что позволило найти коэффициенты вовлечения Кв в ледяную фазу катионов (таблица 12) .
Таблица 12. Коэффициенты вовлечения ионов в ледяную фазу при замораживании рассолов Удачнинского ГОКа
|
Катион |
1 проба (200 г/дм3) |
2 проба (130 г/дм3) |
3 проба (90 г/дм3) |
4 проба (20 г/дм3) |
||||
|
Cисх, мг/дм3 |
Кв |
Cисх, мг/дм3 |
Кв |
Cисх, мг/дм3 |
Кв |
Cисх, мг/дм3 |
Кв |
|
|
Ca |
36800 |
0,143 |
24500 |
0,068 |
14700 |
0,029 |
7400 |
0,0028 |
|
Mg |
5740 |
0,139 |
3800 |
0,067 |
2300 |
0,0295 |
1150 |
0,0029 |
|
Na |
10800 |
0,123 |
7170 |
0,056 |
4300 |
0,0167 |
2150 |
0,0054 |
|
Sr |
487 |
0,146 |
325 |
0,065 |
195 |
0,028 |
97 |
0,0026 |
|
Li |
154 |
0,138 |
103 |
0,07 |
62 |
0,03 |
31 |
0,0029 |
|
Rb |
4 |
0,148 |
2,6 |
0,069 |
1,5 |
0,028 |
0,8 |
0,0027 |
Для проб разных минерализаций получены различные ряды вовлечения катионов в лёд:
200 г/дм3: Rb+ > Sr2+ > Ca2+ > Mg2+ > Li+ > Na+
130 г/дм3: Li+ > Rb+> Ca2+ > Mg2+ > Sr2+ > Na+
90 г/дм3: Li+ > Mg2+ > Ca2+ > Rb+ > Sr2+ > Na+
20 г/дм3: Na+> Mg2+ > Li+ > Ca2+ > Rb+ > Sr2+
Если концентрация солей в замерзающем растворе далека от насыщающей, то их концентрация во льду намного ниже исходной (Кв<1). При насыщающей концентрации или несколько меньшей её, соотношение между концентрациями ионов во льду и в воде равно 1 или очень близко к ней. В первом приближении это объясняется тем, что количество жидкой фазы, захваченной льдом, незначительно, и тем, что образуются криогидраты (криоэвтектики). Химический состав льда, полученного при вымораживании рассола, - функция дифференциации растворимых веществ между ледяной и жидкой фазами.
Вследствие более высокой подвижности одного из ионов во льду возникает избыток соответствующего заряда, который компенсируется зарядом одного из ионов или радикалов воды. При К+>>К- во льду, заряжающемся положительно, впоследствии обнаруживается избыток ОН-; при К+<<К- во льду накапливается Н+. Концентрация ионов водорода во льду, образовавшемся из разбавленного раствора NaCl, значительно выше, чем в льдообразующей воде и её незамёрзшей части. Избыток заряда частично компенсируется Cl- - ионами, т.к. К- Cl- ниже К+ Na+.
Плавление льда вызывается усилением трансляционного движения молекул, что сопровождается разрывом некоторого количества водородных связей, а также, вероятно, изгибанием некоторых связей и попаданием отдельных молекул в пустоты структуры.
Графики на рис. 47-50 показывают распределение ионов в ледяной фазе в процессе оттаивания льда. По концентрациям первых порций оттаявшего льда можно сказать о том, какие ионы вовлекаются наиболее интенсивно в кристаллизующуюся фазу.
Калий выходит с первыми оттаявшими порциями (максимум концентрации) почти весь, следовательно, при замораживании раствора большая часть ионов калия вовлеклась в первый кристаллический слой, а оставшиеся ионы вовлекались в последующие кристаллические слои равномерно (рис. 47).
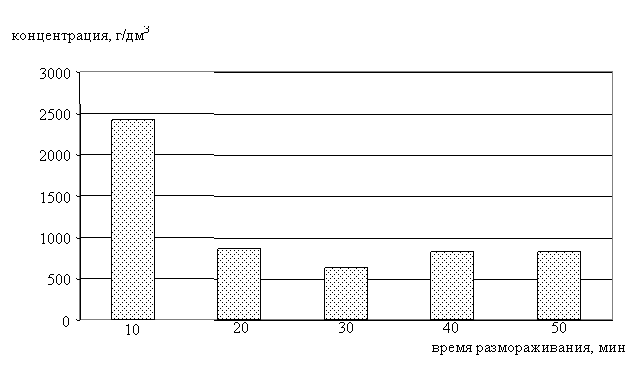
Рис. 47. Распределение ионов К+ в ледяной фазе в процессе таяния льда
Размораживание для ионов Na+ происходит с постепенным снижением концентрации в оттаиваемых порциях, то есть этот элемент практически равномерно распределён во всём объёме замёрзшей части (рис. 48).
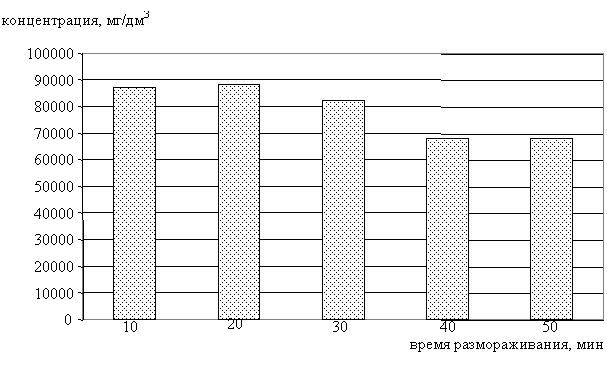
Рис. 48. Распределение ионов Na+ в ледяной фазе в процессе таяния льда
Для элементов Ca и Sr наблюдается увеличение концентрации на 40 минуте размораживания, что говорит о неравномерном вовлечении этих элементов в ледяную фазу при замораживании исходного рассола (рис. 49-50). Кальций и стронций являются геохимическими аналогами, чем и объясняется примерно одинаковый характер поведения их на диаграммах размораживания.
Начиная с температуры замерзания, образуются кристаллики льда, а щелочные и щелочноземельные металлы вытесняются в незамёрзшие области и их локальные концентрации увеличиваются. При этом ионы сближаются, между ними усиливаются магнитные диполь-дипольные взаимодействия. При температуре эвтектики жидкие микрообласти с ионами щелочных и щелочноземельных металлов должны затвердеть. В полностью затвердевшем растворе данные ионы оказываются в областях постоянного состава. При оттаивании раствора полностью повторяется кривая замораживания, но в обратном направлении, что полностью согласуется с литературными данными [79].
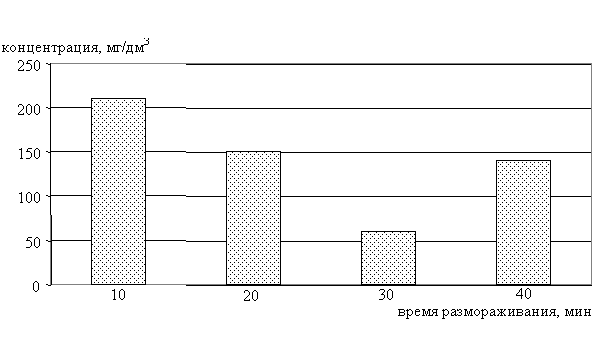
Рис. 49. Распределение ионов Sr2+ в ледяной фазе в процессе таяния льда
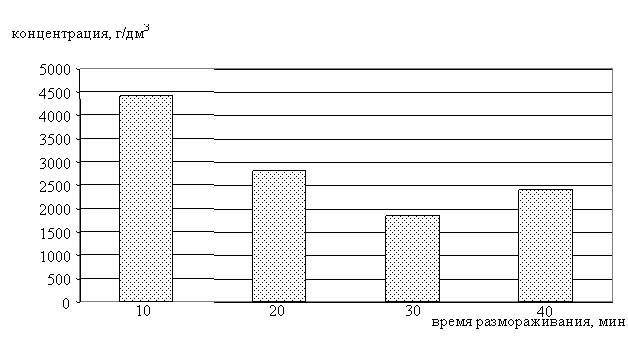
Рис. 50. Распределение ионов Ca2+ в ледяной фазе в процессе таяния льда
