
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

Практикум по спектроскопии. Вода в минералах: Учебное пособие
Шишелова Т. И., Созинова Т. В., Коновалова А. Н.,
4.3. Спектры воды в различных агрегатных состояниях
Спектры паров воды. Молекулы образуют различные комплексы. Пары воды - это плотность 10-3 г/см3 и ниже. Расстояние между молекулами ≈ 30 Ǻ. Молекулы в этих условиях совершают колебательные и вращательные движения, поэтому спектр воды в этом агрегатном состоянии состоит из очень большого числа линий (рис. 8).
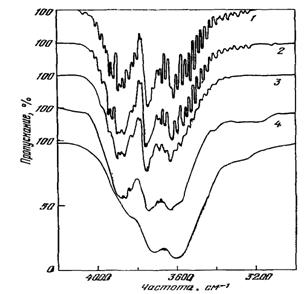
Рис. 8. Спектр пропускания паров воды при 350 °С. Плотность, кг/м3
(в скобках давление, бар): 1 - 1 (2,85); 2 - 3,2 (8,7); 3 - 10 (27,5); 4 - 32 (80); 5 - 100 (160)
Твердая фаза воды - лед, оказывается, тоже имеет далеко не единственную форму существования. В зависимости от внешних параметров - температуры и давления - реализуется одна из одиннадцати модификаций льда: Ih, Ic, II, III, IV, V, VI, VII, VIII, IX или аморфный лед, различающихся взаимным расположением молекул воды в решетке кристалла.
Наиболее распространенным в природе и поэтому лучше изученным является гексагональный лед Ih, образующийся при атмосферном давлении и плавном понижении температуры ниже 0°С (рис. 9).
При охлаждении до -130°С образуется кубический лед Iс с иным расположением молекул в кристаллической решетке, но, тем не менее, с совершенно тождественным спектром поглощения. При дальнейшем понижении температуры (ниже -150 °С) образуется аморфный или стеклообразный лед.
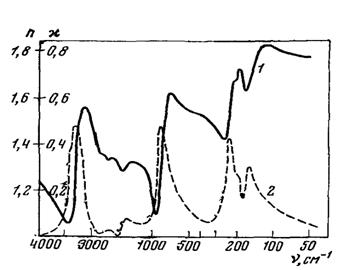
Рис. 9. Оптические постоянные поликристаллического гексагоидального льда
при -24 °С [10], 1 - показатель преломления; 2 - показатель поглощения
Колебательные полосы различных льдов и положение максимумов, наблюдаемых в спектре поглощения жидкой воды (см-1) при комнатной температуре, указаны в табл. 6 и 7 [2].
Таблица 6
Колебательные полосы различных льдов (см-1) (в скобках указана ширина)
|
Тип колебаний |
I |
II |
||||||
|
Н2О |
H-OD в D2О |
D2О |
D-ОН в Н2О |
Н2О |
H-OD в D2О |
D2О |
D-ОН в Н2О |
|
|
Валентное в ИК-спектре |
3220* (~500) |
3277 (~50) |
2425 * (~300) |
2421** (~30) |
3225* (~500) |
3373 3357 3323 |
~2380* |
2493 2481 2460 2455 |
Спектры поглощения жидкой воды. Обертонные колебания. Вода в жидком состоянии уже давно является объектом самых широких спектральных исследований.
В интервале частот от 14 000 до 3750 см-1 В. Лукком и В. Диттером были тщательно измерены спектры всех трех изотопных аналогов воды при температурах от -9 до 400° С. В этих работах было показано, что по мере повышения температуры все полосы испытывают плавное смещение в сторону больших частот, а их интенсивности начиная с +60° С монотонно увеличиваются.
Таблица 7
Положение максимумов, наблюдаемых в спектре поглощения
жидкой воды (см-1) при комнатной температуре, и их интерпретация по [2]
|
Отнесение |
H2О |
HDO |
D2О |
|
νuf |
3490 ± 10 |
3420 ± 10 |
2580 ± 10 |
|
Νsf |
3420 ± 10 |
2510 ± 10 |
2510 ± 10 |
|
ν2α |
3250 ± 10 |
2920 ± 10 |
- |
|
να+L |
2130 ± 20 |
- |
1550 ± 10 |
|
να |
1640 ± 5 |
1460 ± 5 |
1215 ± 5 |
|
νL |
700 ± 5 |
- |
525 ± 10 |
|
νT |
170 ± 5 |
- |
165 ± 5 |
Основные колебания воды. Изучение спектра валентных колебаний жидкой воды было начато сравнительно давно и продолжается до сих пор.
Сложную полосу жидкой воды можно разложить на гауссовские составляющие (рис. 10).
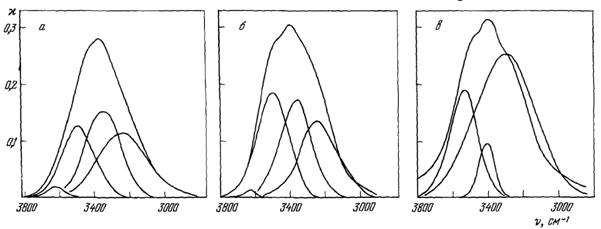
Рис. 10. Разложение сложной νOH-полосы жидкой Н2О на гауссовские составляющие
На рис. 11 приведена зависимость интенсивности полосы HDО от температуры, а на рис. 12 - зависимость интенсивности полосы HDО от плотности.
В согласии с этими измерениями находятся и результаты исследования жидкой фазы Н2O в интервале температур 20-370°С и при давлении насыщенных паров.
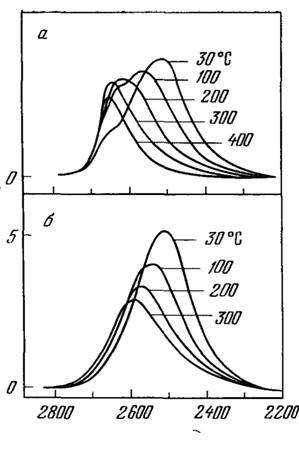
Рис. 11. Зависимость интенсивности полосы жидкой HDO от температуры при плотности воды 1000 кг/м3
а - спектр комбинационного рассеяния б - спектр поглощения [2]
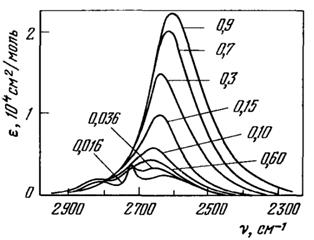
Рис. 12. Зависимость интенсивности полосы молекулы HDO при 400 °С от плотности [10]
Деформационные и межмолекулярные колебания воды. Кроме полос валентных колебаний в спектре жидкой воды присутствуют полосы деформационных vδ-, либрационных vL- и трансляционных vТ-колебаний, а также полоса составного колебания va+L. Большая ширина этих полос и высокий показатель поглощения создавали серьезные трудности для получения точных значений положений максимумов полос voh и vT.
В процессе растворения находящиеся в воде ионы и молекулы окружаются гидратной оболочкой. При этом связь молекул воды гидратного слоя с центральным ионом будет отличаться от связей между молекулами в жидкой воде. В результате этого колебательные частоты молекул воды гидратного слоя будут отличаться от частот колебаний молекул чистой воды.
Первую попытку охарактеризовать молекулярную структуру жидкой воды сделал в 1892 г. В. К. Рентген, который предложил рассматривать ее как остатки структуры льда в некоторой иной среде. После того как В. Г. Барнес конкретизировал структуру льда, идея В. К. Рентгена была подхвачена целым рядом авторов, предлагавших различные многокомпонентные модели воды.
Впервые структуру жидкой воды как льдоподобный каркас с изогнутыми водородными связями постулировали в 1933 г. Дж. Д. Бернал и Р. Г. Фаулер, исходившие из рассмотрения чисто кулоновского взаимодействия жестких зарядов. Однако предложенная ими конкретная модель воды как смеси льдов типа кварца и тридимита оказалась неприемлемой. В вопросе о структуре воды работали многие исследователи, и по настоящее время в литературе находится немало сведений и уточнений по этому вопросу.
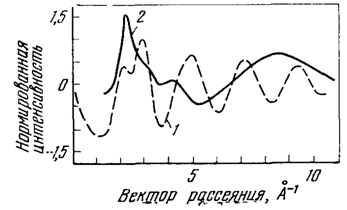
Рис. 13. Нормированная интенсивность рассеяния водой при 20 °С:
1 - рентгеновского излучения, 2 - нейтронов
Измерения дифракции нейтронов в воде (рис. 13) показали, что вследствие тепловых колебаний атомов водорода размытие рефлексов стирает практически все преимущества нейтронографических исследований перед рентгенографическими. Метод инфракрасной спектроскопии позволяет установить ряд ее свойств, определить характеристики структуры ее водородной связи, определить частоты колебаний определенных группировок, вычислить интенсивность их полос, кинетические свойства и ряд других особенностей.
Итак, по [2] в жидкой воде есть ослабленные водородные связи. Колебания «свободных» ОН-групп, молекул воды, образующих «ослабленные» водородные связи в спектре поглощения и комбинационного рассеяния проявляются в виде полос, соответственно около 3617 и 3625 см-1. Среднее время жизни такой «свободной» ОН-группы ~ 10-14 сек, а всего комплекса ~ 1,5-10-12 сек. Таким образом, воду при нормальных условиях следует представлять как решетку с напряженными водородными связями и частично заполненными пустотами, которая непрерывно деформируется. Отдельные элементы деформированного льдоподобного каркаса постоянно рвутся, давая тем самым новые «ослабленные» молекулы, которые попадают в полости псевдорешетки. Одновременно в процессе той же деформации каркаса «ослабленные» молекулы возвращаются в «каркас» и т. д.
Число наблюдаемых полос поглощения до сих пор остается основным критерием числа различных ОН-группировок, присутствующих в исследуемом соединении. Поэтому, по-прежнему, определение полного числа полос поглощения играет первостепенную роль при любом спектрохимическом исследовании.
В случае если заранее известно, что все атомы водорода исследуемого вещества входят только в состав ОН-группировок, все интенсивные полосы, лежащие в интервале частот 3700-1300 см-1, (если это не органический кристалл и в нем нет двойных и тройных связей) или, по крайней мере, в интервале 3700-2500 см-1 (тогда без ограничений на объект исследования), без каких бы то ни было дополнительных проверок с полным основанием могут быть отнесены к колебаниям ОН-связей.