
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
УКАЗАНИЯ К РЕШЕНИЮ НЕКОТОРЫХ ЗАДАЧ
1.12. В таблице Н.А. Морозова есть химически малоактивные предельные углеводороды, а в системе Д.И. Менделеева в то время не было аналогичных им инертных газов. Н.А. Морозов предсказал: в природе должны существовать инертные элементы, что это газы и искать их следует в воздухе.
В 1893 году, продолжая находиться в заключении, Н.А. Морозов узнает из газет, что английский ученый У. Рамзай открыл в воздухе инертный газ аргон. Вскоре последовало открытие и других инертных газов. Последний из них - радон, был открыт в 1901 году.
1.14. В качестве примера рассчитаем среднюю атомную массу никеля с учетом содержания в нем природных изотопов:
67,88 х 0,5793 = 39,3229
26,23 х 0,5993 = 15,7196
1,18 х 0,6093 = 0.7251
3,66 х 0,6193 = 2.2666
1,08 х 0,6393 = 0,6904
Сумма; 58,7246≈58,72 а. е. м.
Атомная масса кобальта, состоящего только из одного природного изотопа, равна 58,93 а. е. м. Сопоставление показывает, что средняя атомная масса кобальта больше, чем у никеля, что обусловлено своеобразным изотопным составом последнего. Аналогичный расчет средней атомной массы теллура показывает, что она больше, чем атомная масса единственного природного изотопа иода.
1.15. Обратите внимание на то, что при переходе Mn → Mn2+ атом теряет четвертый электронный слой (4s2). Превращение Mn2+→ Mn4+ связано с потерей электорнов с одного и того же подуровня 3d при его сохранении.
1.17. При ответе на вопросы в) и г) учтите, что на орбитальный радиус атомов существенное влияние оказывает эффект экранирования внешних электронов. При переходе от Mg к Al характер экранирования принципиально меняется. Почему?
1.18.
б) Это связано с явлением "провала" электрона. У Cr в результате этого явления формируется энергетически стабильный полузаполненный подуровень 3d5, обладающий повышенной экранизирующей способностью по отношению к электрону подуровня 4s.
Аналогичное явление имеет место и в случае Cu электронная валентная конфигурация которого 3d10 4s1.
в) Последний d-элемент периода имеет завершенный (n-1)d10 подуровень (здесь n - номер периода). При переходе к первому - элементу появляющийся у него электрон на nр-подуровне особенно сильно экранируется атомным остовом.
г) Уникальность Pd заключается в том, что у его атома имеет место двойной "провал электрона", т. е. этот атом лишен внешнего электронного слоя.
д) попытайтесь оъяснить эту аномалию, сопоставить особенности электронной конфигурации атомов Br и I.
1.47. Хлориды бора и кремния гидролизуются необратимо и полностью до соответствующей кислоты (борной или кремниевой) и хлороводорода. Хлорид алюминия подвергается гидролизу обратимо, давая в качестве продуктов гидролиза смесь основных солей. Напишите уравнения соответствующих реакций.
2.1. От Be2 (несуществующая молекула) до N2 связь между атомами становится все более прочной в результате увеличения числа электронов на связывающих молекулярных орбиталях. Параллельно с упрочением связи происходит уменьшение её длины.
Начиная с O2 появляются электроны на разрыхляющих молекулярных орбиталях, что приводит к уменьшению порядка (крайности) связи.
2.3. Пример расчета для гидрида и фторида бериллия:
ВеН2: степень ионности = 16 (2,2-1,5) + (2,2-1,5)2 ≈ 13 %
ВеF2: степень ионности = 16(4,0-1,5) + 3,5(4,0-1,5)2 ≈ 62 %.
2.16. Вероятно, решающее значение в уменьшении устойчивости кристаллогидратов имеет дисперсионная составляющая, уменьшающаяся по своей величине при переходе к атомам малого радиуса и потому более «жестким», т.е. в меньшей степени подверженным смещениям электронных оболочек относительно ядра.
2.17.
а) Катион лития Li+ по сравнению с другими катионами этой же группы, обладает уникальными свойствами. Будучи очень малым по размерам, он создает вокруг себя сильное поле и потому особенно склонен к ион-дипольному взаимодействию. По этой причине он энергично взаимодействует с полярными молекулами воды и атомами. В целом, с ростом порядкового номера элементов той группы радиусы катионов возрастают и образование как аквакомплексов, так и аммиакатов становится все менее характерным.
б) Существование комплексных аммиакатов в водных растворах для лития объясняется тем, что ион Li среди щелочных металлов обладает наиболее сильным ионным полем и наибольшим поляризующим действием, что существенно увеличивает силу электростатического притяжения к нему полярных молекул аммиака. Убедитесь в этом, вычислив ионные потенциалы е/r2 для ионов щелочных металлов и разность ионных потенциалов при переходе от одного катиона к другому в подгруппе.
2.18. Очевидно, для щелочноземельных элементов по сравнению с щелочными металлами в целом можно ожидать повышения способности к комплексообразованию. Это зависит как от увеличения силы ионного поля, приближенно определяемого в данном случае выражением 2е/r2, так и от того, у какого из этих элементов ковалентная составляющая может уже играть заметную роль.
2.19. В водных растворах катионы бериллия существуют в виде аквакомплекса [Be(H2О)n]2+, обладающего кислотными свойствами и способного к ступенчатому протолизу:
[Be(H2O)n]2+ + H2O [Ве(Н2О)n-1OН]+ + Н3О+,
[Ве(Н2O)n-1]2+ + Н2O [Ве(Н2О)n-2 (OН)2] + Н3О+
В щелочной (аммиачной) среде эти равновесия смещаются в прямом направлении с образованием комплексных гидроксоанионов:
[Ве(Н2O)n-2(ОН)2] + ОН- [Ве(Н2O)n-2(ОН)3]-,
[Be(H2O)n-2(OH)3]- + OH- [Be(H2O)n-3(OH)4]2-.
2.20. Ионный потенциал катиона бора В3+ так велик и настолько отличается от ионных потенциалов его групповых аналогов, что в водных растворах не образует аквакомплексов, так как силой своего поля вызывает деструкцию молекул воды, давая с ними гидроксо- или даже оксокомплексы.
2.21. Ионы щелочных металлов, галогенов и инертные газы имеют одинаковую по своей структуре завершенную восьмиэлектронную оболочку, что и является причиной их низкой способности образовывать комплексные соединения.
3.6. Это главным образом связано с тем, что катионы лития, имея малый радиус по сравнению с другими катионами щелочных металлов, в наибольшей степени подвержены гидратации. Сильно экзотермический эффект гидратации катиона лития способствует переходу его из металла в раствор. Чтобы лучше разобраться в этом вопросе, составьте термодинамический цикл для процесса
Ме(т) → Ме+(P) + е.
3.14. Процесс диссоциации можно представить в виде последовательности этапов:
HX(г)+ H(г) + X(г); Eдисс
H(г) = H+(г) + e; I
F(г) +e = F-(г); Ecp
H+(г) + aq = H+.aq; ΔH1
F- (г)+ aq = F+.aq; ΔH2
![]()
HX(г) + aq = H+× aq + F-× aq ΔH0p
Отсюда:
ΔH0p = Eдиcc + I + Ecp + ΔH01 + ΔH20 = Eдиcc + Eср + ΔH20 + (I + ΔH01) =
= Едисс + Еср +ΔH20 + 196 кДж/моль.
б), в) Результаты расчетов представлены в таблице:
|
Параметры |
HF |
HCl |
HBr |
HI |
|
ΔH0p , кДж |
- 38 |
- 76 |
- 96 |
- 113 |
|
Т∆Sº, Дж |
- 50 |
- 34 |
- 46 |
- 59 |
|
∆Gºp, кДж |
+ 12 |
- 42 |
- 50 |
- 54 |
|
pKa (вычисл.) |
2 |
- 7 |
- 9 |
- 9,5 |
Сравнение вычисленных значений рКa (вычисл.) с экспериментальными (см. табл. 19) показывает их хорошее совпадение. Это свидетельствует о том, что все составляющие процесса учтены правильно и что подобный метод расчета может служить теоретическим обоснованием изменения силы бескислородных кислот элементов одного и того же периода.
г) Расчет и найденные значения ΔН°р показывают, что основное влияние на величину ΔG0p и, следовательно, на силу кислот оказывает энергия диссоциации Едис молекул НХ, абсолютное значение которой велико и изменяется в ряду кислот также значительно. Существенный, но меньший, вклад вносит и энергия гидратации ионов Х-. Что же касается величин Ecp и энтропийного фактора ТΔS0, то они в ряду рассматриваемых кислот изменяются незначительно, а потому их вклад не имеет решающего значения.
Следует ожидать, что и в других группах Периодической системы, где возможно образование бинарных бескислородных кислот, их сила должна возрастать с ростом атомного номера кислотообразующего элемента. Так, показатели констант кислотности для кислот Н2Х, образуемых р-элементами VI группы, имеют следующие значения:
Н2Х Н2О H2S Н2Sе Н2Те
рКa (эксп.) 14 7,0 3,6 2,6
(здесь представлены показатели констант кислотности, соответствующих первой ступени диссоциации:
H2X + aq = HX- · aq + H+ · aq).
3.15. Изменение упомянутых характеристик в ряду от азота до фтора представлено в таблице:
|
Характеристика |
NH3 |
H2O |
HF |
|
Атомный радиус, rат, нм 0,052 0,045 0,040 Ионный радиус, eион, нм 0,015 0,014 0,013 Электроотрицательность 3,07 3,50 4,00 Дипольный момент, m,D 1,46 1,84 1,91 |
|||
Как следует из данных таблицы, изменение атомных и ионных радиусов трудно увязать с увеличением силы кислот. Напротив, наблюдается хорошая и вполне объяснимая корреляция с изменением величины электроотрицательности и дипольного момента: вдоль периода электроотрицательпость существенно возрастает, следствием чего является и увеличение дипольного момента молекул. Это приводит к последовательному ослаблению связи между водородом и кислотообразующим элементом, т. е. к увеличению силы кислот.
3.16, 3.19. Одно, из объяснений базируется на положениях теории поляризации ионов, которая подробно освещена в учебнике Б. В. Некрасова (см. список рекомендуемой литературы).
3.21. Данное явление связано с усилением восстановительной активности галогенид-ионов от F- к I- (сравните стандартные потенциалы Г2 (2Г-). При действии концентрированной серной кислоты на NaF и NaCl образуется соответственно HF и HCl. В случае NaBr первоначально образующихся HBr за счет аниона Br восстанавливает H2SO4, в основном, до SO2, а сам бромид-анион окисляется до свободного брома. Аналогичное явление имеет место и для NaI, но в этом случае происходит восстановление серной кислоты до H2S (ион I- - наиболее сильный восстановитель в ряду галогенид-ионов).
3.24. Расчет (проделайте его) дает следующие значения образования твердых галидов серебра и кальция из ионов в водном растворе, кДж/моль:
F-(p) Cl-(р) Br-(p) I-(p)
Ag+(p) + 16 - 55 - 63 - 91
Ca2+(p) -56 + 68 + 97 + 128
Полученные результаты находятся в полном соответствии с тем экспериментальным фактом, что в ряду AgCl - AgBr - Agl растворимость галидов резко уменьшается. Фторид серебра растворим, о чем свидетельствует положительное значение ΔG0298 для галидов кальция наблюдается обратное явление: нерастворим в воде только фторид (ΔG298<0), а в ряду CaСl2 - CaBr2 - CaI2 растворимость солей увеличивается (увеличение положительных значений ΔG0298).
3.41. б) Стандартный электродный потенциал Е связан с изменением энергии Гиббса уравнением
ΔG0 = - nFE0
Учитывая, что указанная реакция обратна по отношению к реакции образования гидратированных ионов знак DGоf(Me2+ · aq) следует изменить на обратный, например, для реакции
Mn2+ · aq + 2e = Mn (к).
имеем:
Е Mn2+/Mn = - ΔGоnF = - 228,0×103/2 × 9,6 ×10 4 = - 1,19 B.
Результаты расчетов сведём в таблицу:
|
Элемент |
Е0, В |
|
|
Вычислено |
Справочные данные |
|
|
Mn Fe Co Ni Cu Zn |
- 1,19 - 0,47 - 0.28 - 0,28 + 0,34 - 0,80 |
- 1,18 - 0,44 - 0,28 - 0,25 + 0,34 - 0,76 |
Сопоставление показывает хорошее соответствие вычисленных значений справочным данным.
3.42. а) С увеличением числа d-электронов экранирование возрастающего заряда ядра становится эффективным и ионный радиус уменьшается. Электростатическое притяжение между ионом и диполями воды поэтому возрастает и приводит к увеличению теплоты гидратации.
Наличие максимумов на кривой объясняется тем, что все ионы, за исключением Са2+, Мn2+ и Zn2+, дополнительно стабилизируются полем лигандов, но в разной степени, причем для V2+ и Ni2+ имеет место наибольший выигрыш энергии.
б), в). Применяя указанное соотношение и учитывая электронную конфигурацию октаэдрических аквакомплексов, имеем:
|
Ион |
Электронная |
Эффект поля лигандов |
ΔНкорр=Н- ΔНпопр, кДж/моль |
||
|
конфигурация |
В единицах Δ |
см -1 |
ΔНпопр, кДж/моль |
||
|
Ca2+ |
d0 |
0 |
0 |
0 |
2466 |
|
V2+ |
d3, t32g |
1,2 |
15120 |
180 |
2595 |
|
Cr2+ |
d4, t32gе1g |
0,6 |
8340 |
99 |
2693 |
|
Mn2+ |
d5, t32gе2g |
0 |
0 |
0 |
2734 |
|
Fe2+ |
d6, t42gе2g |
0,4 |
4160 |
50 |
2792 |
|
Co2+ |
d7, t52gе2g |
0,8 |
7440 |
89 |
2824 |
|
Ni2+ |
d8, t62gе2g |
1,2 |
10200 |
121 |
2872 |
|
Cu2+ |
d9, t62gе3g |
0,6 |
7560 |
90 |
2907 |
|
Zn |
d10, t62gе4g |
0 |
0 |
0 |
2930 |
График зависимости теплот гидратации при отсутствии эффекта поля лигандов (ΔНкорр) от числа d-электронов представляет собой практически прямую линию.
Сопоставление кривых ΔHкорр = f(n) и rорб = f(n) показывает, что они практически представляют собой зеркальное отображение друг друга, что свидетельствует о решающем влиянии ионных радиусов на величину энергии гидратации.
3.46. Ионами, где проявляется эффект ЯТ, могут быть те, которые обладают в кубическом поле орбитально вырожденным состоянием. Покажем это на примере иона с конфигурацией d4 (например, Мn3+). В промежуточном октаэдрическом поле ион с этой конфигурацией обладает наполовину заполненным t2g подуровнем (t32g) и одним электроном на подуровне еg, состояние которого можно описать одной из двух волновых функции: dx2-y2 и dz2. Если бы рассматриваемый ион вместо четырех электронов имел пять (t32g, e2g) то две орбитали dx2-y2 и dz2. были бы заполнены и вся электронная оболочка была бы сферически симметричной. Удаление электрона с одной из этих орбиталей нарушает симметрию.
Если, например, состояние dx2-y2 не заполнено, то распределение электронной плотности в заполненном dz2-состоянии таково, что ядро катиона сильнее экранируется от обоих анионов (лигандов), расположенных на оси Z, чем от анионов, лежащих в плоскости XY. Вследствие этого на анионы, лежащие в плоскости XY, действуют более значительные силы притяжения, чем на два остальных аниона, расположенных на оси Z. Это приводит к искажению решетки, возникновению вытянутого, тетрагонально деформированного октаэдра. Наоборот, если заполнено состояние dx2-y2, то возникает противоположное искажение, октаэдр сокращается по оси Z. Оба искажения изображены на рис. 8.
С такой же ситуацией, как у ионов с конфигурацией d1 мы сталкиваемся и в случае ионов с конфигурацией d9, а также в случае d7-ионов (низкоспиновое состояние, сильное поле лигандов). Приведите примеры ионов с такими электронными конфигурациями и подробно опишите проявление для них эффекта ЯТ со всеми вытекающими из него последствиями.
Во всех указанных случаях эффект ЯТ вызывался электронами, занимающими eg-подуровень. Однако в принципе он должен возникать и при частичном заполнении t2g-подуровня, но в этом случае ориентация орбиталей t2g-электронов относительно лигандов такова, что искажения, вызываемые эффектом ЯТ, незначительны. Попытайтесь в этом убедиться на примерах соответствующих ионов.
Если катион находится в тетраэдрической ориентации, то орбитали t2g и eg меняются ролями: тогда большие искажения могут быть вызваны лишь t2g-электронами, орбитали которых близки к отрицательно заряженным лигандам. Поэтому в тетраэдрическом поле можно ожидать появления явно выраженных
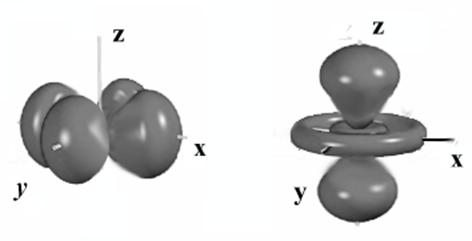
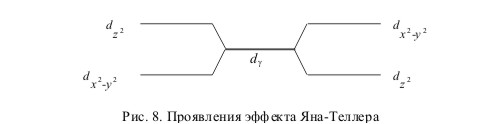
искажений при наличии ионов с электронными конфигурациями d3, d4, d8 и d9. Опишите эти случай на конкретных примерах, приведите рисунки, аналогичные рис. 8, поясняющие проявление эффекта ЯТ в каждом конкретном случае.
3.48. Исходя из приведенного термодинамического цикла, имеем:
ΔGо = -ΔGоh(Ln2+, г) + ΔGоион+ ΔGоh + ΔGоh (Ln3+, г )
Вычислим величину DG° для церия с использованием табл. 33:
ΔGоCe =1397 + 1949 - 458 -3192 = -304 кДж/моль.
Рассчитаем для этого же элемента стандартный окислительно-восстановительный потенциал Е°Ce3+/Ce2+:
E°Ce3+/Ce2+ = ΔGO/F = -304/(96487×10-з) = -3,l В.
Аналогично найдем Ео для других лантаноидов. Результаты расчетов сведем в табл. 38.
Несмотря на некоторую завышенность расчетных значений по сравнению с экспериментальными, они в целом удовлетворительно коррелируют с последними.
Таблица 38
|
Элемент |
Е0Ln3+/Ln2+ |
|
|
Экспериментальное значение |
Рассчитанное значение |
|
|
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb |
-2, 92 ± 0, 08 -2, 84 ± 0, 06 -2,62 ± 0, 05 -2, 44 ± 0,05 -1, 50 ± 0, 01 -0,34 ± 0,01 -2,85 ± 0,07 -2,83 ± 0,07 -2,56 ± 0,05 -2,79 ± 0,06 -2,87 ± 0,08 -2,22 ± 0,05 -1,18 ± 0,01 |
-3,1 -3,1 -2,8 -2,7 -1,7 -0,6 -3,1 -3,0 -2,8 -3,0 -3,1 -2,4 -1,4 |
3.49. Термодинамический цикл имеет следующий вид:
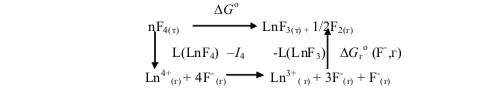
Учитывая, что энтропийный член ТΔS° и ΔG°f(F-, г) постоянны, имеем:
ΔG° = L(LnF4)- I4- L(LnFз)+соnst
где L(LnF4) и L(LnF3)- энергии кристаллической решетки LnF4 и LnF3 соответственно; I4 - четвертый потенциал ионизации лантаноидов.
б), в). Учитывая, что энергии кристаллических решеток в зависимости от атомного номера изменяются плавно, и к тому же в выражение для DG° входит их разность, можно предположить, что величина ΔG° будет в основном зависеть от I4. Для наглядности постройте график зависимости I4 от атомного номера лантаноида, из которой видно, что величина I4 наибольшая для Се, Рr, Tb. Из этих трех металлов ионы Се4+ и Тb4+ имеют наиболее энергетически выгодную электронную конфигурацию (какую?), что согласуется c экспериментальными данными.
