
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
Глава 3. МЕТОДЫ КУЛЬТИВИРОВАНИЯ МИКРОБОВ
Для изготовления каждого специфического препарата, применяющегося как для профилактики и лечения, так и для диагностики инфекционных заболеваний, требуется иметь в том или другом количестве микробов их антигены или токсины. Последние получают на производстве бактерийных и вирусных препаратов путем культивирования микробов. С этой целью бактерий размножают на искусственных, естественных, полусинтетических или синтетических питательных средах. Риккетсии и вирусы культивируют в организме чувствительных животных (иногда членистоногих), различных частях куриного эмбриона или культурах тканей первичных или перевиваемых клеток.
Культивирование бактерий
Как было указано выше, бактерий размножают на искусственных жидких и плотных (агаровые) питательных средах. Применяются различные среды в зависимости от особенностей бактерий и цели, которую преследуют при размножении их.
Применяемые в производстве питательные среды делятся на белковые, промежуточные между белковыми и синтетическими и синтетические.
К первой группе прежде всего относятся среды с нативными белками (агар Бейли с асцитом для культивирования гонококка, среда Бордэ-Жангу с кровью для коклюшной палочки). Сюда же относятся среды с высоким содержанием «белкового азота» (бульон Рамана для изготовления столбнячного анатоксина, дрожжевой агар для культивирования бактерий кишечного семейства и др.) и среды с незначительным содержанием «белкового азота» (среда для получения стафилококкового токсина из кислотного гидролизата, автолизата отрубей и дрожжевого экстракта).
К промежуточным средам относятся, с одной стороны, среды с основой в виде ферментативного или кислотного гидролизата казеина с цистином или триптофаном (среды, применяемые при производстве противотуляремийной вакцины) или с основой из аминокислот и незначительных количеств казеиновых гидролизатов (полусинтетические среды для производства кишечных вакцин).
Синтетические среды широко применяются для культивирования туберкулезной палочки, при производстве туберкулина и штамма ВСО для изготовления противотуберкулезной вакцины. Примером может быть гликоколевая среда ВКЛ, содержащая КСl, М2SO4, лимоннокислый натрий, глицерин, глюкозу и гликокол. Предложены подобные среды и для культивирования других бактерий (синтетическая среда для выращивания тифопаратифозных и дизентерийных бактерий, для изготовления химической вакцины против кишечных инфекций, содержит двузамещенный лимоннокислый аммоний, глюкозу, никотиновую кислоту триптофан, цистин и глютаминовую кислоту).
Преимуществом синтетических сред является то, что они имеют известный состав. Искусственные питательные среды подвергаются химическому контролю на содержание общего и аминного азота, пептонов, свободного триптофана, солей железа, хлоридов, определяется также рН. Все среды подвергаются стерилизации при различном режиме в зависимости от их состава.
Для получения токсинов экзотоксические бактерии (дифтерийные, столбнячные, ботулиновые, раневых инфекций и др.) засеваются на жидкие питательные среды, разлитые в бутыли различной емкости. Выращивание производится при 35-37 °С в течение 7-10 дней.
Получение бактерийной массы в больших количествах для изготовления вакцин производится глубинным методом, который заключается в том, что бактерии культивируются в жидкой питательной среде в специальных аппаратах - реакторах при постоянном продувании через среду стерильного воздуха.
В условиях аэрации процесс размножения микробов резко ускоряется. Если при стационарных условиях размножения на плотной питательной среде максимальный выход бактерий достигается через 24-48 часов культивирования, то при глубинном методе данный срок сокращается до 12-14 часов. При этом имеет место резкое увеличение выхода микробной массы.
При культивировании на синтетических средах в условиях аэрации количество бактерий за 14 часов, достигает 25 млрд., а на мясных средах - 50-60 млрд. в 1 мл, в то время как выращивание в стационарных условиях на тех же средах приводит к накоплению 1-2 млрд. бактерий в 1 мл.
Быстрое размножение и накопление больших масс микробов зависит от того, что в условиях аэрации отсутствует начальная стационарная фаза роста, происходит интенсивное размножение в фазе положительного ускорения роста, в логарифмической фазе, при продолжительной фазе отрицательного ускорения размножения.
В последнее время метод глубинного культивирования усовершенствован дополнением к реактору пульта управления, с которого и производится регулирование процессов в реакторе. Установка обеспечивает возможность проводить глубинное выращивание бактерий в стандартных условиях с регистрацией и автоматическим регулированием температуры и рН, учетом окислительно-восстановительного потенциала и регламентированием степени аэрации. При помощи специально смонтированного мембранного насоса обеспечивается подача воздуха, свободного от каких-либо примесей. Использование этой установки позволяет получать переход популяции в логарифмическую фазу роста и накопление больших количеств бактериальной массы в течение 6-7 часов.
Глубинный метод культивирования микробов в жидкой среде применяется не только для получения больших масс микробных тел, но и токсинов.
Культивирование риккетсий
Долгое время единственным методом культивирования патогенных риккетсий было размножение их в организме экспериментальных животных. В 1906-1909 гг. были изучены на обезьянах лихорадочные формы экспериментальных заболеваний - риккетсиозов группы Цуцугамуши, а в 1909-1911 гг. - на обезьянах и морских свинках группы сыпного тифа. В дальнейшем были изучены и другие формы (лихорадочно-скротальная, бессимптомная, легочная, перитонеальная, септическая, тестикулярная глазная, кожная) экспериментальных риккетсиозов.
Для производственных целей используется размножение риккетсий в легких белых мышей, которые являются наиболее чувствительными животными для воспроизведения легочной риккетсиозной инфекции. Эта форма экспериментальной инфекции в виде риккетсиозной пневмонии регулярно развивается у белых мышей при внутриносовом заражении вирулентной взвесью риккетсий. Наиболее чувствительны к заражению молодые мыши весом 10-15 г. Инфицирование их производится под эфирным наркозом с инсталляцией в ноздри 10 капель риккетсиальной взвеси. При такой дозировке микроба заражается 93-95 % животных, причем, в подавляющем большинстве случаев, заразившиеся мыши погибают на 4-5 день. Для течения риккетсиозной пневмонии у белых мышей характерной является гипотермия. Температура снижается на 3-4 день после заражения до 28-33 °С и в дальнейшем перед смертью животных падает до 18-20 °С. Состояние гипотермии, очевидно, является особо благоприятным для размножения риккетсий. При вскрытии мышей, убитых на высоте инфекции или в случае их гибели, обнаруживается очаговая или разлитая (долевая) пневмония с красной гепатизацией, захватывающей от 50-75 до 100 % всей легочной ткани.
При микроскопическом исследовании окрашенных мазков из пораженного легкого обнаруживается огромное количество мелких палочковидных или кокковидных форм риккетсий, свободных и частью расположенных в клетках, особенно в септальных. В среднем из легкого инфицированной мыши получают до 20-25 млрд. риккетсий.
В больших количествах риккетсий Провачека можно получить при воспроизведении легочного риккетсиоза у кроликов, разработанного П.Ф. Здродовским. У этого вида животных экспериментальная инфекция воспроизводится при внутритрахеальном заражении их значительной дозой вирулентных риккетсий в комбинации с одновременным снижением у них температуры до 36-37 °С и ниже на протяжении всего периода развития риккетсиозного процесса в легких. Кролики заражаются суспензией из одного риккетсиозного легкого мыши. Снижение у них температуры тела достигается с помощью люминалового наркоза, поддерживаемого в течение 72 часов, - срок, на протяжении которого у кроликов заканчивается созревание пневмонии и накопление риккетсий в легких.
Вскрытие кроликов через этот срок обнаруживает у них бронхопневмонию очагового или сливного характера при наличии серой или красной гепатизации различной выраженности и протяженности, с преимущественной локализацией в дорзальной части легких.
При микроскопическом исследовании легких в окрашенных препаратах обнаруживается значительное или очень большое количество обычно палочковидных риккетсий, свободных и частью расположенных внутриклеточно. Несмотря на то, что вес пораженных легких у кроликов достигает 20 г, этот метод накопления риккетсий не смог конкурировать с получением риккетсий в больших количествах в легких белых мышей, которые, 1 по исследованиям М.М. Маевского, превращаются как бы в живую пробирку с обильной культурой риккетсий.
В прошлом для изготовления противосыпнотифозной вакцины Вейль использовал кишечники вшей, инфицированных риккетсиями Провачека путем микроклизмы, - зараженных путем кормления нимф вшей через эпидермомембрану. Такой метод размножения риккетсий для получения их в больших количествах рекомендуется в настоящее время некоторыми лабораториями только для изготовления концентрированного антигена для серодиагностики сыпного тифа.
Метод этот основан на том, что платяная вошь легко инфицируется риккетсиями Провачека как в молодых формах (личинки-нимфы), так и во взрослом состоянии. Разведение здоровых вшей производится, в специальных отделениях лабораторий, занятых производством указанного выше антигена.
В качестве доноров для кормления вшей принимаются в первую очередь лица, страдающие гипертонией, так как эта процедура, понижая кровяное давление, в значительной степени устраняет болезненные явления, связанные с гипертонией. Доноры находятся под постоянным врачебным наблюдением. Вши от стадии личинки до полного развития и момента заражения закреплены за каждым донором.
Кормление вшей может также производиться через эпидермомембраны. В особую кормилку наливается нитратная или дефибринированная кровь здорового человека - донора. Кольцеобразная крышка этой кормилки имеет натянутую эпидермомембрану с трупа человека, соприкасающуюся с поверхностью крови. Подлежащие кормлению голодные вши помещаются на указанную мембрану, через которую они охотно питаются кровью.
Насекомые содержатся в деревянных закрытых кормушках, покрытых, с одной стороны, мелкоячейной мельничной сеткой, через отверстия которой вши сосут кровь донора. В кормушке помещается 500 вшей. Кормушки со вшами сохраняются в картонных коробках, на дне которых приклеены две узкие полоски картона, чтобы кормушки не касались дна коробки своей сеткой, что облегчает проветривание кормушек. Кал вшей в форме мелких круглых черных зернышек выпадает сквозь отверстия сетки на дно коробки. Вши сохраняются в термостатах при температуре 33-35 °С, кормление происходит раз в сутки в течение 45 минут.
Для изготовления указанного выше антигена производится введение, под бинокулярной лупой, взвеси риккетсий в кишечник вшей, укрепленных под пластинками соответствующего приспособления. Кроме такого метода можно использовать кормление насекомых инфицированной кровью по А.В. Пшеничнову. Через 4-8 дней после заражения через кишечник и 8-9 дней через эпидермомембрану наступает максимальное развитие риккетсий во вшах и гибель их. К этому сроку у насекомых, зараженных по А. В. Пшеничнову, накапливается до 30-60 млн. риккетсий.
В 1938 г. Кокс предложил производить размножение риккетсий в куриных эмбрионах путем заражения их в полость желточного мешка. Для этой цели используют 6-7-дневные эмбрионы. Вся работа по заражению куриных яиц и их вскрытию производится в боксах с тщательным соблюдением стерильности в работе. После дезинфекции 50 % спиртом и смазывания 5 % йодной настойкой скорлупы тупого конца яйца пробуравливают отверстие над вершиной воздушной камеры. Заражение яиц производится с помощью стерильного шприца с иглой среднего размера или пастеровской пипеткой. Жидкость, содержащая риккетсии, вводится в дозе 0,4-0,5 мл. Отверстие в скорлупе закрывается расплавленным стерильным парафином.
Зараженные яйца инкубируются в термостате при 35-37 °С. Максимальное накопление риккетсии происходит от 6 до 8-10 дня.
Риккетсии размножаются в ткани стенки желточного мешка. В мазках из последнего риккетсии обнаруживаются в свободном виде. П.Ф. Здродовский считает, что, как и при других формах риккетсиоза, при заселении стенки желточного мешка риккетсии ведут себя как внутриклеточные паразиты, но при повреждении нежной ткани желточной оболочки легко высвобождаются из клеток и представляются свободными формами.
Вскрытие зараженных яиц осуществляется следующим образом: вначале смазывается 5 % йодной настойкой тупой конец яйца, и пинцетом на уровне нижней границы воздушном камеры циркулярно надламывается скорлупа. После вскрытия скорлупы и оболочки воздушной камеры стерильно извлекается пинцетом желточный мешок и помещается в стерильную посуду для последующего превращения в суспензию в физиологическом растворе.
В настоящее время для накопления риккетсии широко используется метод культуры тканей. Успешно осуществляется культивирование риккетсии в присутствии тканей или оболочек, покрытых мезотелием или эндотелием. В лаборатории П.Ф. Здродовского все виды риккетсии размножают, используя пульпу куриных эмбрионов. Доказано, что риккетсии хорошо размножаются при пониженном метаболизме клеток. В связи с этим размножение риккетсии в культуре ткани начинается только тогда, когда снижается ее метаболизм; максимальное накопление микроорганизмов происходит к 7-12 дню. Солевой состав в среде выращивания риккетсии обеспечивается жидкостью Тироде. Оптимальной реакцией среды является
рН 7,4-7,8. Обильное размножение риккетсии происходит в аэробных условиях при 35-37 °С. Риккетсии культивируют в жидкой среде и на агаре. Жидкая среда представляет смесь жидкости Тироде обычного состава с сывороткой, в которой взвешены частички ткани, зараженные риккетсиями. Сыворотка морской свинки или кролика добавляется из расчета 1 часть ее к 3-5 частям жидкости Тироде. Для культивирования на агаре изготавливают Тироде - сывороточный агар, на 1/3 поверхности которого наносят тканевую пульпу. Этот агар может использоваться повторно (3-4 раза) при удалении засеянной эмбриональной пульпы с ростом риккетсии и замене ее свежей тканью куриных эмбрионов.
Из представленного материала видно, что разработаны различные методы культивирования риккетсии для производственных целей, но из них обычно чаще применяется размножение в легких белых мышей и в желточных мешках куриных эмбрионов.
Культивирование вирусов
Вирусы размножаются только в живых клетках и эта способность обусловлена, по-видимому, тем, что они используют ферментные системы клетки для своего обмена.
Для культивирования вирусов предложены различные методы, но для получения их в больших количествах, для целей изготовления противовирусных специфических препаратов применяется размножение в организме восприимчивых животных, в курином эмбрионе и тканевых культурах.
Метод размножения вирусов в организме восприимчивых животных
Для изготовления оспенного детрита вирус вакцины размножается в коже телят. Прививочное поле 3-4 раза моют теплой водой с мылом, смачивают 70 ° алкоголем или орошают 1 % раствором лизола или 1,5 % фенола в течение 3-5 минут и потом обильно обмывают стерильной водой и обсушивают стерильным полотенцем. После этого производят некровоточащие надрезы с промежутками в 3-5 мм. В эти надрезы втирается штамм вакцины. В течение 96-120 часов на месте внедрения вируса развиваются специфические образования - оспины, содержащие большое количество элементарных телец. Соскоб с кожи и используется как материал, содержащий вирус вакцины для изготовления детрита.
Для производства антирабической вакцины фиксированный вирус бешенства размножают в головном мозгу кроликов, белых крыс или овец. Для этих целей используют кроликов весом в 1,5 кг, крыс - четырех-восьмидневных сосунков, а овец - в возрасте от 6 месяцев до 1 года. Производят интрацеребральное заражение после прокола черепа шилом (кролика) или трепанации дрелью (овцы) вирусной суспензией мозга в разведении 1:100. Кроликам вводят 0,2 мл, а овцам - 0,3-0,5 мл. Вся операция производится с соблюдением стерильности и дезинфекцией поля до и после заражения. У животных после инкубации в 80-90 часов развивается экспериментальное бешенство, проявляющееся в прогрессивном расстройстве координации, а затем парезов и параличей конечностей. Головной мозг, содержащий большое количество фиксированного вируса бешенства, используется как для изготовления вакцины, так и антигена для иммунизации лошадей с целями производства антирабического гамма-глобулина.
Размножение вируса клещевого энцефалита производят в головном мозгу белых мышей весом в 8-10 г. Животных заражают интрацеребрально 0,03-0,04 мл 10 % мозговой вирусной суспензией. В течение 3-4 дней развивается экспериментальный клещевой энцефалит, проявляющийся в параличах задних и передних конечностей. В этом состоянии животных забивают, промывают несколько раз в 5 % карболовой кислоте и извлекают головной мозг. Обычно вирус обнаруживается в мозгу при разведении суспензии его в 10-7.
Метод размножения вирусов в куриных эмбрионах
Куриные эмбрионы как живая система вошли в вирусологическую практику в 30-х годах XX в. Их использование расширило спектр культивируемых в лабораторных условиях вирусов, позволило более успешно решать стоящие перед вирусологией задачи в связи с тем, что куриные эмбрионы имеют ряд преимуществ перед лабораторными животными.
Так, скорлупа и подскорлупная оболочка надежно защищают эмбрион от бактериального заражения со стороны внешней среды. Важным преимуществом эмбрионов является также их высокая чувствительность к широкому спектру вирусов, что объясняется недостаточным развитием защитных механизмов. Куриные эмбрионы -
легкодоступный объект в связи с развитием широкой сети птицефабрик и инкубаториев. Кроме того, куриные эмбрионы экономичны, не требуют ухода и кормления.
Однако нельзя полностью гарантировать стерильность этой живой системы, так как эмбрионы могут нести в своем содержимом вирусы и другие патогенные агенты (вирусы инфекционного бронхита кур, ньюкаслской болезни, гриппа, лейкоза, хламидии и микоплазмы). Их присутствие может искажать результаты исследования.
Используют куриные эмбрионы в вирусологии в основном для тех же целей, что и лабораторных животных, а именно:
- обнаружения в патматериале активного вируса биопробой;
- первичного выделения вируса;
- поддержания вирусов в лаборатории;
- титрования вирусов;
- накопления вируса для лабораторных исследований и получения вакцин;
- как тест-объект в реакции нейтрализации.
Эффективно выделяют и культивируют на куриных эмбрионах вирусы, вызывающие заболевания у птиц, а также некоторые вирусы млекопитающих.
При отборе куриных эмбрионов для заражения вируссодержащим материалом к ним предъявляют следующие требования:
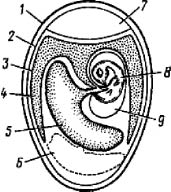
Рис. 1. Схематический разрез куриного эмбриона на 8 день инкубации:
1 - скорлупа; 2 - подскорлупная оболочка; 3 - хорионаллантоисная оболочка; 4 - аллантоисная полость; 5 - желточный мешок; 6 - белок; 7 - воздушная камера; 8 - тело зародыша; 9 - амниотичсская полость- эмбрионы должны быть получены из хозяйств, благополучных по инфекционным болезням;
- скорлупа яиц должна быть непигментированной, чистой (мыть нельзя);
- возраст эмбриона должен соответствовать избранному методу заражения.
Строение куриного эмбриона. Обычно курица откладывает оплодотворенное яйцо, в котором зародыш находится на стадии бластулы или ранней гаструлы. При нагревании яйца до температуры, близкой к температуре тела курицы, происходит дальнейшее развитие зародыша (рис. 1). В период с 5-го по 12-й день инкубации куриные эмбрионы могут быть использованы для заражения вирусами.
Яйцо с развивающимся куриным эмбрионом покрыто снаружи твердой пористой скорлупой, к которой плотно прилегает подскорлупная оболочка.
Последняя в тупом конце яйца разделяется на два листка, между которыми образуется воздушная камера. Тело зародыша лежит в яйце эксцентрично, спиной ближе к скорлупе, голова направлена в сторону воздушной камеры. Зародыш погружен в околоплодную жидкость, заполняющую амниотическую полость, и пуповиной связан с желтком. Желток также располагается эксцентрично и относительно зародыша как бы по другую сторону продольной оси.
Непосредственно под подскорлупной оболочкой находится аллантоисная полость, покрывающая амнион и желточный мешок, а к 10-11-му дню замыкающаяся в остром конце яйца. В процессе развития аллантоисная оболочка срастается с хорионом, образуя единую хорионаллантоисную оболочку (ХАО). В остром конце яйца находится остаток белка.
Размножение вирусов возможно во всех структурах эмбриона, имеющих клеточное строение, к которым относятся зародыш, ХАО и желточный мешок. Накопление вирусов происходит в тех же структурах, но ряд вирусов может накапливаться в аллантоисной и в амниотической жидкостях, образуя практически готовую суспензию вирусов.
Заражение в ту или другую часть эмбриона проводится в период ее максимального развития, когда количество чувствительных клеток будет наибольшим.
В процессе инкубации меняются размеры зародышевых структур, что во многом объясняется их функциональным назначением, и определяет оптимальный для заражения возраст эмбриона. Так, желточный мешок как резервуар питательных веществ имеет наибольший объем в начале инкубации, а затем (после 12-го дня) по мере развития зародыша он уменьшается. Заражают в желточный мешок с 5-го по 7-й день инкубации.
Амниотическая полость, являясь буферной средой развития зародыша, покрывает его уже на 5-й день инкубации. Среднее количество жидкости к середине периода инкубации составляет около 1 мл.
Для заражения в амниотическую полость используют эмбрионы в возрасте 6-10 дней.
Аллантоисная полость служит для сбора продуктов обмена, в ней скапливаются мочекислые соли, фосфорные и азотистые соединения. В процессе роста и развития зародыша аллантоисная жидкость приобретает кислую реакцию. Максимальных размеров аллантоисная полость достигает на 9-12-й день развития эмбриона, поэтому заражение в аллантоисную полость проводят преимущественно на 9-11 день инкубации.
Хорионаллантоисная оболочка богата кровеносными сосудами, которые, тесно прилегая к внутренней поверхности пористой скорлупы, насыщаются кислородом и снабжают им тело зародыша, выполняя функцию органа дыхания эмбриона. Максимального развития ХАО достигает на 11-13-й день. Заражение на хорионаллантоисную оболочку проводят на 10-12-й день инкубации.
Подготовка куриных эмбрионов к заражению. Эмбрионы доставляют из инкубатория, не допуская их охлаждения в пути. В лаборатории эмбрионы инкубируют в термостате при температуре 37 °С и влажности 60-70 %, что достигается установлением в термостате открытых широкогорлых сосудов с водой. Вентиляционные отверстия термостата должны быть открыты. Эмбрионы размещают воздушной камерой вверх в специальных штативах. Рекомендуется до момента заражения дать возможность эмбрионам в течение суток адаптироваться к новым условиям и нормализовать свои функции после транспортного стресса. Если лаборатория располагает собственным инкубаторием, то снесенные курицей оплодотворенные яйца пригодны для закладки в него в течение 10 дней.
Подготовка куриных эмбрионов к заражению включает овоскопирование и дезинфекцию скорлупы, а также соответствующую подготовку рабочего места. Овоскопирование представляет собой просмотр яиц против достаточно яркого источника света (овоскоп), в результате чего на неосвещенной стороне скорлупы образуются тени от внутренних структур. Овоскопирование проводят в затемненном помещении. При этом на скорлупе графитным карандашом отмечают границу воздушной камеры, место расположения зародыша и участок бессосудистой зоны размером 0,5×0,5 см.
Эти отметки служат ориентиром при выборе места введения вируссодержащего материала. При овоскопировании также определяют, жив зародыш или погиб. Зародышей, проявляющих активные движения при хорошей кровенаполненности сосудов ХАО, считают живыми.
Заражение куриных эмбрионов. Яйца инкубируют при температуре 38-39 °С. Куриные эмбрионы заражают в асептических условиях (лучше в боксе). В предбокснике скорлупу эмбрионов обрабатывают йодированным спиртом, затем уже в боксе повторно протирают, а иногда еще и фламбируют - обрабатывают пламенем смоченного спиртом тампона.
Эмбрионы фиксируют в специальных подставках, установленных в эмалированной кювете на 3-4-слойной марлевой салфетке, смоченной дезинфицирующим раствором.
В работе используют инструменты, стерилизованные кипячением. Их ставят в баночку со спиртом и обжигают пламенем горелки перед каждым повторным использованием.
Заражение производится в хориоаллантоисную оболочку, в амниотическую полость, желточный мешок, в вену и мозг. При различных способах заражения пользуются эмбрионами различных сроков (5-12 дней) инкубации.
Заражение в аллантоисную полость. При заражении этим методом хорошо размножаются вирусы гриппа, ньюкаслской болезни, ринопневмонии лошадей, везикулярного стоматита и др. Существует несколько вариантов метода.
Первый вариант. Эмбрион фиксируют вертикально тупым концом вверх. В скорлупе на стороне зародыша, а иногда с противоположной зародышу стороны на 5-6 мм выше границы воздушной камеры делают отверстие диаметром около 1 мм. Иглу вводят параллельно продольной оси на глубину 10-12 мм (рис. 3). После инъекции вируссодержащего материала иглу извлекают, а отверстие в скорлупе закрывают каплей расплавленного стерильного парафина.
Второй вариант. Сделанное в скорлупе над воздушной камерой отверстие используют лишь для выхода части воздуха. Отверстие же для самого заражения делают на участке бессосудистой зоны хорионаллантоисной оболочки (ХАО) со стороны зародыша. Иглу вводят на глубину не более 2-3 мм. Инъецируют инфицирующую жидкость в объеме 0,1-0,2 мл и закрывают отверстие парафином.
Заражение на хорионаллантоисную оболочку. Этот метод заражения куриных эмбрионов чаще используют для культивирования эпителиотропных и пантропных вирусов оспы, инфекционного ларинготрахеита птиц, чумы плотоядных, болезни Ауески, катаральной лихорадки овец и др.
Такое заражение может быть выполнено через естественную или искусственную воздушную камеру.
Для заражения через естественную воздушную камеру эмбрион помещают в штатив вертикально тупым концом вверх и в скорлупе против центра воздушной камеры вырезают круглое окно диаметром 15-20 мм. Через это окно пинцетом снимают подскорлупную оболочку. На обнажившийся участок ХАО наносят 0,2 мм вируссодержащей суспензии (рис. 2), отверстие закрывают лейкопластырем или реже покровным стеклом, укрепив его расплавленным парафином.
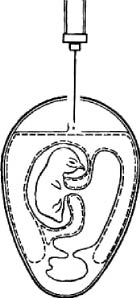
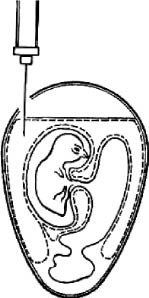
Рис. 2. Заражение куриного эмбриона на ХАО через естественную воздушную камеру
(по Николау)
Рис. 3. Заражение куриного эмбриона в аллантоисную полость (по Николау)
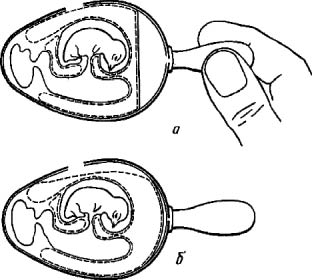
Заражение через искусственную воздушную камеру применяют чаще первого, так как оно обеспечивает контакт вируссодержащего материала с большей поверхностью ХАО и, следовательно, ведет к образованию большего количества вируса. Для заражения эмбриона этим методом его помещают в штатив горизонтально зародышем вверх. В скорлупе делают два отверстия: одно небольшое над центром воздушной камеры (предназначено для отсасывания из нее воздуха), а другое диаметром 0,2-0,5 см сбоку, со стороны зародыша. Сложность метода в том, что, делая второе отверстие, необходимо осторожно снять вначале кусочек скорлупы, затем скользящим движением, не повреждая ХАО, сдвинуть подскорлупную оболочку в сторону так, чтобы через образовавшийся дефект мог пройти воздух. После этого резиновой грушей через первое отверстие отсасывают воздух из естественной воздушной камеры (рис. 4, а). В результате через боковое отверстие наружный воздух устремляется внутрь, образуя искусственную воздушную камеру, дном которой является ХАО (рис. 4, б).
 ,
,
Рис. 4. Заражение куриного эмбриона на ХАО через искусственную воздушную камеру (по Николау и др.)
Через боковое отверстие на поверхность ХАО наносят инфекционную жидкость и отверстие закрывают кусочком лейкопластыря. Закрывать первое отверстие нет необходимости, так как внутренний листок подскорлупной оболочки при этом методе заражения не нарушается и продолжает выполнять роль барьера для микрофлоры окружающей среды.
Дальнейшую инкубацию эмбрионов, зараженных этим методом, проводят в горизонтальном положении боковым отверстием вверх.
Заражение в желточный мешок. Большей частью им пользуются для размножения хламидий, а также вирусов болезни Марека, ринопневмонии лошадей, катаральной лихорадки овец и др. Заражают эмбрионы 5-7-дневного, а иногда и 2-3-дневного возраста (вирус лихорадки долины РИФ). Используют два варианта заражения (рис. 6).
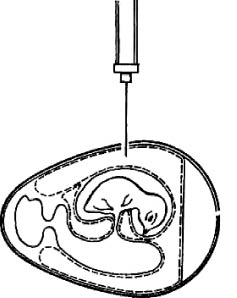
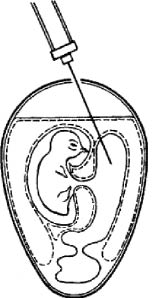
Рис. 5. Заражение куриного эмбриона в амниотическую полость (по Николау и др.)
Рис. 6. Заражение куриного эмбриона в желточный мешок (по Николау и др.)
Первый вариант. Иногда путь заражения осуществляется на горизонтально укрепленном в штативе эмбрионе, при этом зародыш находится внизу, а желток - над ним. Отверстие в скорлупе закрывают каплей расплавленного парафина.
Второй вариант. Эмбрионы помещают в штатив в вертикальном положении. Делают отверстие в скорлупе над центром воздушной камеры и вводят иглу на глубину 3,5-4 см под углом 45° к вертикальной оси в направлении, противоположном месту нахождения зародыша.
Заражение в амниотическую полость. Для этой цели используют эмбрионы 6-10-дневного возраста. Метод используется при культивировании вирусов гриппа, ньюкаслской болезни, ринопневмонии лошадей и др. Есть два способа заражжения (рис. 5).
Закрытый способ. Заражение проводят в затемненном боксе. Яйцо помещают на овоскопе в горизонтальном положении зародышем вверх. Через отверстие в скорлупе над воздушной камерой вводят иглу с затупленным концом по направлению к зародышу. Доказательством того, что игла проникла в амнион, служит движение тела зародыша в направлении передвижения.
Открытый способ. Скорлупу над воздушной камерой срезают так, чтобы образовалось окно диаметром 1,5-2,5 см. Через него пинцетом под контролем глаза снимают подскорлупную оболочку. Затем анатомический (14 см) пинцет с сомкнутыми браншами ведут, продавливая хорионаллантоисную оболочку по направлению к зародышу. Когда пинцет достигнет его, бранши размыкают, захватывают амниотическую оболочку вместе с ХАО и подтягивают к окну. Удерживая левой рукой пинцет с фиксированной в нем оболочкой амниона, вводят вируссодержащий материал (рис. 7). Далее все оболочки опускают, окно закрывают лейкопластырем и эмбрион инкубируют в вертикальном положении.
Заражение в тело зародыша. Для заражения используют эмбрионы 7-12-дневного возраста. Известно два варианта метода.
Первый вариант. Заражают так же, как в амнион закрытым способом, с той лишь разницей, что берут острую иглу и на овоскопе показателем попадания иглы в тело считают подчинение зародыша движениям иглы.
Второй вариант. Заражают так же, как в амнион открытым способом: через окно в скорлупе подтягивают пинцетом тело зародыша. Материал вводят в головной мозг или определенные участки тела. При таких методах заражения бывает значительный процент неспецифической гибели эмбрионов.
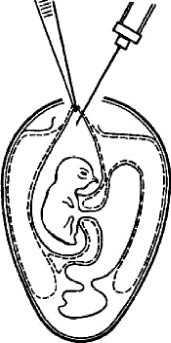
Рис. 7. Заражение куриного эмбриона в амнион открытым способом (по Николау и др.)
Заражение в кровеносные сосуды ХАО. При овоскопировании 11-13-дневных эмбрионов отмечают крупный кровеносный сосуд. По его ходу удаляют участок скорлупы, наносят 1-2 капли спирта, что делает на некоторое время подскорлупную оболочку прозрачной. Под контролем глаза на овоскопе иглу вводят в сосуд, что подтверждается его подвижностью при небольших боковых движениях иглы. Обнаженный участок подскорлупной оболочки закрывают кусочком лейкопластыря.
Можно материал в сосуды ввести и несколько отличающимся способом. Срезают скорлупу над воздушной камерой, подскорлупную оболочку смачивают спиртом и в ставшие видными сосуды ХАО вводят материал. Отверстие закрывают кусочком стерильного лейкопластыря.
Описанные технические приемы экспериментального заражения куриных эмбрионов не единственные, а имеют различные варианты.
Перед дальнейшей инкубацией на скорлупе зараженных любым методом куриных эмбрионов простым (графитным) карандашом пишут, чем заражен эмбрион и когда, а если нужно, то и другие сведения. Зараженные куриные эмбрионы помещают в термостат для дальнейшей инкубации, в процессе которой происходят репродукция внесенных вирусов и их накопление в соответствующих структурах. Температура инкубации эмбрионов варьирует от 33 до 38 °С в зависимости от свойств вируса, которым проведено
заражение.
За эмбрионами ведут постоянное наблюдение, просматривают на овоскопе, отбирая павшие.
Гибель эмбрионов в первые 24 ч после заражения чаще всего обусловлена размножением грибов, бактериальной микрофлоры, внесенных в эмбрион вместе с инокулятом, или травмированием при заражении. Эта гибель считается неспецифической. В более поздние сроки эмбрионы гибнут в результате, как правило, размножения в эмбрионах вируса. Обнаружив погибшие эмбрионы, их сразу же переносят в холодильник с температурой 4 °С. Такие условия, с одной стороны, способствуют сохранению активности накопившегося в эмбрионе вируса, с другой - уплотнению тканей и запустению сосудов, что значительно облегчает последующее вскрытие.
Эмбрионы инкубируют до момента максимального накопления вируса. Для каждого вируса и даже штамма этот срок является определенным и варьирует в пределах от 2 до 7-8 сут. Так, для вируса ньюкаслской болезни штамма Н он составляет 2-3 дня, для того же вируса штамма В - 5 дней, для вируса инфекционного ларинготрахеита птиц - 5 дней и т.д. Затем все эмбрионы умерщвляют охлаждением при 4 °С в течение не менее 3-4 ч и вскрывают.
Признаки размножения вируса в курином эмбрионе. Показателем заражения эмбриона вирусом может служить его гибель в характерные для данного вируса сроки. Другой признак размножения вируса - патологоанатомические изменения, появляющиеся в различных структурах эмбриона. Так, ХАО может быть отечной, иметь кровоизлияния, узелки, или, как их называют, оспины. Такого рода поражения наблюдаются при заражении куриных эмбрионов вирусами оспы птиц, инфекционного ларинготрахеита птиц, болезни Ауески и некоторыми другими. При этом размер и морфология оспин заметно различаются при размножении разных вирусов. Сам зародыш может отставать в росте и развитии от незараженных, т.е. проявлять феномен карликовости. Тело его может быть в разной степени обезвожено или мумифицировано, шея характерно перекручена. Названные признаки характерны для инфекционного бронхита кур. Кожа зародыша может быть гиперемирована, с кровоизлияниями. Внутренние органы также могут иметь признаки размножения вируса. Например, набухшая желто-зеленого или темно-зеленого цвета печень куриного эмбриона - признак размножения в нем вируса гепатита утят.
Встречаются вирусы (например, штамм В, вируса ньюкаслской болезни), которые, размножаясь в куриных эмбрионах, не вызывают ни их гибели, ни патологоанатомических изменений. Обнаружить такой вирус можно лишь в том случае, если он обладает способностью агглютинировать эритроциты, т.е. с помощью реакции гемагглютинации (РГА). Явление гемагглютинации представляет собой соединение эритроцитов в хлопья при добавлении к ним суспензии гемагглютинирующего вируса. Гемагглютинирующими свойствами обладают те вирусы, вирионы которых имеют на поверхности рецепторы, способные взаимодействовать с рецепторами оболочек эритроцитов. Такие вирионы адсорбируются на поверхности эритроцитов. Адсорбция одного вириона одновременно на двух эритроцитах ведет к тому, что последние оказываются соединенными между собой, а адсорбировавшийся вирион играет роль мостика между ними. Образованием таких мостиков между многими эритроцитами и объясняется склеивание эритроцитов в хлопья.
Образование хлопьев, видимых невооруженным глазом, можно наблюдать при смешивании капли суспензии вируса с каплей отмытых эритроцитов на плоской поверхности (стекла, керамики и др.). При смешивании суспензии эритроцитов и вируса в пробирке хлопья эритроцитов оседают ровным слоем на дно в форме так называемого зонтика.
РГА используют для обнаружения и титрования вирусов. Хлопья эритроцитов появляются через 5-10 мин после смешивания капли вируссодержащей жидкости и капли взвеси эритроцитов. Положительная гемагглютинация не только указывает на присутствие вируса, но и выявляет его гемагглютинирующую активность с определенным видом эритроцитов, что может служить вспомогательным диагностическим признаком.
Нередко при вскрытии эмбриона не удается обнаружить ни одного признака размножения вируса, хотя он и находится в исследуемом материале. Такой пассаж, как уже говорилось, называется «слепым».
Вскрытие куриного эмбриона и получение вируссодержащего материала. Вскрывают куриные эмбрионы с целью обнаружения признаков размножения в них вирусов и получения вируссодержащего материала. Последнее требует соблюдения правил асептики при вскрытии.
В зависимости от того, каким вирусом был заражен эмбрион (а значит, в какой структуре он накопился соответственно тропизму), вируссодержащим материалом могут служить ХАО, ткани зародыша, желточный мешок (его стенки), а также аллантоисная и амниотическая жидкости. В последнем случае выделение вируса наиболее удобно, так как экстраэмбриональные (аллантоисная, амниотическая) жидкости представляют, по существу, готовую суспензию вируса. Перед вскрытием скорлупу эмбриона обрабатывают йодированным спиртом (иногда еще фламбируют). Вскрытие производят в боксе, пользуясь стерильными инструментами и посудой. Скорлупу срезают над той воздушной камерой (естественной или искусственной), через которую заражали.
При этом яйцо держат под некоторым углом, чтобы скорлупа не упала внутрь. Ножницы не должны касаться и повреждать лежащую под воздушной камерой оболочку, для этого срез должен проходить несколько выше границы воздушной камеры.
Обнажившуюся ХАО осматривают, приподнимая ее пинцетом с целью установления в ней патологоанатомических изменений. Часть ХАО, на которую был нанесен вируссодержащий материал, имеет обычно наиболее выраженные изменения. Для более тщательного осмотра ее и взятия этой части приподнимают пинцетом ХАО в этом месте и срезают ножницами как возможно больше. Для осмотра и взятия всей ХАО удаляют зародыш, желточный мешок и белок, а хорионаллантоисную оболочку отслаивают от внутренней поверхности скорлупы, извлекают и переносят в стерильную чашку Петри с физраствором. Оболочку отполаскивают, а затем двумя пинцетами расправляют так, чтобы она лежала в один слой и могла быть осмотрена по всей поверхности. Для того чтобы патологоанатомические изменения оболочки были видны более отчетливо, под чашку Петри подкладывают лист черной
бумаги.
Аллантоисную жидкость в количестве до 10 мл отсасывают пипеткой, которой прокалывают подскорлупную оболочку и ХАО над телом зародыша (рис. 8). Такое направление пипетки предотвращает случайный разрыв стенки желточного мешка и смешивание его содержимого с набираемой аллантоисной жидкостью.
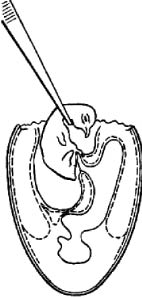
Амниотической жидкости удается отсосать до 1 мл. Для этого после удаления аллантоисной жидкости пипетку вводят в амнион между головой и телом зародыша под его шеей (рис. 9).
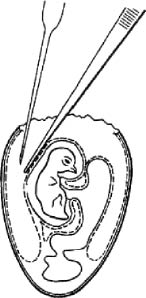
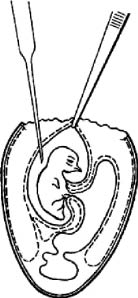
Рис. 8. Отсасывание аллантоисной жидкости (по Николау)
Рис. 9. Отсасывание амниотической жидкости (по Николау и др.)
Для получения стенки желточного мешка как вируссодержащего материала желток извлекают на чашку Петри, стенку его разрезают ножницами и отполаскивают от содержимого в физиологическом растворе. Тело зародыша извлекают, удерживая его за шею (рис. 10).
При вскрытии куриных эмбрионов ставят бактериологический контроль вируссодержащего материала посевом на МПБ, МПА, МППБ и среду Сабуро. Вируссодержащий материал хранят при минус 25 °С и ниже.
Культивирование с производственными целями на куриных эмбрионах применяется для размножения ряда вирусов (осповакцины, клещевого энцефалита, гриппа, москитной лихорадки и др.). Так, для изготовления гриппозной и оспенной вакцин используют вирусы, размноженные на хорионаллантоисной оболочке, вакцины против москитной лихорадки - в аллантоисной полости, а вирус клещевого энцефалита культивируют в желточном мешке.
Метод размножения вирусов на культурах тканей
Для изготовления живых и инактированных вакцин вирусы размножаются на первичных культурах тканей, а диагностических препаратов также и на перевиваемых культурах.
Для размножения вирусов предложен ряд методов с использованием культур тканей. Такие методы, как Карреля-Берреуза (1910), культивирование кусочков ткани, фиксированных в сгустке плазмы, Меттлендов (1928) - культивирование в переживающих тканях - в настоящее время не используются не только в производстве, но и в исследовательской работе. Эти методы вытеснены культивированием в однослойной культуре клеток.
Работа по культивированию клеток производится в специальных лабораториях при соблюдении высоких требований к стерильности воздуха, посуды, растворов, питательных сред. Используемая посуда должна быть нейтральной, хорошо вымытой и обезжиренной, применяемые реактивы - химически чистыми.
Широко применяются различные растворы химических веществ (фосфатный буферный, Хэнкса, Эрла, феноловый красный, трипсина, версена др.) и антибиотики (микостатин или нистатин - 40000 ед, пенициллин и стрепотимицин 500000 ед в 1 мл). Концентраты антибиотиков хранят в замороженном состоянии.
В качестве питательных сред используются такие, как синтетическая № 199, содержащая 20 различных аминокислот, 17 витаминов, 10 компонентов нуклеиновой кислоты, 2 источника липоидов и 7 прочих веществ, или среда Эндерса, из таких естественных компонентов, как коровья амниотическая жидкость и, эмбриональный экстракт, лошадиная сыворотка.
В настоящее время предложено до 15 различных сред из естественных компонентов.
Обычно в питательные среды и растворы для предупреждения бактериальных проростов в момент их использования вводят концентрат антибиотиков с таким расчетом, чтобы в 1 мл было 100 ед. пенициллина, 100 мг стрептомицина и 25-30 ед. микостатина или нистатина.
Метод однослойных культур имеет значительное преимущество перед первыми, двумя тем, что на них можно легко изучать процесс взаимодействия вируса с клеткой и получать большие выходы вирусной массы, что имеет большое значение в производстве.
В основе этого метода лежит получение суспензии клеток из кусочков тканей того или другого органа путем обработки их протеолитическими ферментами, которые разрушают межклеточные протоплазматические мостики. В практике для этих целей обычно используется трипсин.
В общих чертах изготовление суспензии клеток заключается в том, что орган, клетки которого должны быть получены, разрезается на кусочки и многократно промывается фосфатно-буферным раствором для удаления крови. Трипсинизацию ведут в специально смонтированных колбах Эрленмейера на магнитной мешалке при 32 °С. Периодически (15 минут) раствор трипсина сливается и заменяется свежим до окончания отделения клеток от тканевых кусочков. Собирают до 60-80 млн. клеток с 1 г ткани органа. В дальнейшем клетки центрифугируют при 2000 об./мин в течение 30 минут для удаления трипсина. Клетки суспендируют в подогретой до 37 °С питательной среде и подсчитывают при помощи камеры Горяева или других. В зависимости от используемой посуды берут различное количество клеток (для 1,5 литровых матрацев - 750000, матрацев Ру -
100000 и пробирок - 400000) в 1 мл. В 1,5 литровые матрацы наливают 200 мл, в матрацы Ру - 100 мл и в пробирки - 0,5 мл указанной выше концентрации суспензии клеток в питательной среде. Выращивание производится при 37 °С в течение 5-7 дней.
Клетки продуцируют, в том или другом количестве в зависимости от вида, клейкое белковое вещество, при помощи которого они прикрепляются к стеклу. В результате размножения они покрывают в виде одного слоя всю поверхность сосуда, в котором производится выращивание.
При необходимости клетки суспендируют, пользуясь такими физическими приемами, как встряхивание или соскабливание со стекла пластмассовой пластинкой или резиной, укрепленной на стеклянной палочке. Если физическими методами не удается снять клетки, прибегают к использованию химических приемов: действием протеолитических энзимов (трипсин) или поверхностно-активных агентов (версен).
Для культивирования вирусов применяют первичные культуры многих тканей (клетки первого пассажа из ткани органа), в особенности куриного эмбриона, почки обезьяны и эмбриона человека.
Наряду с первичными культурами тканей используются и культуры перевиваемых клеток (особые штаммы клеток, поддерживаемые в искусственных условиях), обычно полученные из отдельных клонов (поколение отдельных клеток). В настоящее время предложено около 50 штаммов из нормальных тканей человека и различных животных и более 10 штаммов раковой ткани человека и животных.
Перевиваемые культуры тканей имеют ряд преимуществ перед первичными. Так, они свободны от посторонних вирусов, обычно обладают более широким спектром чувствительности к инфицирующим агентам, лучше переносят повышенные концентрации антибиотиков работа с ними значительно проще и требует меньших материальных затрат.
В последнее время у перевиваемых культур тканей обнаружена еще одна положительная черта - способность роста в суспендированном состоянии. Показано, что, по крайней мере, три перевиваемых штамма могут быть размножены глубинным методом, если выращивание производить при вращении сосуда, в котором находится суспензия клеток, со скоростью 300 об./ч. Добавление в среду выращивания 0,1 % метилцеллюлозы способствует сохранению клеток в суспензии. Предложен ряд аппаратов для этих целей. Широко используемая в ряде зарубежных лабораторий ротационная качалка типа Броневик обеспечивает во флаконах с культурой воронкообразное движение среды, так как аппарат развивает скорость вращения до 1300 об./ч.
Исследования, проведенные в этом направлении в Томском институте вакцин и сывороток, показывают, - что нет необходимости создавать такие скорости для культур, выращиваемых в суспендированном состоянии. В последнее время для глубинного метода размножения клеток разработан специальный тип реактора. Считают, что этот метод является наилучшим, для получения больших количеств клеток.
Несмотря на ряд преимуществ, у перевиваемых культур клеток, использование их при производстве вирусных препаратов ограничено, так как многие признают, что в основе превращения клеток в перевиваемые, при длительном культивировании, лежит их злокачественное перерождение.
В связи с этим перевиваемые культуры тканей не используются для размножения вирусов с целями производства из них препаратов, вводимых в организм человека.
При размножении вируса в культуре ткани наблюдаются две формы взаимодействия клеток с внедрившимся и репродуцирующимся в них вирусом - острая и латентная инфекции. Острая форма инфекции сопровождается деструкцией клетки и в ряде случаев распадом ее; этот процесс носит название цитопатогенного действия. Форма этой деструкции бывает различной в зависимости от вируса ее вызвавшего.
При латентной форме инфекции размножение вируса не вызывает гибели клеток и внешне они могут не отличаться от незараженных культур.
Механизм взаимодействия вируса с клеткой заключается в адсорбции его чувствительной клеткой, проникновении вируса или его нуклеиновой кислоты в клетку, синтезе в ней вирусных, частиц и выделении их из клетки. Показано, что вирус в питательной среде появляется после фазы созревания в клетке, продолжающейся примерно 4 часа, после чего начинается медленное его выделение в среду. Заражение свежих клеток в зависимости от вида вируса происходит или через среду или в основном путем контакта здоровой клетки с зараженной.
В связи с тем, что одновременно заражаются не все клетки, да и процесс размножения их в культуре имеет место, инкубация посевов в термостате производится в течение двух и более суток, в зависимости от вида вируса и культуры ткани. Так при изготовлении тканевой культуральной противоэнцефалитной вакцины вирус клещевого энцефалита выращивается на первичной культуре клеток куриного эмбриона 48-55 часов. Для увеличения выхода вируса можно производить два сбора - после двухсуточного культивирования питательная среда, содержащая вирус, сливается, а на слой клеток в матрацы наливается свежая порция, и выращивание вновь продолжается в течение установленного срока.
Культивирование бактериофагов осуществляется на культурах микробов (бактерий, актиномицетов), в клетках которых они интенсивно размножаются.
Метод размножения вирусов в культурах клеток
Культура клеток - это клетки многоклеточного организма, живущие и размножающиеся в искусственных условиях вне организма (in vitro).
Методика культивирования клеток особенно успешно стала развиваться после 40-х годов текущего столетия. Этому способствовали следующие обстоятельства: открытие антибиотиков, предотвращающих бактериальное заражение культур клеток, открытие Хуангом (1943) и Эндерсом (1949) способности вирусов вызывать специфическую деструкцию клеток (цитопатический эффект) - удобный метод индикации вирусов в культурах клеток, и, наконец, Дульбекко и Фогт (1952) предложили методику трипсинизации тканей и получения однослойных культур клеток.
В вирусологической практике применяют следующие культуры клеток: первично-трипсинизированные культуры клеток - клетки, полученные непосредственно из органов или тканей организма, растущие in vitro в один слой. Культуру клеток можно получить практически из любого органа или ткани человека или животного (взрослого или эмбриона). Однако лучше это удается сделать из эмбриональных органов, так как клетки эмбрионов обладают более высокой потенцией роста. Чаще всего для этих целей используют почки, легкие, кожу, тимус, тестикулы эмбрионов или молодых животных.
Для получения первичных клеток от здорового животного не позднее 2-3 ч после убоя берут соответствующие органы или ткани, измельчают их на кусочки (1-4 мм) и обрабатывают ферментами: трипсином, панкреатином, коллагеназой и другими (чаще трипсином). Ферменты разрушают межклеточные вещества, полученные при этом отдельные клетки суспендируют в питательной среде и культивируют на внутренней поверхности пробирок или матрасов в термостате при 37 °С.
Клетки прикрепляются к стеклу и начинают делиться. В развитии культур клеток различают несколько фаз: адаптации, логарифмического роста, стационарную и старения (гибель клеток). Размножаясь, клетки размещаются на поверхности стекла и при полном покрытии его в один слой контактируют друг с другом и прекращают делиться (контактная ингибиция).
На стекле формируется слой толщиной в одну клетку (поэтому эти культуры клеток называют однослойными или монослойными).
Обычно монослой формируется через 3-5 дней. Скорость его формирования зависит от вида ткани, возраста животного, качества питательной среды, посевной концентрации клеток и других факторов.
Питательную среду меняют по мере загрязнения ее продуктами жизнедеятельности клеток. Монослой сохраняет жизнеспособность в течение 7-21 дня (в зависимости от вида клеток и состава питательной среды).
Интенсивность размножения клеток и состояние монослоя контролируют визуально под малым увеличением микроскопа (объектив х10). Лучше для этой цели использовать инвертированный микроскоп.
Для культивирования вирусов используют молодые культуры клеток (как только сформировался монослой).
Субкультуры. В вирусологической практике часто используют субкультуры, которые получают из первичных клеток, выращенных в матрасах, путем снятия их со стекла раствором версена или трипсина, ресуспендирования в новой питательной среде и пересева на новые матрасы или пробирки. Через 2-3 сут формируется монослой.
Практически субкультуру можно получить из всех первичных культур клеток. (Хуже субкультивируются куриные фибробласты.) Субкультуры по чувствительности к вирусам не уступают первичным культурам клеток, кроме того, они более экономичны, и есть возможность выявления контаминации клеток вирусами. Субкультуры получают от 2-5 пассажей (перевивок) и очень редко до 8-10. Последующие пассажи приводят к изменению морфологии клеток и их гибели. Если клеточные культуры прошли более 10 пассажей, они уже на стадии перехода к перевиваемым культурам клеток.
Перевиваемые культуры клеток - это клетки, способные к размножению вне организма неопределенно длительное время. В лабораториях их поддерживают путем пересевов из одного сосуда в другой (при условии замены питательной среды).
Получают перевиваемые клетки из первичных культур клеток с повышенной активностью роста путем длительных пересевов в определенном режиме культивирования. Обычно работа по получению новых клеточных линий продолжается несколько месяцев. Полагают, что механизм происхождения перевиваемых культур клеток - результат генетической изменчивости клеток или селекции единичных клеток, присутствующих в первичной исходной культуре.
Клетки перевиваемых культур имеют одинаковую форму, гетероплоидный набор хромосом (у первичных клеток он диплоидпый), стабильны в условиях роста in vitro, некоторые из них обладают онкогенной активностью. Последнее свойство ограничивает использование перевиваемых культур клеток для культивирования вирусов при производстве вакцин.
Перевиваемые культуры клеток можно получать как из здоровых тканей животных, так и из опухолевых. Среди них наиболее широко используют следующие линии клеток: HeLa (из раковой опухоли шейки матки женщины); Нер-2 (из карциономы гортани человека); KB (из раковой опухоли полости рта); ВНК-21 (почка новорожденного хомячка); ППЭС (перевиваемая почка эмбриона свиньи); ППТ (перевиваемая почка теленка); ППО (перевиваемая почка овцы); TR (из слизистой трахеи коровы); L (мышиные фибробласты). СОЦ (из сердца обезьяны циномольгус) и др. Перевиваемые клетки имеют преимущества перед первичными: их приготовление значительно проще, экономятся труд и материальные средства; эти культуры заранее можно проверить на наличие латентных вирусов и микрофлоры; клональные линии обеспечивают более стандартные условия для размножения вирусов, чем первичные, представляющие смешанную популяцию клеток. Большинство перевиваемых клеток обладает более широким спектром чувствительности к вирусам, чем соответствующие первичные культуры.
Однако перевиваемые клетки имеют и недостатки: они склонны к малигнизации, т.е. злокачественное перерождение независимо от происхождения и снижения чувствительности к вирусам у них происходит быстрее, чем у первичных, поэтому необходимо применять клональные линии перевиваемых клеток.
Поддерживают перевиваемые клетки путем периодических пересевов. Чаще используют бесцентрифужный метод. Для очередного пересева отбирают 2-3-дневную культуру с хорошим монослоем, сливают питательную среду, а клеточный монослой покрывают подогретым до 35-37 °С 0,02 %-м раствором версена. Под действием версена клетки округляются, отделяются от стекла. Через 10-15 мин. после округления клеток версен сливают, оставляя небольшое количество, и выдерживают еще 5-10 минут. Затем добавляют небольшое количество питательной среды. После встряхивания подсчитывают клетки в камере Горяева, исходную клеточную взвесь разводят ростовой питательной средой до необходимой концентрации (80-200 тыс. в 1 мл) и разливают при помешивании в пробирки, закрывают резиновыми пробками и культивируют в термостате при 37 °С в течение 3-4 дней до образования сплошного монослоя. Состав питательной среды зависит от вида клеток, но чаще при культивировании перевиваемых клеток используют среды Игла, 199 или смеси этих сред с гидролизатом лактальбумина.
Диплоидные культуры клеток. Это морфологически однородная популяция клеток, стабилизированная в процессе культивирования in vitro, имеющая ограниченный срок жизни, характеризующаяся в процессе пассирования кариотипом, свойственным исходной ткани, свободная от контаминантов и не обладающая туморагенной активностью при трансплантации хомячкам.
Диплоидные культуры клеток, так же как и перевиваемые, получают из первичных культур клеток. Кариотип клеток очень лабилен и при обычных методах культивирования клеток он изменяется в первые дни. Поэтому потребовались специальные методы обработки ткани, питательные среды высокого качества, фетальная сыворотка для длительного поддерживания клеток in vitro в диплоидном состоянии. Диплоидные клетки получают из различных тканей эмбриона человека (легкие, почки, кожно-мышечная ткань, сердце и др.) и животных (почки эмбриона крупного рогатого скота, свиней, почки хомяка).
Диплоидные клетки в отличие от перевиваемых имеют ограниченные возможности пассирования. Максимальное число пассажей 50 ± 10, затем количество делящихся клеток резко уменьшается и они гибнут. Однако диплоидные клетки могут быть использованы в течение длительного времени, так как при каждом пассаже часть клеток можно заморозить (-196 °С) и при необходимости восстановить.
Диплоидные клетки имеют преимущества перед перевиваемыми и первичными клетками: 10-12 дней они могут быть в жизнеспособном состоянии без смены питательной среды; при смене среды один раз в неделю остаются жизнеспособными в течение 4 недель; особенно пригодны для длительного культивирования вирусов, у них сохранена чувствительность исходной ткани к вирусам.
Суспензионные культуры клеток. В 1953 г. Оуэне с сотрудниками показали способность клеток размножаться в свободносуспендированном состоянии. В последующие годы этот метод был значительно усовершенствован: была создана современная аппаратура, обеспечивающая размножение клеток со строго заданными параметрами (температура, рН, скорость перемешивания), а также адаптированы многие линии перевиваемых клеток к размножению в этих условиях (ВНК-21, Нер-2, МДВК и др.). Выращивание вирусов в суспензионных культурах клеток открывает большие возможности в промышленном производстве вакцин и диагностикумов. Однако только перевиваемые клетки хорошо культивируются в суспензии.
Новый подход к культивированию клеток в суспензии - применение микроносителей (сефадекс, силикагель, цитолар и др.). На микроносителях культивируемые клетки формируют монослой. Таким образом, этот способ позволяет методами суспензионного культивирования выращивать зависимые от прикрепления к твердому субстрату клетки: первичные, субкультуры, диплоидные. Эти клетки принято называть поверхностно зависимыми.
Способ культивирования на микроносителях в настоящее время чрезвычайно популярен, так как он открывает большие перспективы в клеточной биотехнологии, в получении вакцин и других биологически активных веществ (интерферон, гормоны и т.д.).
Хранение культур клеток. Каждый из трех основных типов клеточных культур - первичных культур, диплоидных штаммов и перевиваемых линий клеток, используемых в вирусологических исследованиях, часто приходится консервировать, так как при продолжительном пассировании клеток in vitro есть опасность бактериального загрязнения и неконтролируемых (генетических) изменений самих клеток.
Наиболее простой метод консервирования культур клеток - хранение их при 4 °С до 1-6 недель. Успешно применяют хранение клеточных штаммов в условиях сухого льда (минус 78 °С) и жидкого азота (минус 196 °С). Для этого клетки снимают с матрасов, суспендируют в концентрации 106 в 1 мл питательной среды, содержащей в качестве защитных веществ 10-40 % сыворотки и 10 % очищенного стерильного глицерина (вместо глицерина успешно применяют ДМСО - диметилсульфоксид). Затем клеточную суспензию разливают в ампулы, запаивают и выдерживают 1-3 ч при 4 °С, после чего замораживают клетки в смеси этилового спирта с сухим льдом. Скорость охлаждения не должна превышать 1 °С в 1 мин. При снижении температуры до минус 25 °С ампулы помещают для хранения в сухой лед. Если для хранения используют жидкий азот, то ампулы с клетками охлаждают до минус 70 °С и кладут в жидкий азот. Хранение клеток в жидком азоте в течение ряда лет не изменяет их пролиферативную активность и чувствительность к вирусам.
Восстанавливают замороженные клетки следующим образом. Ампулу с замороженными клетками быстро погружают в водяную баню на 1-2 мин при легком встряхивании, затем клетки выливают в матрас, добавляют соответствующее количество ростовой среды и культивируют в термостате при 37 °С. Для удаления глицерина или ДМСО питательную среду заменяют на следующий день после посева.
При транспортировке клеток матрасы с выросшим монослоем заливают средой доверху и закрывают резиновой пробкой. В лаборатории питательную среду сливают и используют при культивировании этих клеток в виде добавок к питательной среде, применяемой в данной лаборатории.
Можно транспортировать и клеточную суспензию при 4 °С. При благоприятных условиях транспортировки, исключающих перегревание и замораживание клеток, 80-90 % из них сохраняют жизнеспособность до 7-8 дней.
Работа с культурой клеток требует абсолютной стерильности, тщательной подготовки посуды, соответствующих растворов, питательных сред и высокого качества воды.
Контаминация культур клеток. Работа с культурами клеток, их использование в вирусологических и других исследованиях, в биотехнологии требуют постоянного контроля на отсутствие посторонних агентов (контаминантов). Контаминантами могут быть вирусы, бактерии, грибы, микоплазмы и клетки других клеточных культур. Микоплаз-
мы - одни из наиболее частых контаминантов, особенно в перевиваемых линиях клеток. Своевременное выявление их, других микроорганизмов или вирусов в культуре клеток - важное условие поддержания высокого качества последней. Паспортизация стабильных клеточных линий предусматривает в качестве необходимого теста контроль на отсутствие микоплазмоконтаминации, что должно стать обязательным для всех лабораторий, где работают с культурами клеток.
Резкое закисление питательной среды в культуральных флаконах и опалесценция ее могут быть следствием контаминации культур клеток микоплазмами. Для выявления последних используют следующие методы: посев на питательные среды, тест-культуры, цитологические, радиоавтографические и электронно-микроскопические.
В случае контаминации клеточные культуры уничтожают, а культивирование возобновляют из резервных расплодок, хранящихся в жидком азоте. Только редкие и уникальные культуры подлежат деконтаминации.
Предупредить размножение и подавить случайно попавшие в клеточную культуру бактерии удается с помощью противомикробных препаратов (антибиотиков и др.), добавляемых в ростовые среды непосредственно перед их использованием. Эти препараты следует строго дозировать и применять дифференцирование. Их использование - необходимое условие при возрастании риска контаминации в процессе получения первичных культур клеток при крупномасштабном суспензионном выращивании клеток, массовом производственном культивировании перевиваемых клеток, а также во всех случаях объединения клеточного материала.
При работе с культурами клеток используют многие антимикробные (нетоксичные) препараты в оптимальных дозах. Выбор эффективного препарата или комплекса препаратов зависит от чувствительности к ним конкретных контаминантов.
