
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
1.1. Равновесия с переносом протонов (кислотно-основные равновесия)
Одной из самых многочисленных групп химических реакций, протекающих в водных растворах, являются так называемые донорно-акцепторные взаимодействия. Их сущность заключается в том, что реагирующие частицы, находящиеся в растворе, обмениваются между собой электронами, протонами, молекулами или ионами. При этом одна из взаимодействующих частиц теряет перечисленные обмениваемые частицы Х и называется донором D (от лат. donno - "дарю"), а другая их приобретает и играет роль акцептора А (от лат. acceptor - "принимающий").
Процесс донорно-акцепторного взаимодействия удобно разделить на две полуреакции, суммирование которых описывает сущность рассматриваемого процесса:
D1 -> А1+ nX (1)
A2 + nX -> D2 (2)
![]()
D1 + A2-> A1 + D2 (3)
Как полуреакции (1) и (2), так и суммарная реакция (3) являются в общем случае обратимыми процессами. Когда, например, полуреакция (1) протекает в прямом направлении, то частица D1проявляет свои донорные свойства, отщепляя n частиц Х. Если рассматривать протекание той же полуреакции в обратном направлении, то А1ведет себя как акцептор и, присоединив nX, превращается в D1. Донор и акцептор, принадлежащие к одной и той же полуреакции, называются сопряженными, таковыми являются D1и А1(1-я полуреакция), а также D2и А2(2-я полуреакция).
Отдельно взятая полуреакция особого смысла не имеет, так как не способна протекать самопроизвольно, независимо от других полуреакций; она лишь выражает потенциальную возможность одной частицы быть донором, а другой - акцептором. Действительно, частица D только тогда может реально проявить свои донорные свойства, когда имеется потребитель для отщепляемых частиц Х и, таким образом, равновесие (1) смещается в правую сторону. Аналогично, смещение этого равновесия в левую сторону возможно только при условии, если имеется источник частиц Х, которые А может присоединить к себе, проявляя свои акцепторные свойства.
Потенциальные возможности донора D1и акцептора А1реализуются только тогда, когда одна сопряженная донорно-акцепторная пара D1/А1взаимодействует с другой сопряженной парой D2/А2. В этом случае система содержит два акцептора А1и А2, конкурирующих между собой за обладание обмениваемыми частицами Х, а также два донора D1и D2, которые также конкурируют между собой, стараясь отдать частицы Х. Конечным результатом будет переход частиц Х от более "сильного" донора к более "сильному" акцептору. Если донор D1"сильнее" донора D2, а акцептор А2"сильнее" акцептора А1, то суммарная реакция заключается во взаимодействии D1и А2с образованием в качестве продуктов D2и А1, то есть преобладать будет прямое направление реакции (3). Если же, наоборот, донор D2"сильнее" D1, а акцептор А1"сильнее" А2, то реакция (3) преимущественно протекает в обратном направлении. Сказанное можно иллюстрировать следующей схемой:
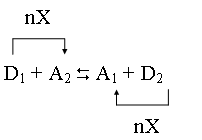 .
.
Под силой донора и акцептора подразумевается количественная мера их способности соответственно отдавать или присоединять обмениваемые частицы Х. Из сказанного вытекает, что, чем сильнее донор данной донорно-акцепторной пары, тем слабее ее акцептор, и наоборот. Количественно сила донора или акцептора оценивается по-разному, в зависимости от конкретного типа донорно-акцепторного взаимодействия. Уточнение этого понятия будет дано при рассмотрении соответствующих равновесий.
Поскольку любая донорно-акцепторная реакция, протекающая в водном растворе, представляет собой сочетание двух сопряженных донорно-акцепторных пар, то в целом такие реакции носят название реакций двойного сопряжения.
В зависимости от природы обмениваемых частиц Х донорно-акцепторные реакции в водных растворах подразделяются на следующие типы:
1. Равновесия с переносом протонов. В данном случае переносимой (обмениваемой) частицей является протон Н+. Данный тип реакций охватывает весь спектр кислотно-основных равновесий. Донором протона являются кислоты, а акцептором – основания.
Пример: HF + NH3D F–+ NH4+.
Данная реакция может быть представлена как совокупность двух полуреакций:
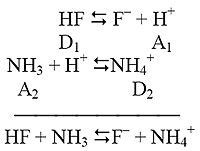 .
.
При схематической записи сопряженных кислотно-основных пар принято над чертой записывать кислоту данной пары, а под чертой - основание. Таким образом, реакция, рассматриваемая в данном примере, представляет собой сочетание сопряженных кислотно-основных пар HF/F–и NH4+/NH3.
В водных растворах очень часто полноправным участником кислотно-основных равновесий является вода, молекулы которой способны играть роль как кислоты, так и основания:
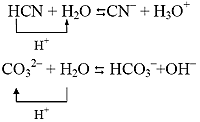 .
.
2. Равновесия с переносом электрона. Если обмениваемой частицей Х является электрон, то речь идет об окислительно-восстановительных реакциях, например:
Ce4++ Fe2+DCe3++ Fe3+
Эта реакция представляет собой сопряжение двух окислительно-восстановительных пар:
Ce4+ + e– DCe3+; Ce4+/ Ce3+
Fe2+ - e– DFe3+; Fe3+/ Fe2+
Заметим, что при символическом изображении сопряженной окислительно-восстановительной пары окислитель этой пары (акцептор электронов) записывается над чертой, а восстановитель (донор электронов) – под чертой.
3. Равновесия с переносом молекул, ионов или атомов. Здесь роль обмениваемой частицы могут играть электрически нейтральные молекулы (чаще всего H2O и NH3), ионы (как правило, анионы, например CN–, F–, NO2–и т.д.), реже - атомы (например, О, Н и т.д.), которые носят общее название лигандов:
FeF2++ Al3+DFe3++ AlF2+
При протекании данной реакции в прямом направлении донором является частица FeF2+, а акцептором - Al3+. Роль лиганда играет анион F–.
Общепринятого символического обозначения сопряженных донорно-акцепторных пар в этом случае не существует.
