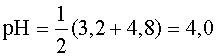Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
1.1.2. рН смеси растворов двух слабых кислот или оснований
Смешаем растворы, в одном из которых содержится слабая кислота А1, а в другом - слабая кислота А2. Таким образом, смесь представляет собой сочетание двух сопряженных кислотно-основных пар А1/В1 и А2/В2, а также воду как растворитель, но собственную диссоциацию воды в дальнейших рассуждениях учитывать не будем.
Пусть кислота А1 сильнее, чем кислота А2, тогда основание В2 сильнее, чем основание В1, то есть в растворах до их сливания рН1 < pH2, pK1 > > pK2.
После смешивания растворов в смеси установится равновесие, характеризующееся тем, что в ходе его установления А1 будет являться донором протонов, а В2 - их акцептором:
А1 D В1 + Н+
В2 + Н+ D А2
![]()
А1 + В2 D В1 + А2 (9)
Система в состоянии равновесия описывается уравнением (9). Обратим внимание на то, что в этом состоянии [B1] = [A2], а [A1]= [B2]. В ходе установления равновесия рН1 и рН2 сравняются и установится новое значение рН раствора, которое можно найти путем суммирования выражений рН1 и рН2 отдельных кислотно-основных пар, учитывая, что к моменту достижения равновесия в системе рН1=рН2=рН:
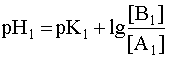 .
.
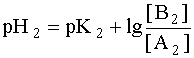 .
.
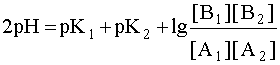 .
.
Поскольку дробь под знаком логарифма равна единице, то окончательно имеем:
2рН = рК1 + рК2
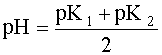 (10)
(10)
Полученное выражение позволяет сделать весьма важный вывод:
если в водном растворе сосуществуют две сопряженные кислотно-основные пары, то рН такого раствора не зависит от исходных концентраций содержащихся в нем форм, а зависит только от констант кислотности сосуществующих пар.
Данный вывод позволяет рассчитать рН растворов в некоторых особых случаях, что можно пояснить с помощью следующих примеров.
1. рН раствора соли слабого основания и слабой кислоты. Классическим примером такой соли является ацетат аммония NH4CH3COO. В водном растворе эта соль, будучи хорошо растворимой, существует в виде своих ионов:
NH4CH3COO D NH4+ + CH3COO–
С другой стороны, эти ионы в водной среде входят в состав сопряженных кислотно-основных пар, каждая из которых характеризуется своей константой кислотности:
NH4+ + H2O D NH3 + H3O+;![]() ; pK1 = 9,2
; pK1 = 9,2
CH3COO–– + H2O D CH3COOH + OH–; ![]() ; pK2 = 4,8
; pK2 = 4,8
Катион аммония является кислотой, а ацетат-анион - основанием, поэтому эти ионы могут обмениваться протонами не только с растворителем (водой), но и непосредственно друг с другом:
NH4+ D NH3 + H+
CH3COO– + H+ D CH3COOH
![]()
NH4+ + CH3COO– D NH3 + CH3COOH
Таким образом, рассмотренный случай является типичным примером сочетания двух кислотно-основных пар и поэтому рН раствора равен
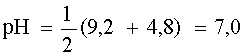 .
.
2. Смесь соли с кислотой (основанием). Если имеется эквимолярная смесь соли, образованной сильным основанием и слабой кислотой, с другой слабой кислотой; или соли, образованной слабым основанием и сильной кислотой с другим слабым основанием, то это тоже случай сочетания двух кислотно-основных пар, к которому применимо соотношение (10).
В качестве примера можно взять эквимолярную смесь NaF и CH3COOH. Здесь взаимодействуют между собой кислотно-основные пары ![]() (рК1 = 3,2) и
(рК1 = 3,2) и![]() (pK2 = 4,8). рН такого раствора
(pK2 = 4,8). рН такого раствора