
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
1.2.2. Концентрация свободных лигандов и иона-комплексообразователя в растворе комплекса
Реакции комплексообразования в водных растворах, подобно кислотно-основным равновесиям, которые были рассмотрены ранее, по своей сути представляют собой донорно-акцепторные взаимодействия. По этой причине между этими двумя типами равновесий много общего, хотя есть и различия, обусловленные специфическими особенностями каждого из них. Рассмотрим одну из ступеней диссоциации комплекса (например, первую) в растворе
[Ag(NH3)2]+ D [AgNH3]+ + NH3.
Здесь донором (D) является комплекс [Ag(NH3)2]+, акцептором (А) - [AgNH3]+, а переносимой частицей (Х) - молекула NH3 (лиганд). Константа равновесия для данной ступени диссоциации (первая константа нестойкости) имеет вид:
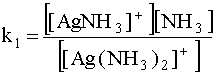 .
.
Если исходную концентрацию комплекса СК в первом приближении принять равной его равновесной концентрации, то есть [[Ag(NH3)2]+] » СК и выразить отсюда равновесную концентрацию свободных лигандов NH3 в виде десятичного логарифма этой величины, взятого с обратным знаком (рNH3), то получим выражение, абсолютно аналогичное выражению рН для растворов слабых кислот (5):
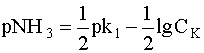 .
.
или в общем случае
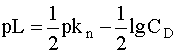 (11)
(11)
Здесь Kn - константа нестойкости комплекса по n-ой ступени, а CD - концентрация комплекса, играющего роль донора при диссоциации по той же ступени.
В справочной литературе чаще всего приведены не частные константы нестойкости комплексов, а общие (полные), поэтому целесообразно уравнение (11) преобразовать для случая полной диссоциации комплекса MLn (без учета зарядов комплексообразователя M, лигандов L и комплексной частицы MLn в целом). Здесь n – координационное число комплексообразователя М.
Если указанный комплекс подвергается полной диссоциации
MLn D М + nL
то этому случаю соответствует общая (полная) константа нестойкости К:
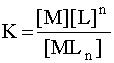 .
.
Учитывая, что равновесная концентрация иона - комплексообразователя [M] в n раз меньше равновесной концентрации лигандов [L] (что вытекает из уравнения диссоциации), можно записать:
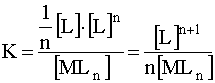 .
.
Приняв также, что для достаточно устойчивых в водном растворе комплексов равновесная концентрация комплексных частиц [MLn] приблизительно равна их исходной концентрации СК, имеем:
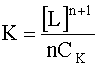 .
.
Прологарифмируем это выражение и выразим из него рL, введя обозначения рL=-lg[L], pK = -lgK:
![]() .
.
![]() .
.
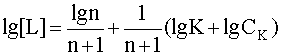 .
.
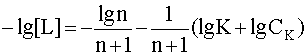 .
.
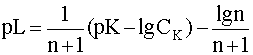 (12)
(12)
Следует учесть, что для подавляющего большинства одноядерных комплексов координационное число n не превышает восьми. При этом условии последнее слагаемое уравнения (12) можно считать величиной постоянной, приблизительно равной 0,1.
Зная рL, а, следовательно, и равновесную концентрацию лиганда L в растворе, не содержащем ничего, кроме рассматриваемого комплекса, легко найти и равновесную концентрацию свободных ионов комплексообразователя М.
Показатель рL можно рассчитать и тогда, когда известны только равновесные концентрации иона - комплексообразователя [M] и комплексных частиц [MLn]. Оно выводится аналогично уравнению (8) и в окончательном виде записывается следующим образом:
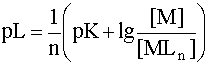 (13)
(13)
Очевидна полная идентичность уравнений (8) и (13) с той только разницей, что в выражении (13) присутствует сомножитель ![]() . Также очевидно и то, что если данное уравнение относится лишь к одной отдельно взятой ступени диссоциации комплекса, то этот сомножитель отсутствует и тогда уравнения (8) и (13), решенные относительно переносимой частицы (протона в кислотно-основных равновесиях и лиганда в реакциях комплексообразования), абсолютно идентичны, что еще раз подчеркивает единую сущность этих двух процессов.
. Также очевидно и то, что если данное уравнение относится лишь к одной отдельно взятой ступени диссоциации комплекса, то этот сомножитель отсутствует и тогда уравнения (8) и (13), решенные относительно переносимой частицы (протона в кислотно-основных равновесиях и лиганда в реакциях комплексообразования), абсолютно идентичны, что еще раз подчеркивает единую сущность этих двух процессов.
