
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
1.3.3. Направленность и полнота протекания реакций окисления-восстановления
Прогноз направленности протекания окислительно-восстановительных реакций подчиняется единому правилу, действующему для всех донорно-акцепторных взаимодействий: реакция протекает преимущественно в том направлении, которое отвечает взаимодействию более сильного акцептора (окислителя) с более сильным донором (восстановителем).
Рассмотрим простой пример: будем постепенно приливать раствор, содержащий катионы церия (IV) к раствору, содержащему катионы железа (II). Данная реакция сводится к взаимодействию двух окислительно-восстановительных пар:
Fe3+ + e– D Fe2+;![]()
Ox1![]() Red1
Red1
Ce4+ + e– D Ce3+;![]()
Ox2 Red2
Для безошибочного определения преобладающего направления суммарной реакции целесообразно поступать следующим образом:
1. Исходя из стандартных электродных потенциалов, устанавливаем, что из двух окислителей (Fe3+ и Ce4+) более сильным является катион Ce4+, так как потенциал пары Ce4+/Ce3+ больше, а более сильным восстановителем будет Fe2+, так как потенциал пары Fe3+/Fe2+ меньше. Соединяем их чертой – это исходные вещества суммарной окислительно-восстановительной реакции, поэтому записываем их слева:
Ce4+ + Fe2+ ->
2. Продукты реакции выявляются в соответствии с направлением стрелок, таким образом:
Ce4+ + Fe2+-> Ce3+ + Fe3+
Совершенно очевидно, что данное равновесие будет смещено в сторону прямой реакции, однако принципиально важно знать, насколько полно данная реакция будет протекать слева направо. Об этом можно судить по величине константы равновесия рассматриваемой реакции:
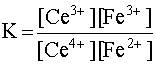 .
.
Чем больше численное значение этой константы, тем полнее протекает данная реакция, тем в большей степени равновесие сдвинуто в правую сторону.
Для расчета K запишем уравнение Нернста для обеих полуреакций:
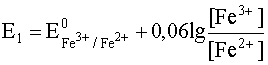 .
.
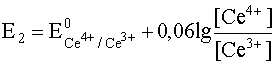 .
.
При постепенном приливании одного раствора к другому концентрации ионов Ce4+ и Fe2+ будут уменьшаться, так как это исходные вещества, расходующиеся в ходе реакции. Напротив, [Ce3+] и [Fe3+] будут возрастать, так как это продукты реакции, накапливающиеся по мере ее протекания. В результате этого Е1 будет увеличиваться, а Е2 - уменьшаться. Равновесие наступит тогда, когда оба потенциала сравняются, то есть когда электродвижущая сила процесса станет равной нулю:
Е1 = Е2
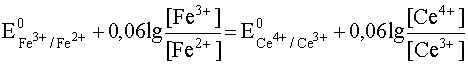 .
.
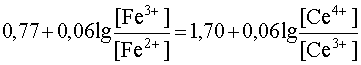 .
.
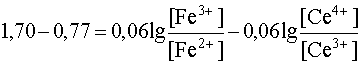 .
.
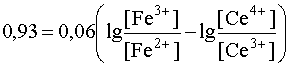 .
.
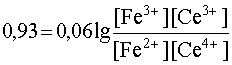 .
.
![]()
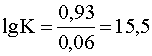 .
.
K=1015,55.
Большое численное значение константы равновесия свидетельствует о том, что данная реакция практически нацело протекает в прямом направлении – до полного исчезновения исходных веществ (конечно, если они были взяты в стехиометрических количествах). Химики-аналитики в этом случае говорят, что реакция протекает количественно.
Разобранный пример позволяет связать константу равновесия окислительно-восстановительной реакции со стандартными электродными потенциалами полуреакций. Для описанного случая, когда от восстановителя (Fe2+) к окислителю (Ce4+) переносится всего один электрон, эта зависимость имеет следующий вид:
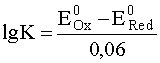 .
.
где Е0Ox и Е0Red - соответственно стандартные электродные потенциалы полуреакций, куда входит окислитель и восстановитель суммарной окислительно-восстановительной реакции.
Для более сложных реакций, в ходе которых от восстановителя к окислителю переносится n электронов, эта зависимость выражается следующим образом:
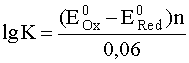 .
.
Так, для суммарной окислительно-восстановительной реакции взаимодействия ионов железа (II) с перманганатом в кислой среде
MnO4– + 5Fe2+ + 8H+ D 5Fe3+ + Mn2+ + 4H2O
константу равновесия вычисляем по формуле:
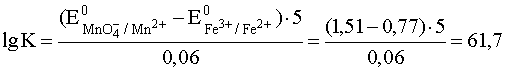 ,
,
то есть K = 1061,7.
Из разобранных примеров также вытекает весьма важный вывод: чем больше разность между стандартными электродными потенциалами окислителя и восстановителя данной окислительно-восстановительной реакции и чем больше при этом переносится электронов, тем полнее эта реакция протекает в заданном направлении.
