
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
1.5.1. Исходные положения
Пусть имеется раствор, в котором одновременно содержатся и находятся в равновесии окисленная и восстановленная формы окислительно-восстановительной пары Fe3+/ Fe2+:
Fe3+ + e– D Fe2+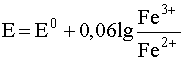 (26)
(26)
Если в этот раствор постепенно добавлять фторид-анионы, то катион Fe3+ будет образовывать с ними комплексы, простейшим из которых является [FeF]2+:
Fe3+ + F– D [FeF]2+;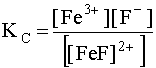 (27)
(27)
Добавление к раствору лиганда F– влечет за собой смещение равновесия (27) в правую сторону, то есть из раствора будут исчезать катионы, превращаясь в [FeF]2+. Но коль скоро в растворе уменьшается концентрация [Fe3+], потенциал (26) системы
Fe3+/ Fe2+ также будет уменьшаться за счет уменьшения дроби под логарифмом. Это, в свою очередь, скажется на величине электродного потенциала окислительно-восстановительной системы Fe3+/ Fe2+ - он будет становиться все меньше и меньше по мере увеличения концентрации лиганда F–. Следовательно, в присутствии лиганда окислительные свойства катионов Fe3+ ослабевают, а восстановительные свойства Fe2+ увеличиваются.
С другой стороны, если каким-либо подходящим восстановителем восстанавливать катионы Fe3+ до Fe2+, то равновесие (27) будет смещено влево, то есть комплекс [FeF]2+ будет разрушаться. Итак, наложение друг на друга двух равновесий - окислительно-восстановительного и комплексообразования - имеет два аспекта: с одной стороны, комплексообразование изменяет силу окислителя и восстановителя данной пары; с другой стороны, окисление-восстановление непосредственно влияет на устойчивость содержащихся в растворе комплексов. Из этих двух аспектов наибольшее практическое значение имеет первый, поэтому рассмотрим его более детально.
