
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
1.5.2. Влияние комплексообразования на свойства окислителей и восстановителей
Выразим равновесную концентрацию [Fe3+] через константу нестойкости комплекса (27):
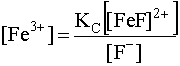 .
.
и подставим ее в уравнение Нернста для данной окислительно-восстановительной системы (26):
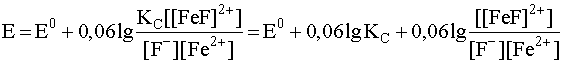 .
.
Два первых слагаемых в этом выражении представляют собой сумму постоянных величин, которая, естественно, тоже есть величина постоянная, которую обозначим Е01 и которая есть новое значение стандартного электродного потенциала окислительно-восстановительной пары Fe3+/Fe2+ с учетом комплексообразования по окислителю:
![]() (28)
(28)
Тогда уравнение Нернста примет вид:
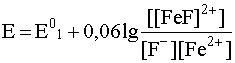 (29)
(29)
Из рассмотрения уравнений (28) и (29) следуют важные выводы:
Если при добавлении лиганда к окислительно-восстановительной системе комплексообразованию подвергается только окислитель, то потенциал этой системы уменьшается, а значит, уменьшается сила окислителя этой пары и увеличивается сила ее восстановителя. Уменьшение потенциала вытекает из того, что для достаточно устойчивых комплексов KC << 1, следовательно, lgKC есть величина отрицательная, поэтому Е01 < Е0.
Уменьшение потенциала окислительно-восстановительной системы будет тем заметнее, чем более устойчивый комплекс образует добавляемый лиганд с окислителем этой системы, то есть чем меньше численное значение константы нестойкости возникающего комплекса.
Дополнительное уменьшение потенциала окислительно-восстановительной системы вызывается введением в раствор избытка лиганда, так как при этом с ростом концентрации лиганда дробь под знаком логарифма в выражении (29) становится все меньше и меньше.
Рассмотренный пример был простейшим в том смысле, что при введении в раствор лиганда подвергался комплексообразованию только один член окислительно-восстановительной пары - в нашем случае окислитель Fe3+. Однако чаще встречаются случаи, когда с вводимым в раствор лигандом комплексы образует как окислитель, так и восстановитель пары. Типичным примером такой ситуации может служить окислительно-восстановительная пара Со3+/Со2+, стандартный электродный потенциал которой равен 1,80 В:
Co3+ + e– D Co2+;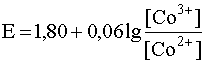 (30)
(30)
При добавлении в раствор, содержащий как окислитель, так и восстановитель этой системы, цианид-анионов в достаточном количестве комплексообразованию подвергается как Co3+, так и Co2+, образуя комплексы [Co(CN)6]3– и [Co(CN)6]4– соответственно. Обозначим константы нестойкости этих комплексов соответственно KOx и KRed, так как в первый комплекс входит окислитель данной системы (Co3+), а во второй - восстановитель (Co2+):
[Co(CN)6]3– D Co3+ + 6CN–;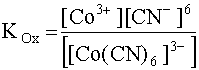 (31)
(31)
[Co(CN)6]4– D Co2+ + 6CN–;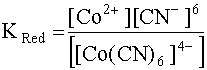 (32)
(32)
Выразим концентрации [Co3+] и [Co2+] через константы нестойкости (31) и (32):
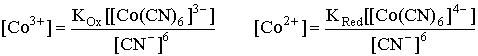 .
.
и подставим в уравнение Нернста (30), в результате чего получим:
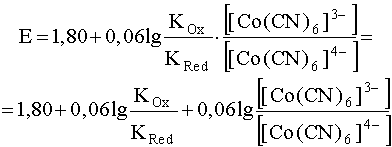 .
.
Новой окислительно-восстановительной системе
[Co(CN)6]3– + e– D [Co(CN)6]4–
соответствует новый стандартный электродный потенциал
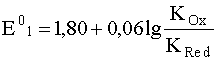 (33)
(33)
Численные значения KOx и KRed соответственно равны 10–64 и
10–19,1. Подставив их в уравнение (33), получаем, что Е01 = –0,89В. Это означает, что в системе [Co(CN)6]3–/[Co(CN)6]4– комплекс [Co(CN)6]4– является очень сильным восстановителем, тогда как комплекс [Co(CN)6]3–, содержащий в качестве комплексообразователя катион Со3+, представляет собой очень слабый окислитель. Этот результат диаметрально противоположен тому случаю, когда мы имеем систему, состоящую из свободных катионов Со3+/Со2+, для которой весьма высокое значение стандартного электродного потенциала Е0 = 1,80 В свидетельствует об очень высокой окислительной способности Со3+ и крайне слабой восстановительной способности Со2+.
Из уравнения (33) дополнительно следует, что стандартный электродный потенциал окислительно-восстановительной пары Е01 будет тем меньше (а, следовательно, восстановительные свойства ее тем больше), чем в большей степени комплексы отличаются друг от друга по своей устойчивости, то есть чем больше разница между KOx и KRed. Практически всегда из двух катионов одного и того же элемента тот из них образует более устойчивый комплекс с одним и тем же лигандом, у которого больший электрический заряд, то есть практически всегда KOx << KRed. Об этом свидетельствуют, наряду с рассмотренными цианидными комплексами Co(II) и Co(III), и хорошо известные гексацианоферраты [Fe(CN)6]3– и [Fe(CN)6]4–. Константа нестойкости первого из них равна 10–44, а второго 10–37. Стандартный электродный потенциал пары [Fe(CN)6]3–/[Fe(CN)6]4– равен +0,54В, а для пары, состоящей из свободных катионов Fe3+/Fe2+ он составляет 0,77 В. Обращает на себя внимание то, что в данном случае разница этих двух стандартных потенциалов значительно меньше, чем в случае разобранных нами цианидных комплексов кобальта. Это и понятно: если для кобальта константы нестойкости комплексов отличаются друг от друга почти на 45 (!) порядков (10–64 и 10–19,1), то для гексацианоферратов эта разница составляет "всего лишь" 7 порядков.
Итак, введение лигандов в окислительно-восстановительную систему, члены которой с добавленными лигандами могут образовывать достаточно устойчивые комплексы, существенно влияет на окислительно-восстановительные свойства этой системы.
