
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
1.6.1. Исходные положения
Когда в растворе одновременно происходит как перенос протонов (протолитическое равновесие), так и перенос электронов (окисление-восстановление), эти два процесса взаимосвязаны и существенно влияют друг на друга. Наложение этих двух равновесий порождает два эффекта: первый – это влияние рН cреды на протекание окислительно-восстановительных реакций, а второй - влияние окисления-восстановления на характер среды раствора. Первый аспект имеет неизмеримо более важное значение, чем второй, поэтому в данном разделе будет рассмотрено именно влияние протолитических процессов на свойства окислителей и восстановителей и, в конечном итоге, на протекание окислительно-восстановительных реакций.
Среди безбрежного многообразия окислительно-восстановительных реакций очень значительно число таких, в которых влияние кислотности cреды выражается в явном виде: это полуреакции с участием кислородсодержащих ионов, где количество атомов кислорода у сопряженных друг с другом окислителя и восстановителя неодинаково. Типичным примером может служить пара MnO4–/Mn2+, которой в кислой среде соответствует уравнение полуреакции:
MnO4– +8H+ + 5e– D Mn2+ + 4H2O,
для которой уравнение Нернста под знаком логарифма содержит концентрацию ионов водорода в весьма высокой степени:
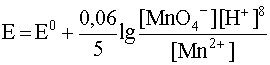 .
.
Совершенно очевидно, что увеличение кислотности раствора в данном случае сильно влияет на окислительные свойства перманганат-иона. Нетрудно догадаться, что влияние кислотности cреды в подобного рода случаях тем значительнее, чем больше дисбаланс по кислороду у окислителя и восстановителя данной пары.
В других случаях в уравнении полуреакции не фигурируют ни протоны, ни гидроксо-анионы. Это имеет место, например, для окислительно-восстановительных пар, состоящих из разнозарядных катионов одного и того же металла (Fe3+/Fe2+, Ce4+/Ce3+ и так далее) или галоген-галоидные пары (Cl2/2Cl–, Br2/2Br– и т.д.). Казалось бы, в этих случаях характер среды не влияет на свойства окислителя и восстановителя. Однако в результате взаимодействия подобного рода частиц с молекулами воды устанавливается протолитическое равновесие, чувствительное к изменению характера cреды и влияющее на свойства окислителей и восстановителей.
