
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
1.6.2. Влияние pH cреды на свойства окислителей и восстановителей
Рассмотрим окислительно-восстановительную пару:
Fe3+ + e– D Fe2+
Уравнение Нернста в данном случае имеет вид:
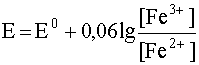 (34)
(34)
Будучи довольно сильной кислотой ![]() , гидратированный ион Fe3+×aq в значительной степени подвергается протолизу:
, гидратированный ион Fe3+×aq в значительной степени подвергается протолизу:
Fe3+ × H2O + H2O D FeOH2+ + H3O+
или, в упрощенной форме:
Fe3+ + H2O D FeOH2+ + H+ (35)
Напишем выражение константы кислотности для данной кислотно-основной пары:
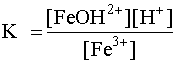 ,
,
откуда
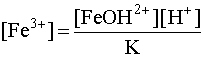 (36)
(36)
При увеличении рН раствора, то есть при уменьшении концентрации ионов водорода равновесие (35) смещается в сторону прямой реакции, что влечет за собой снижение концентрации ионов Fe3+ в результате их превращения в гидроксокатионы FeOH2+. Это, в свою очередь, влияет на величину окислительно-восстановительного потенциала: дробь под знаком логарифма в выражении (34) уменьшается и, следовательно, уменьшается потенциал рассматриваемой окислительно-восстановительной пары. Иными словами, окислительные свойства катиона Fe3+ с увеличением рН раствора ослабевают, а восстановительные свойства Fe2+ усиливаются. Чтобы найти выражение потенциала, учитывающее взаимное влияние окислительно-восстановительного и протолитического равновесий, подставим выражение (36) в уравнение (34):
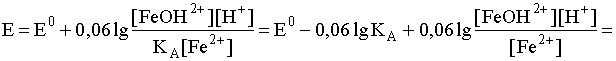 .
.
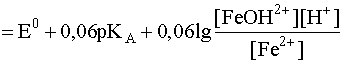 .
.
Следует заметить, что протолизу подвергаются не только ионы Fe3+, но и Fe2+, однако константа кислотности последнего ( ) более чем на три порядка меньше константы кислотности Fe3+, поэтому протолизом катиона железа (II) можно пренебречь.
В общем случае, когда окислительно-восстановительная пара состоит из простых катионов одного и того же металла Mex+/Mey+ (x > y) и учитывается только первая ступень протолиза катиона-окислителя Mex+, уравнение Нернста имеет вид:
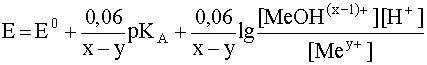 (37)
(37)
Из уравнения (37) следует, что окислительные свойства катиона Mex+ тем меньше, чем больше его константа кислотности (или, что то же самое, чем меньше его рКА). Но самый главный вывод из анализа поведения в водном растворе пары Mex+/Mey+ заключается в том, что даже в случае простых гидратированных катионов окислительно-восстановительные свойства пары зависят от кислотности cреды, хотя это и не следует из формальной записи соответствующей полуреакции
Mex+ + ne– D Mey+ (n = x - y)
Поскольку простые катионы металлов в водном растворе ведут себя как слабые кислоты, для которых логарифм константы кислотности lgK представляет собой отрицательную величину, то второе слагаемое уравнения (37), являясь величиной постоянной для рассматриваемой пары Mex+/Mey+, есть поправка к стандартному окислительно-восстановительному потенциалу Е0, учитывающая протолиз катиона-окислителя Mex+. С учетом этого уравнение Нернста для подобных систем можно записать в виде:
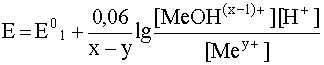 .
.
где 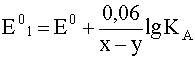 .
.
Для известных систем Mex+/Mey+ разность x - y чаще всего равна единице (Fe3+/Fe2+, Co3+/Co2+, Cr3+/Cr2+ и т.д.), реже - двум (Mn4+/Mn2+, Sn4+/Sn2+, Tl3+/Tl+ и т.д.).
Во всех случаях Е0 < Е01, то есть протолиз катиона Mex+ влечет за собой уменьшение величины табличного стандартного потенциала Е0 и снижение окислительных свойств катиона Mex+.
