
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
1.6.4. Условия существования окислителей и восстановителей в водном растворе. Роль воды
Когда накладываются друг на друга равновесия, протекающие с переносом протонов и электронов, следует учитывать, что вода при определенных условиях может участвовать в этих взаимодействиях не просто как инертный растворитель, а как полноправный участник химического процесса. Ранее указывалось на то, что в протолитических реакциях вода ведет себя как амфолит. В окислительно-восстановительных взаимодействиях воде также присуща двойственная роль: она может выступать и как окислитель
H2O + e– D 1/2H2(г) + OH–; E0 = - 0,83 B (39)
(или, в кислой среде,
2H+ + 2e– D H2),
и как восстановитель
H2O - 2e–1/2О2(г) + 2H+; E0 = + 1,23 B (40)
(или, в щелочной среде
2OH– - 2e– D 1/2O2(г) + H2O).
Как показывают уравнения этих полуреакций, обе они непосредственно зависят от кислотности cреды. Для полуреакции (39) эта связь имеет следующий вид:
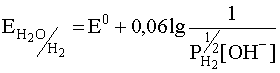 .
.
Здесь под знаком логарифма фигурирует парциальное давление газообразного водорода, которое, будучи величиной постоянной (см. 1.3.2.), входит в константу Е0. Тогда
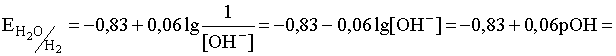 .
.
![]() .
.
![]() (41)
(41)
Для полуреакции (40):
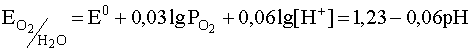 .
.
![]() (42)
(42)
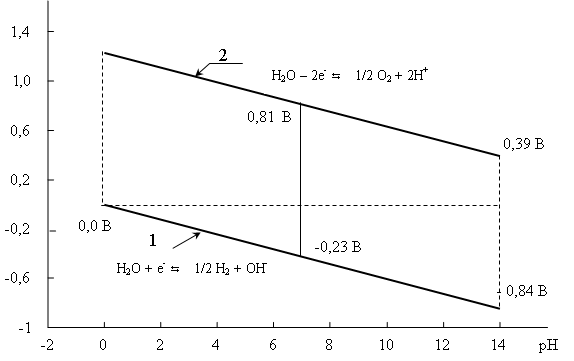
Построим график зависимости Е - рН для уравнений (41) и (42) в интервале значений рН от 0 до 14 (рис. 9).
Главный вывод, вытекающий из данной диаграммы, заключается в том, что для химии водных растворов доступна только область, ограниченная параллелограммом. Любая частица может существовать в водной среде только тогда, когда ее окислительно-восстановительный потенциал и значение рН раствора таковы, что эти параметры попадают в данную область. Для нейтральной cреды любая частица-окислитель, потенциал которой Е > 0,81 В, по отношению к воде является окислителем и подвергается восстановлению водой. Аналогично, любая частица-восстановитель, потенциал которой Е < - 0,42 В, должна водой окисляться, являясь по отношению к последней восстановителем.
 .
.
Рис. 9. Диаграмма термодинамической устойчивости воды в зависимости от рН
Этот важный вывод требует уточнений, так как иногда он входит в противоречие с реальностью.
В чистой воде (рН = 7) должны растворяться (окисляться) все металлы, если потенциал системы Men+/Me отрицательнее, чем - 0,42 В. На самом деле с водой непосредственно взаимодействуют только металлы, потенциал которых более отрицателен, чем таковой для магния . Сам магний медленно взаимодействует с водой только при кипячении. Другие же металлы, даже те, потенциал которых значительно отрицательнее - 0,42 В (например, Al (E0 = - 1,67 B), Mn (E0 = - 1,18 B) и другие) с водой не взаимодействуют. Это объясняется тем, что перенапряжение выделения водорода на этих металлах достаточно велико, а также тем, что в некоторых случаях (например, для алюминия) на поверхности металла формируется защитный слой оксида, что пассивирует металл.
Некоторые сильные окислители достаточно стабильны в водном растворе, хотя их потенциал лежит выше кривой 2 рисунка 10. Так, в нейтральной среде при одинаковых концентрациях [MnO4–] = [Mn2+] потенциал системы MnO4–/Mn2+ имеет значение E= E0 – 0,096pH = 1,51– 0,096×7 = 0,84B и, таким образом, выходит за пределы термодинамической устойчивости в растворе перманганат-иона. Учитывая, что в растворе перманганата калия практически отсутствуют катионы Mn2+ и по этой причине [MnO4–]>>[Mn2+], логарифмическое слагаемое в уравнении Нернста существенно увеличит значение потенциала этой системы и ион MnO4– должен окислять воду, сам при этом восстанавливаясь. Однако химикам известно, что водные растворы перманганата калия достаточно устойчивы и могут длительное время храниться в лаборатории без заметного разложения. Это связано с тем, что в данном случае ион MnO4– находится в метастабильном состоянии и его термодинамически возможное взаимодействие с водой не происходит в результате кинетических затруднений. Тем не менее известно, что со временем внутренняя поверхность сосудов, где хранится раствор перманганата калия, постепенно покрывается бурым налетом диоксида марганца, являющегося продуктом восстановления перманганат-иона водой. Чтобы замедлить этот процесс, растворы KMnO4 хранят в сосудах из темного стекла.
Аналогично ведут себя водные растворы некоторых других сильных окислителей, потенциал которых находится выше прямой (2). Так, пероксид водорода в кислой среде является очень сильным окислителем (Е0 =1,76 В), но разложение Н2О2 в водных растворах происходит очень медленно и эти растворы при соблюдении определенных предосторожностей (отсутствие примесей, играющих роль катализатора) могут храниться достаточно долго.
Практически с водой достаточно энергично взаимодействуют те вещества, потенциал которых выходит далеко за пределы кривых (1) и (2). Так, щелочные и щелочноземельные металлы (Ca, Sr, Ba, Ra) энергично взаимодействуют с водой, восстанавливая ее до газообразного водорода, так как соответствующие потенциалы систем Me+/Me и Me2+/Me имеют весьма отрицательные значения (лежат значительно ниже кривой (1). Напротив, свободный фтор энергично окисляет воду при любой кислотности cреды, так как потенциал системы F2/2F– (E0 = + 2,87 B) имеет исключительно высокое значение.
В заключение заметим, что при решении вопроса об устойчивости или неустойчивости того или иного соединения в водном растворе стандартными окислительно-восстановительными потенциалами, содержащимися в таблицах, следует пользоваться с большой осторожностью, так как по определению стандартный потенциал, если в уравнение Нернста соответствующей окислительно-восстановительной пары входит концентрация ионов водорода, применим для рН = 0, когда [H+] = 1 моль/л. Во всех других случаях необходимо решать этот вопрос на основании диаграмм Е- рН, называемых диаграммами Пурбэ. Это в особенности относится к тем случаям, когда, в зависимости от кислотности cреды, элемент проявляет большое разнообразие форм своего существования в различных степенях окисления. Особенно сложный характер – как в отношении окислительно-восстановительных, так и в отношении кислотно-основных равновесий - имеют эти диаграммы для d-элементов, расположенных в середине периодов, а также для p-элементов верхней части таблицы Д.И.Менделеева.
В качестве примера на рис.10 приведена диаграмма Пурбэ для соединений марганца. Диаграмма построена для растворов с исходной концентрацией по марганцу 10–2 моль/л. Для более концентрированных растворов вид диаграммы несколько изменяется.
 .
.
Рис. 10. Диаграмма Пурбэ для соединений марганца
Некоторые заключения, вытекающие из рассмотрения этой диаграммы, сводятся к следующему:
Катион Mn2+ может существовать в водном растворе только при рН<8,6. Выше этого значения образуется нерастворимый гидроксид Mn(OH)2. Поэтому полуреакция для системы Mn(II)/Mn(0) до указанного значения рН имеет вид Mn2+ + 2e– D Mn, а выше этого значения Mn(OH)2 + 2e– D Mn + 2OH–. Потенциал первой из этих полуреакций не зависит от рН, а второй – уменьшается с ростом щелочности cреды.
Манганат-анион MnO42– существует только в сильно щелочных средах (рН>14).
Окисляясь, Mn(II) почти при всех значениях рН склонен превращаться в MnO2.
Перманганат-анион MnO4– при своем восстановлении склонен превращаться в MnO2, но в достаточно концентрированных растворах и в сильно кислой среде он восстанавливается до Mn2+ (эта часть диаграммы выходит за пределы рис.10).
