
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
2.1.2 Осаждение и комплексообразование
В данном случае речь идет о наложении друг на друга двух типов равновесий – гетерогенного, устанавливающегося между твердой фазой (осадок) и насыщенным раствором, и гомогенного– между ионами комлексообразователя и добавляемыми в раствор лигандами.
Рассмотрим в качестве примера аммиачный комплекс серебра (I) [Ag(NH3)2]+, диссоциирующий в растворе в соответствии с уравнением:
[Ag(NH3)2]+↔Ag+ + 2NH3 (53)
с константой нестойкости
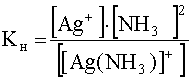 .
.
Если к раствору добавлять хлорид-ионы Cl-, то можно ожидать образования AgCl, который, будучи малорастворимым соединением, должен выпадать в осадок:
Ag+ + Cl- AgCl(т), (54)
и характеризуется произведением растворимости
ПР = [Ag+].[Cl-]
По мере увеличения концентрации ионов Cl-, равновесие (53) все более смещается вправо, поскольку уменьшается концентрация Ag+ за счет его перевода в твердую фазу в виде осадка AgCl(т). Это влечет за собой разрушение комплекса.
С другой стороны, если к осадку AgCl(т) добавлять аммиак, то равновесие (54) будет смещаться влево из-за уменьшения концентрации Ag+, вовлекаемого в комплексный ион, и при достаточной концентрации в растворе NH3 осадок должен полностью исчезнуть, а вместо него в растворе образуется [Ag(NH3)2]+. Данное явление описывается суммарным уравнением
[Ag(NH3)2]+ +Cl- AgCl(т) +2NH3, (55)
в котором прямое направление соответствует разрушению комплекса с переводом иона – комплексообразователя в осадок, а обратное – растворению осадка за счет комплексообразования.
Полнота протекания прямой реакции качественно характеризуется константой равновесия
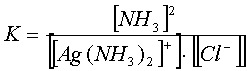 .
.
Разделим константу нестойкости комплекса Кн на произведение растворимости ПР:
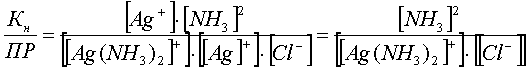 .
.
Полученное выражение есть не что иное, как константа равновесия рассматриваемой реакции, т.е.
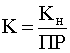 .
.
Данное соотношение позволяет сделать важный вывод: реакция разрушения комплекса в результате перевода комплексообразователя в осадок протекает тем полнее, чем менее устойчив комплекс (больше Кн) и менее растворим образующийся осадок (меньше ПР). Справедливо также и обратное утверждение.
Разумеется, этот вывод имеет общий характер.
Учитывая, что для рассмотренного примера Кн=10-7,2, а ПР=10-9,7, имеем
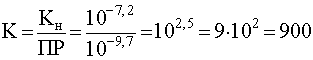 .
.
Достаточно большое численное значение константы равновесия говорит о том, что реакция (55) в принципе возможна.
Вычислим минимальную концентрацию иона-осадителя (Cl-), начиная с которой произойдет разрушение комплекса, т.е. станет преимущественным прямое направление реакции (55). Пусть имеем раствор, исходная концентрация комплекса (ск) в котором равна 10-2 моль/л. Поскольку рассматриваемый комплекс достаточно устойчив в водном растворе, можно считать, что его равновесная концентрация и исходная весьма близки, т.е. ![]() .
.
Равновесная концентрация свободных (не связанных в комплекс) ионов комплесообразователя может быть вычислена, исходя из выражения для константы нестойкости, в котором [Ag+] обозначим через х, а [NH3] через 2х, т.е.
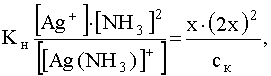 .
.
откуда
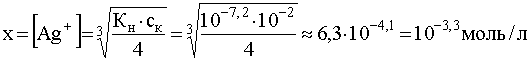 ..
..
Если теперь к раствору комплекса постепенно добавлять ион-осадитель, то разрушение комплекса начнется с того момента, когда концентрация Cl- станет такой, какая вытекает из произведения растворимости осадка. Учитывая, что ,![]() получим:
получим:
![]() ;
;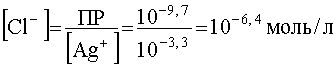 .
.
Такая низкая концентрация иона-осадителя указывает на то, что образование осадка и разрушение комплекса начнется практически сразу, как только в раствор стали добавлять ионы Cl-.
Теперь предположим, что к раствору комплекса, концентрация которого в растворе осталась прежней, добавлен избыток лиганда (NH3), концентрация которого, например, стала равной 1,0 моль/л. В этом случае равновесие (53) будут существенно смещено влево, что вызовет уменьшение концентрации свободных ионов Ag+, которая теперь станет равной:
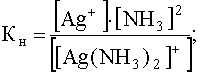
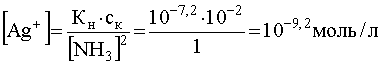 .
.
Тогда минимальная концентрация Cl-, необходимая для того, чтобы началось осаждение AgCl, станет равной
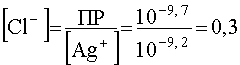 моль/л,
моль/л,
т.е. она сильно возросла вследствие стабилизации комплекса в присутствие избытка лиганда. Отсюда вытекает важный практический вывод: чтобы воспрепятствовать разрушению комплекса под воздействием иона - осадителя, необходимо создать в растворе достаточный избыток лиганда. Эта операция носит название маскировки комплексообразователя.
Рассмотрим обратное явление – растворение осадка в результате комплексообразования.
Пусть имеется осадок хлорида серебра (I) в равновесии с его насыщенным раствором.
Если к этому раствору постепенно добавлять аммиак, то равновесие (55) станет смещаться влево, осадок, по мере добавления лиганда будет растворяться вследствие образования комплекса [Ag(NH3)2]+. Пусть в результате полного растворения осадка концентрация комплекса в растворе стала равной 10-2 моль/л. Нетрудно рассчитать ту минимальную концентрацию лиганда, которую для этого нужно создать в растворе.
Как следует из уравнения (55), концентрации [Ag(NH3)2]+ и [Cl- ] при условии полного растворения AgCl, одинаковы и равны 10-2 моль/л. При этом, как следует из выражения для ПР,
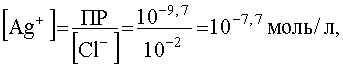 .
.
а из выражения Кн получим:
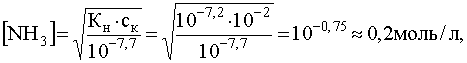 .
.
т.е. полное растворение осадка AgCl произойдет тогда, когда концентрация лиганда достигнет значения приблизительно 0,2моль/л.
Очевидно, что, чем меньше растворимость осадка, т.е. чем меньше его ПР, тем труднее этот осадок растворить, т.е. для этого потребуется более значительная концентрация добавляемого в раствор лиганда. Так, бромид серебра (I) менее растворим, чем хлорид:
![]() .
.
Аналогичный предыдущему расчет показывает, что для полного растворения AgBr добавлением NH3 минимальная концентрация последнего должна достигнуть значения 101,5=31,6 моль/л, что практически недостижимо.
