
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
2.1.3 Растворение осадков при избытке иона-осадителя
Это явление представляет собой частный случай рассмотренного выше.
Пусть имеется осадок хлорида серебра в равновесии с его насыщенным раствором. Если к системе постепенно добавлять хлорид-ионы, то произойдет растворение осадка вследствие образования хлоридного комплекса:
AgCl(т) + Cl- [AgCl2]-
Пренебрегая той незначительной частью хлорида серебра, которая находится в растворе в недиссоциированном состоянии, растворимость AgCl (S) можно представить как сумму концентраций серебра во всех его формах:
S = [Ag+] + [[AgCl2]-]
Вынеся за скобки концентрацию свободных катионов серебра [Ag+] и выразив ее через произведение растворимости хлорида серебра, получим:
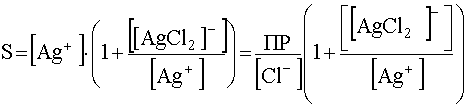 (56)
(56)
Учитывая, что константа нестойкости комплекса [[AgCl2]-] представляет собой
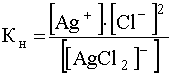 ,
,
выразим [[AgCl2]-] и подставим эту концентрацию в уравнение (56), в результате чего получим:
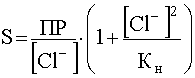 (57)
(57)
Уравнение (57) показывает, что с ростом концентрации [Cl-] растворимость AgCl сначала резко падает в результате действия эффекта одноименного иона, а потом возрастает, проходя через минимум. Положение этого минимума на кривой зависимости S=f([Cl-]) станет известным, если производную 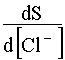 приравнять нулю:
приравнять нулю:
 .
.
Отсюда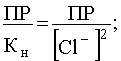
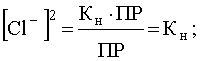
![]() .
.
Учитывая, что константа нестойкости комплекса [AgCl2]- равна ![]() найдем концентрацию ионов Cl-, при которой растворимость садка AgCl будет минимальной и при дальнейшем ее увеличении растворимость S начнет возрастать вследствие образования хлоридного комплекса [AgCl2]-:
найдем концентрацию ионов Cl-, при которой растворимость садка AgCl будет минимальной и при дальнейшем ее увеличении растворимость S начнет возрастать вследствие образования хлоридного комплекса [AgCl2]-:
![]() .
.
Ход кривой S = f([Cl-]) представлен на рис. 14
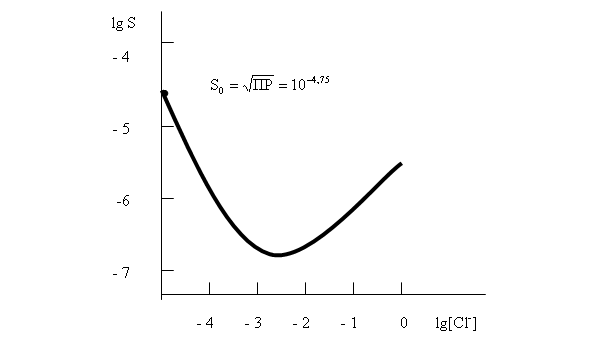 .
.
14 Зависимость растворимости S хлорида серебра от концентрации хлорид-ионов
Растворимость осадка в точке минимума может быть определена из уравнения (57), если в него подставить ![]() рассчитанную выше. Она приблизительно равна 10-7 моль/л.
рассчитанную выше. Она приблизительно равна 10-7 моль/л.
