
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
2.1.4 Осаждение и окислительно-восстановительные процессы
Если осаждению подвергаются соединения, способные участвовать в окислительно-восстановительных реакциях, то свойства окислительно-восстановительных систем часто претерпевают изменения.
Возьмем, к примеру, сопряженную окислительно-восстановительную пару [Fe(CN)6]3-/[Fe(CN)6]4-. Стандартный электродный потенциал этой пары составляет 0,36 В, что свидетельствует о том, что гексацианоферрат(III)-ион обладает весьма умеренной окислительной силой. Однако введение в систему, содержащую обе формы данной пары, ионов цинка существенно усиливает окислительные свойства ![]() . Это явление становится понятным, если учесть, что гексацианоферрат(II) цинка очень мало растворим в воде и выпадает в осадок, увлекая за собой из раствора ионы
. Это явление становится понятным, если учесть, что гексацианоферрат(II) цинка очень мало растворим в воде и выпадает в осадок, увлекая за собой из раствора ионы ![]() и, следовательно, уменьшая их концентрацию. В результате электродный потенциал рассматриваемойпары
и, следовательно, уменьшая их концентрацию. В результате электродный потенциал рассматриваемойпары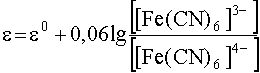 увеличивается за счет уменьшения знаменателя дроби, стоящей под знаком логарифма.
увеличивается за счет уменьшения знаменателя дроби, стоящей под знаком логарифма.
Если рассматривать металлические электроды Меn++ne![]() Me, то добавление в систему ионов, способных образовывать малорастворимые соединения с катионами
Me, то добавление в систему ионов, способных образовывать малорастворимые соединения с катионами ![]() , усиливает восстановительные свойства соответствующих свободных металлов, т.к. в этом случае электродный потенциал системы уменьшается и, следовательно, увеличивается восстановительная способность металла. Так, металлическое серебро, обычно представляющее собой очень слабый восстановитель, усиливает свою восстановительную способность, если в раствор вводить такие ионы, которые образуют с Ag+ малорастворимые соединения (Cl–, Br–, I–, CNS–и т.п.).
, усиливает восстановительные свойства соответствующих свободных металлов, т.к. в этом случае электродный потенциал системы уменьшается и, следовательно, увеличивается восстановительная способность металла. Так, металлическое серебро, обычно представляющее собой очень слабый восстановитель, усиливает свою восстановительную способность, если в раствор вводить такие ионы, которые образуют с Ag+ малорастворимые соединения (Cl–, Br–, I–, CNS–и т.п.).
В общем случае сила окислителя возрастает, если осаждать из раствора сопряженный с этим окислителем восстановитель, концентрация которого стоит в знаменателе логарифмического слагаемого уравнения Нернста. Сила восстановителя увеличивается тогда, когда осаждению подвергается сопряженный с этим восстановителем окислитель.
