
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

СОЕДИНЕНИЯ АЗОТА В БИОМЕДИЦИНСКИХ НАУКАХ
Колосов А. Е., Жданова О. Б., Мартусевич А. К., Ашихмин С. П.,
Глава IV. ОКСИД АЗОТА КАК МЕССЕНДЖЕР ЭФФЕКТА НЕКОТОРЫХ ТЕРАПЕВТИЧЕСКИХ ФИЗИКО-ХИМИЧЕСКИХ ВОЗДЕЙСТВИЙ
В настоящее время в лечебных целях все более активно применяются физико-химические факторы. Являясь прерогативой физиотерапии, сейчас они успешно демонстрируют свои возможности как полноценного дополнительного [1], а, в некоторых случаях – самостоятельного (фотодинамическая терапия, лазерная медицина, озоно-оксигенотерапия и др.), метода коррекции различных заболеваний и патологических состояний [2-6]. Несмотря на имеющую место в литературе дискуссию относительно эффективности применения данных технологий, последняя подтверждена, в частности, тридцатилетней историей экспериментально-клинического обоснования целесообразности применения озонотерапии при широком спектре патологии человека и животных [4, 7], и более чем десятилетней – для синглетно-кислородной терапии [6]. Исследования в области лазерных технологий уже прочно заняли свои позиции в медицине и биологии, результатом чего явились организация и успешное функционирование профильного научного центра, а также издание специализированного научного журнала.
Даже с учетом кажущегося полиморфизма молекулярных и клеточных эффектов, вызываемых действием данных факторов, четко установлено, что все они оказывают существенное корректирующее влияние на интенсивность процессов липопероксидации [2, 3, 5-9]. В свою очередь, окислительный стресс сейчас принято рассматривать как значимое патогенетическое звено различных патологических состояний [10-12]. Это дает основание предположить возможность стереотипности молекулярного ответа клеток и тканей н изучаемые физико-химические воздействия.
Ситуация с раскрытием молекулярных механизмов действия различных физико-химических агентов становится еще более затруднительной в свете революционного открытия роли оксида азота (II) [NO] как одного из наиболее важных меж- и внутриклеточных молекулярных мессенджеров [13, 14]. Следствием этого стало признание журналом «Science» NO «молекулой года» в 1992 г. и получение Р. Фурчготом, Л. Игнарро и Ф. Мурадом Нобелевской премии в области физиологии и медицины за выяснение роли оксида азота в функционировании живого организма. Следует отметить, что в последнее десятилетие число работ в данной отрасли науки растет лавинообразно [12-17]. Этими исследованиями было, в частности, показано, что NO определяет текущий тонус сосудов, ингибирует агрегацию тромбоцитов и их адгезию на стенках кровеносных сосудов, функционирует в центральной и вегетативной нервной системы, регулируя деятельность органов дыхания, желудочно-кишечного тракта и мочеполовой системы. Кроме того, данное соединение является нейротрансмиттером, а также принимает участие в регуляции системы иммунитета. В целом, NO – токсичный газ, способный выступать в биосистемах как свободный радикал, имеющий короткий период полужизни (4 с.) и легко подвергающийся различным химическим трансформациям, который непрерывно продуцируется в организме человека и животных ферментным и неферментным путями, оказывая ключевое воздействие на целый ряд принципиально различных физиологических и патологических процессов.
С этих позиций можно предположить, что результативное изменение продукции и биологической активности NO имеет место и при применении физико-химических воздействий. Поэтому целью данной работы является анализ потенциального участия оксида азота (II) как единого мессенджера эффекта терапевтических физико-химических факторов (озона, синглетного кислорода, лазерного и ультрафиолетового излучения и др.).
Прежде всего, логично привести краткую физико-химическую характеристику NO с акцентом на свойства, необходимые для понимания его физиологических и биохимических эффектов. Оксид азота (II) [NO] – бесцветный газ, умеренно растворимый в воде (1,9 мкМ при 25 °С), в водной среде легко окисляемый кислородом воздуха [13]. В связи с этим, сохранность растворов оксида азота некоторые авторы предлагают обеспечивать предварительной аэрацией из ультразвуком с последующим пропусканием через раствор, содержащий пирогаллол. В водных растворах в присутствии кислорода NO почти полностью превращается в нитрит-анион в процессе протекания следующих реакций [13]:
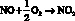 (1)
(1)
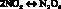 (2)
(2)
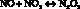 (3)
(3)
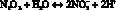 (4)
(4)
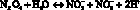 (5)
(5)
Показано, что в реальных жидкостях преобладают реакции 3 и 4 в сравнении с реакцией 5, вследствие этого образующиеся концентрации нитрат-иона невелики относительно концентрации нитрит-иона.
Свободнорадикальные свойства оксида азота проявляются в биологических и модельных системах в форме генерации пероксинитрита и гидроксил-анион радикала по следующей схеме:
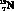
Относительно метаболизма NO сравнительно недавно В.П. Реутовым с соавт. (1998) и Е.Б. Меньшиковой с соавт. (2000) сформулирована оригинальная концепция, характеризующая синтез, деградацию и рециркуляцию соединения в организме млекопитающих в форме нового метаболического цикла – «цикла оксида азота» (рис. 4.1) [12, 18]. Следует отметить, что данный цикл является закономерным дополнением к уже хорошо изученным биохимическим циклам (Кребса, Кальвина, орнитиновому, люцифериновому и др.) и взаимосвязан с ними.

Рис. 4.1. Цикл оксида азота (по В.П. Реутову, 1998 [18])
По мнению указанных авторов, цикл оксида азота включает 2 компонента [18]:
а) NO-синтазные реакции, заключающиеся в трансформации L-аргинина в L-цитруллин и оксид азота, который далее окисляется до нитритов и нитратов.
б) Нитритредуктазная реакция, катализируемая электронодонорными системами с участием НАДН, НАДФН, флавопротеинов, дезоксигемоглобина и цитохрома Р450.
Одним из центральных компонентов данного цикла является фермент, обеспечивающий продукцию оксида азота – синтаза оксида азота (NO-синтаза, NOS) [19]. В настоящее время обнаружены 3 основных изоформы рассматриваемого энзима, 2 из которых – конститутивные, кальций/кальмодулин-зависимые, од-
на – индуцибельная. Краткая характеристика изоформ NO-синтазы представлена в табл. 4.1.
Таблица 4.1
Изоформы синтаз оксида азота (NOS) (по В.Г. Гранику, Н.Б. Григорьеву, 2004 [13])
|
Тип NOS (молекулярная масса |
Альтернативные |
Распределение |
Тип активации |
|
NOS-I (155 kDa) |
Нейрональная NOS (nNOS), |
Нейроны центральной и периферической нервной системы, матка, скелетная мускулатура |
Конститутивная форма, |
|
NOS-II (125 kDa) |
Индуцибельная NOS (iNOS) |
Макрофаги, печень, гладкая мускулатура, эндотелий, сердце |
Индуцируется липополисахаридами, цитокинами и глюкокортикоидами, кальций/кальмодулин-независимая |
|
NOS-III (133 kDa) |
Эндотелиальная NOS (eNOS) |
Эндотелий, сердце, мозг |
Конститутивная форма, |
Несмотря на то, что сейчас обнаружены многочисленные эффекты оксида азота в отношении регуляции состояния биологических систем, наибольшее клинико-патофизиологическое значение имеет вазодилататорное действие NO [20, 21]. Механизм данного эффекта изучен достаточно подробно, и в общем виде может быть представлен в виде схемы (рис. 4.2). Соединение, синтезируемое конститутивными изоформами NO-синтазы в эндотелии и нервной системе, взаимодействуя с гуанилатциклазой и трансформируя ее пространственное строение, запускает синтез цГТФ, а через него – каскад других ферментных систем, результатом чего и является вазодилатация [17, 22].
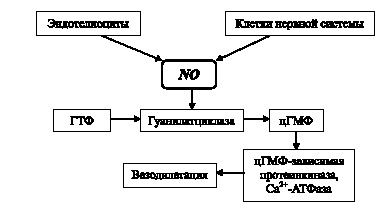
Рис. 4.2. Схема генерации и вазодилаторного действия оксида азота (по В.Г. Гранику, Н.Б. Григорьеву, 2004 [13], с изменениями)
Открытие данного механизма способствовало стимуляции исследований в области обнаружения способов увеличения продукции оксида азота соответствующей синтазой, что обусловлено многочисленностью патологии, сопровождающейся нарушением тонуса сосудов по спазматическому типу. В частности, заманчивой целью подобной коррекции являются артериальная гипертензия различного генеза, ишемическая болезнь сердца, инсульт и др. Наиболее простым и логичным подходом к решению данной проблемы с позиций патофизиологии и биохимии служит экзогенное введение субстрата для NO-синтазы – L-аргинина [12, 13, 23]. Однако последующими работами было показано, что, во-первых, период полужизни оксида азота крайне мал [8, 23], а увеличение темпов депонирования соединения (как в форме S-нитротиолов, так и комплексов железа) затруднительно; во-вторых, избыток NO может по принципу обратной связи ингибировать собственную синтазу [13] и, в-третьих, высокая концентрация L-аргинина способствует изменению превалирующего продукта реакции на супероксид-анион радикал, обладающий, в частности, мембраноповреждающим действием [16, 24, 25]. Именно последнее обстоятельство реализуется в случае цитотоксического эффекта NO, когда в результате уже описанной реакции при взаимодействии продуктов функционирования NO-синтазы образуется пероксинитрит, в отсутствии или недостаточной концентрации/активности молекул-гасителей (супероксиддисмутаза, восстановленный глутатион и др.) вызывающий повреждение соприкасающихся с ним клеточных элементов, прежде всего, биомембран [13, 23]. В целом, наряду с позитивными эффектами у NO как свободного радикала присутствует и токсическое действие, проявляющееся только в определенных условиях (рис. 4.3). В связи с этим, следует подчеркнуть, что для адекватного функционирования организма имеет место оптимальный уровень синтеза оксида азота, а его отклонения (в любую сторону), ведут к негативным последствиям [25].
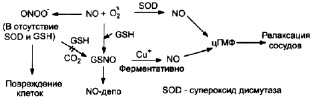
Рис. 4.3. Комплекс позитивных и негативных молекулярно-клеточных эффектов NO [13]
Совокупность свойств и убиквитарность оксида азота как низкомолекулярного регулятора физиологических и патологических процессов указывают на потенциальную многочисленность механизмов, звеном которых является данное соединение. Это касается и внешних воздействий. Так, одним из механизмов реализации саногенетического эффекта многих лекарственных препаратов, как было установлено в последнее десятилетие, служит модуляция синтеза NO, причем подобное действие обнаружено и для целого ряда известных и давно применяемых в медицине и ветеринарии лекарственных средств (нитроглицерин, нитропруссид натрия, изосорбид мононитрат, пропранолол) [13, 14, 19, 26]. Данные препараты, являясь донорами NO, запускают соответствующий каскад его эффектов, оказывая необходимое клиническое (прежде всего – антиангинальное) действие [27, 28]. Учитывая этот аспект действия лекарств с подобной химической структурой, разрабатываются средства, комбинирующие NO-донорные свойства и способность выступать в качестве лигандов к рецепторам [29].
Например, известный препарат небиволол сочетает в себе
NO-донорный и ?1-адреноблокирующий эффекты [30].
Другие интересные варианты сочетанных эффектов лекарственных средств включают комбинацию NO-донорных свойств и характеристик нестероидного противовоспалительного препарата [13, 31]. К ряду таких лекарств, в частности, относится мелоксикам [32, 33]. Эти «гибридные» молекулы способны предотвратить гастропатию, обусловленную длительным приемом неселективных блокаторов циклооксигеназы. Таким образом, различные экзогенные соединения при введении в организм обладают модулирующим действием в отношении оксида азота.
В то же время эти исследования практически исключительно касаются фармакологических препаратов, тогда как физико-химические факторы, существенно изменяющие многие параметры клеточного гомеостаза, характеристики биологических жидкостей и функциональное состояние органов и тканей, как модуляторы генерации оксида азота практически не рассматривались. Упоминание о подобном эффекторном каскаде приводится лишь в единичных работах по применению генераторов синглетного кислорода [8, 34]. Кроме того, предполагается, что применение экзогенного NO также стимулирует и эндогенный синтез данного соединения [13].
Принцип молекулярных мишеней в отношении действия физических факторов наиболее полно изучен и представлен для фотодинамической терапии, однако синглетный кислород является не единственной мишенью, т.к. в процессе фотохимических реакций образуется не только он, но и другие активные биорадикалы [5, 23]. Сходные внутриклеточные процессы наблюдаются при действии ультрафиолетового и лазерного излучения на биологические объекты, хотя каждое из данных воздействий имеет особенности реализации эффекта [3, 9].
С другой стороны, многие методы лечения, основанные на действии физико-химических факторов, традиционно рассматриваются с позиций самостоятельного эффекта их действующего начала [35-38]. Так, биологическая активность озона достаточно подробно изучена и положена в основу тактики применения озонотерапии при различных патологических состояниях [4, 39, 40], тогда как в этом случае результирующее действие связано с совокупностью образующихся активных форм кислорода и озона. Одним из косвенных доказательств связи озона и метаболизма оксида азота является то, что только в присутствии окислителей (перекись водорода, кислород, озон и др. [24]) реакция NO с тиолами приводит к образованию S-нитрозотиолов – известных молекулярных депо оксида азота [20, 41].
Учитывая вышеперечисленные факты, можно предположить, что оксид азота способен выступать в качестве единого молекулярного интермедиата, реализующего на клеточном уровне эффекты действия различных физико-химических факторов (рис. 4.4). Есть основания причислять к спектру данных воздействий озонотерапию, синглетно-кислородную терапию, фотодинамическую терапию, применение ультрафиолетового и лазерного излучения, местную дарсонвализацию, а также непосредственно NO-терапию. Важно подчеркнуть, что большинство из перечисленных воздействий опосредует эффект через дополнительные промежуточные звенья, среди которых особое место занимает эндогенный синглетный кислород [8, 34, 42]. Кроме того, принимая в расчет нестабильность оксида азота, в рамках предлагаемой концепции предполагается, что рассматриваемые факторы влияют и на процессы депонирования и высвобождения NO, на что, в частности, указывает роль окислителей в формировании S-нитротиолов [13, 20, 41, 43].
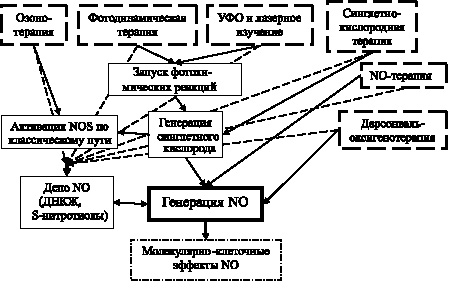
Рис. 4.4. Гипотетическая схема реализации молекулярной стереотипии в действии физико-химических факторов на биосистемы
В целом, имеющиеся данные позволяют сформулировать гипотезу о молекулярной стереотипии в реализации эффекта физико-химических факторов в отношении биологических систем, базирующуюся на универсальной мессенджерской функции оксида азота. Следует подчеркнуть, что для верификации приведенной гипотезы требуется проведение целенаправленных изысканий, ориентированных на уточнение компонентов данного молекулярного каскада и характера их взаимодействий.