
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
2.3.1 Общие сведения об экстракции
Предположим, что имеется система из двух несмешивающихся друг с другом жидкостей и некоторое вещество А, в разной степени растворимое как в одной жидкости, так и в другой. Вещество А распределяется между этими двумя растворителями и устанавливается равновесие
Арастворитель1![]() Арастворитель2
Арастворитель2
Наиболее важным и интересным случаем является тот, когда одним из растворителей является вода, а в качестве другого выступает какой-либо органический растворитель, не смешивающийся с водой
А(в) ![]() А(р) (67)
А(р) (67)
Здесь слева обозначена та доля вещества А, которая находится в водном слое, а справа – та его часть, которая содержится в органическом растворителе.
Если растворимость вещества А в воде больше, чем его растворимость в органическом растворителе, то равновесие (67) в бóльшей степени смещено влево, если же А лучше растворяется в органическом растворителе – вправо.
На различной растворимости веществ в двух находящихся в контакте и не смешивающихся друг с другом растворителях основан один из важных методов разделения веществ – экстракция. Физическая сущность экстракции состоит в том, что извлекаемое (экстрагируемое) вещество А переходит из одной жидкой фазы в другую – в ту, где это вещество лучше растворимо.
Применяя к равновесию (67) закон действующих масс, напишем выражение константы равновесия:
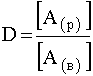 (68)
(68)
В данном случае эта константа называется коэффициентом распределения вещества А между органическим растворителем и водой, который количественно характеризует степень извлечения вещества А из одной жидкой фазы в другую: если вещество лучше растворимо в воде, то D <1, если в органическом растворителе– то D>1.
Примером рассматриваемой системы может служить распределение иода I2 между водным слоем и органическим: иод растворим в воде и его водный раствор имеет бурую окраску. Если к раствору прилить какой-либо органический растворитель, не смешивающийся с водой (например, CCl4) и энергично взболтать, то после расслоения двух жидких фаз обнаруживается, что органический слой окрасился в фиолетовый цвет. Таким образом произошла экстракция иода из воды в органический растворитель, играющий роль экстрагента. Для данного случая
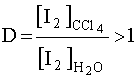 .
.
Если имеем трехфазную систему, включающую твердую фазу (осадок малорастворимого вещества) и две жидкие фазы (водный слой и органический), то оба растворителя – и вода, и органический растворитель – будут насыщены по отношению к веществу А, и тогда в выражении для коэффициента распределения фигурируют не концентрации вещества, а его растворимость:
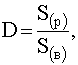 .
.
где![]() – растворимость вещества А в органическом растворителе;
– растворимость вещества А в органическом растворителе;
![]() – растворимость его в воде.
– растворимость его в воде.
Чаще всего используют инертные органические растворители, имеющие малую диэлектрическую постоянную. В этом случае в водном слое неорганические вещества присутствуют в виде ионов, а в органическом – в виде недиссоциированных молекул.
Следует заметить, что добавление органического растворителя к водному раствору часто вызывает исчезновение (или, по крайней мере, уменьшение концентрации) некоторых веществ, находившихся до этого в водном слое. Это, в свою очередь, оказывает существенное влияние на обычные равновесия, устанавливающиеся в водном растворе: кислотно-основные, комплексообразование, окислительно-восстановительные. Но возможно и обратное влияние: если тем или иным способом воздействовать на ионные равновесия в водном растворе, то это может оказывать существенное влияние на состояние равновесия распределения (67).
