
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

РАК ЩИТОВИДНОЙ ЖЕЛЕЗЫ: ПАТОФИЗИОЛОГИЧЕСКИЕ И КЛИНИЧЕСКИЕ АСПЕКТЫ
Чеснокова Н П, Зяблов Е В, Селезнева Т Д,
Раздел II. ЗАКОНОМЕРНОСТИ РАЗВИТИЯ СИСТЕМНЫХ ПАРАНЕОПЛАСТИЧЕСКИХ РАССТРОЙСТВ ПРИ ПАПИЛЛЯРНОЙ И ФОЛЛИКУЛЯРНОЙ ФОРМАХ РАКА ЩИТОВИДНОЙ ЖЕЛЕЗЫ, ИХ ДИАГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ
До настоящего момента чрезвычайно ограничены сведения относительно характера и механизмов развития паранеопластических расстройств, ограничивающих или, наоборот, способствующих опухолевой прогрессии, в частности, метастазированию трансформированных клеток. Комплексные исследования в этом направлении, начатые в 90-х годах в городе Саратове и продолжающиеся по настоящее время на базе НУЗ «Дорожная клиническая больница на ст. Саратов-II» ОАО «РЖД», позволили впервые сформулировать новые закономерности патогенеза рака щитовидной железы.
В настоящее время четко определена точка зрения о том, что в последовательном развитии стадий канцерогенеза – инициации, промоции и опухолевой прогрессии – важная роль должна быть отведена не только молекулярно-клеточным механизмам онкогенной трансформации клеток, но и системным паранеопластическим изменениям, в частности, активации процессов липопероксидации, недостаточности антирадикальной защиты клеток различной морфофункциональной организации, развитию иммунодефицитных состояний, расстройствам гормонального баланса и цитокинового статуса.
Комплексное обследование больных фолликулярной формой РЩЖ позволило впервые выявить закономерности системных паранеопластических расстройств, характерные для начальных стадий заболевания (I–II стадии) и метастатических форм патологии (III–IV стадии), в частности, характера динамических сдвигов клеточного состава периферической крови, метаболического, иммунного, цитокинового статусов, гормонального баланса при фолликулярной и папиллярной формах РЩЖ.
Касаясь изменений клеточного состава и ряда метаболических показателей периферической крови при фолликулярной форме РЩЖ, следует отметить, что развитие I–II стадий заболевания характеризуется появлением лимфопении, гипогликемии. В то же время не возникает изменений со стороны других форменных элементов белой и красной крови, а также ряда метаболических показателей крови – белкового спектра, уровня мочевины, общего содержания билирубина, электролитов: натрия, калия, кальция.
По мере распространения фолликулярной формы неоплазии щитовидной железы (III–IV стадии) лимфопения прогрессирует. При этом возникает сдвиг лейкоцитарной формулы влево, развиваются моноцитопения, эозинофилия, тромбоцитопения, ускорение СОЭ. Усугубляются и системные метаболические расстройства в виде прогрессирующей гипогликемии, развития гипоальбуминемии, гиперглобулинемии.
При папиллярной форме РЩЖ на I–II стадиях развития неоплазии имеют место выраженные лимфопения и гипогликемия. Другие метаболические показатели и показатели клеточного состава крови не изменяются по отношению к таковым группам контроля.
Таким образом, установленные закономерности формирования системных паранеопластических расстройств в виде лимфопении и гипогликемии имеют место уже на начальных стадиях распространения неоплазии при фолликулярной и папиллярной формах РЩЖ.
Механизмы развития указанных сдвигов очевидны: с одной стороны в связи с биохимическим атипизмом, при этом пролифирирующие малигнизированные клетки являются «ловушкой» для глюкозы, а с другой – выброс гормонов адаптации (адренокортикотропного гормона и глюкокортикоидов) вызывает развитие апоптоза и лизиса лимфоидной ткани.
Аналогичные закономерности изменений клеточного состава периферической крови и ряда интегративных показателей метаболического статуса выявляются и на метастатических стадиях (III–IV стадии) папиллярной формы РЩЖ. Об этом свидетельствуют прогрессирующая лимфопения, сдвиг лейкоцитарной формулы влево, моноцитопения, незначительная эозинофилия, тромбоцитопения, ускорение СОЭ. Показатели содержания в крови эритроцитов и гемоглобина остаются стабильными в пределах нормы на различных стадиях распространения неоплазии при фолликулярной и папиллярной формах РЩЖ.
Резюмируя вышеизложенное, следует заключить, что развитие стадии метастазирования при дифференцированных формах РЩЖ закономерно сочетается с системными паранеопластическими расстройствами в виде гипогликемии, гипоальбуминемии, гиперглобулинемии, а также сдвигами со стороны клеточного состава периферической крови в виде лимфопении, моноцитопении, тромбоцитопении, ускорения СОЭ. Комплексное определение указанных показателей может быть использовано в качестве дополнительных объективных критериев диагностики стадии метастазирования неоплазии при папиллярной и фолликулярной формах РЩЖ, когда использование традиционных методов обследования недостаточно для оценки степени распространения неоплазии, особенно при «латентной» форме РЩЖ.
В настоящее время, очевидно, что ведущими патогенетическими факторами развития паранеопластических расстройств при фолликулярной и папиллярной формах РЩЖ являются аутоинтоксикация, системная активация процессов свободнорадикальной дестабилизации биомембран клеток различной морфофункциональной организации, на что указывает прогрессирующее по мере распространения неоплазии увеличение содержания в крови промежуточных продуктов липопероксидации: ДК и МДА, а также МСМ. Дезорганизация липидных компонентов мембран клеток обусловлена недостаточностью ферментного и неферментного звеньев антиоксидантной системы крови, снижением активности супероксиддисмутазы и содержания витамина Е в крови.
Как известно, свободные радикалы являются неизменными спутниками разнообразных внутриклеточных и внеклеточных метаболических процессов в условиях нормы и патологии.
Адекватное образование свободных радикалов в условиях нормы обеспечивает стабильность структуры ядра, биологических мембран клеток, их рецепторного аппарата, сохранность функциональной активности клеток и процессов их контактного взаимодействия.
Источником образования свободных радикалов являются окислительно-восстановительные реакции в митохондриях, монооксигеназные реакции в эндоплазматическом ретикулуме, а также в метаболических системах, содержащих металлы переменной валентности, в процессах фагоцитоза, метаболизма катехоламинов, взаимопревращений простагландинов.
Как известно, к числу первичных свободных радикалов относят супероксид, интроксид, убихинон.
Взаимодействие первичных радикалов и других веществ с металлами переменной валентности (прежде всего с железом) приводит к образованию вторичных радикалов – гидроксила и липидных радикалов, обладающих выраженным деструктивным действием на клетки в ситуациях избыточного накопления их в крови и тканях.
Высокая реактогенность свободных радикалов, способность к дезорганизации структур клеток различной морфофункциональной принадлежности обусловлены их свойством выступать в роли мощных окислителей, захватывающих недостающий на их внешней орбитали электрон от липидных компонентов мембран клеток и субклеточных фракций, SH-групп стромальных и ферментных белков, нуклеиновых кислот и других соединений.
Свободные радикалы – короткоживущие в биологических системах молекулы, поэтому их определение чрезвычайно затруднено. В связи с этим очевиден тот факт, что в большинстве исследований в целях оценки состояния свободнорадикальной дезорганизации биологических мембран клеток определяют содержание в крови и тканях продуктов липопероксидации – ДК и МДА. В последние годы появился ряд сообщений о роли свободных радикалов в механизмах онкогенной трансформации клеток, развитии опухолевой прогрессии, в частности, в процессах метастазирования при неоплазиях различной локализации.
Установлено, что уже на ранних стадиях фолликулярной формы РЩЖ (I–II стадии заболевания) возникает избыточное накопление в крови ДК и МДА, прогрессирующее на стадиях метастазирования неоплазии (III–IV стадии заболевания) (рис. 5).
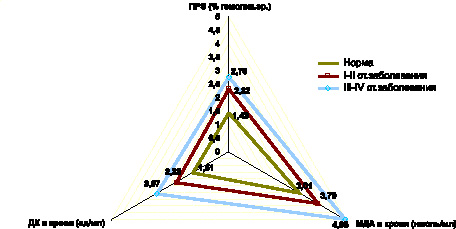
Рис. 5. Показатели содержания промежуточных продуктов липопероксидации и перекисной резистентности эритроцитов в крови при фолликулярной форме РЩЖ на I-II и III-IV стадиях распространения неоплазии
Одновременно обнаружено и возрастающее по мере распространения неоплазии содержание в крови МСМ – интегративного показателя аутоинтоксикации (рис. 6).
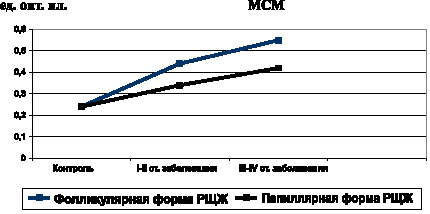
Рис. 6. Показатели уровня МСМ при фолликулярной и папиллярной формах РЩЖ на I-II и III-IV стадиях неоплазии
Установлено, что одним из патогенетических факторов активации процессов липопероксидации при фолликулярной форме РЩЖ явилась недостаточность ферментного и неферментного звеньев антиоксидантной системы крови, на что указывало снижение активности СОД, уровня витамина Е в крови и ПРЭ (рис. 7).
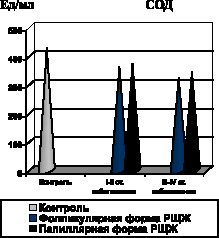
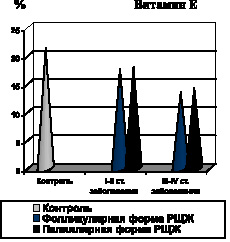
Рис. 7. Показатели содержания в крови СОД и витамина Е при фолликулярной и папиллярной формах РЩЖ на I-II и III-IV стадиях распространения неоплазии
Аналогичная закономерность системной активации процессов липопероксидации на фоне недостаточности антиоксидантной системы крови выявлена и при папиллярной форме РЩЖ. Уже на ранних стадиях развития неоплазии имеет место возрастание содержания в крови МДА, ДК, МСМ, снижение содержания витамина Е и ПРЭ, а также падение активности СОД (рис. 6, 7, 8).
По мере распространения папиллярной формы РЩЖ (III–IV стадии заболевания), активность СОД остается стабильно низкой, а содержание витамина Е в крови достигает минимальных значений (рис. 7).
Таким образом, в процессе сравнительной оценки метаболического статуса при фолликулярной и папиллярной формах РЩЖ была обнаружена еще одна закономерность развития паранеопластических метаболических расстройств, неизменно сопутствующих формированию дифференцированных форм неоплазии в щитовидной железе и прогрессирующих по мере развития метастатических стадий патологии – активации процессов липопероксидации на фоне недостаточности антиоксидантной системы крови.
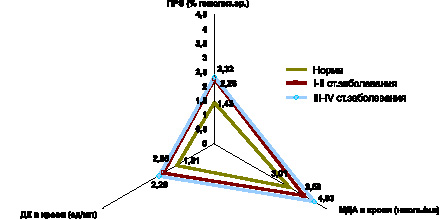
Рис. 8. Показатели содержания промежуточных продуктов липопероксидации и перекисной резистентности эритроцитов в крови при папиллярной форме РЩЖ на I-II и III-IV стадиях распространения неоплазии
Касаясь функциональной значимости обнаруженных нами нарушений метаболического статуса при РЩЖ, следует отметить, что одну из первых линий защиты клеток от агрессивного действия свободных радикалов обеспечивают ферменты – СОД и каталаза.
Различаясь по структуре активного центра и полипептидной цепи, все СОД (металлоферменты) катализируют одну и ту же реакцию дисмутации: .ОО.+ .ОО.+2Н+ О2+НООН. Образующаяся в процессе этой реакции перекись водорода разрушается до Н2О2 и О2 при участии каталазы, активность которой высока в эритроцитах, печени, почках.
Как показали проведенные нами исследования, активность каталазы крови остается стабильной в пределах нормы и на ранних, и на поздних стадиях развития РЩЖ, в то время как активность СОД резко снижается, особенно при метастатических формах неоплазии.
Как известно, в условиях нормы СОД ускоряет спонтанную реакцию дисмутации супероксиданион-радикала в 200 раз. Естественно, что подавление активности СОД является ведущим патогенетическим фактором накопления активной формы кислорода-супероксиданион-радикала.
Установлено, что действие ферментных антиоксидантов в целостном организме дополняется естественными антиоксидантами, среди которых витаминами группы Е, А, К, Р, стероидными гормонами и другими соединениями. Витамин Е относится к категории жирорастворимых биоантиоксидантов, защищает от свободнорадикальной дестабилизации биологических мембран, в частности, цитоплазматические, митохондриальные, лизосомальные. Обнаруженный нами дефицит витамина Е-ловушки свободных радикалов, является одним из патогенетических факторов развития цитолиза.
Дефицит антиоксидантов и мембранопротекторов при папиллярной и фолликулярной формах РЩЖ проявляется и снижением ПРЭ, коррелирующим со стадией распространения неоплазии.
Таким образом, недостаточность антиоксидантной системы крови приводит к образованию избыточных концентраций активных форм кислорода, индуцирующих процессы липопероксидации биологических мембран с последующим образованием еще большего количества вторичных свободных радикалов при окислении полиненасыщенных жирных кислот. Накопление в гидрофобном слое мембран клеток гидрофильных группировок ROOH вызывает нарушение пассивной трансмембранной диффузии различных соединений.
Цитопатогенные эффекты свободных радикалов связаны не только с активацией процессов липопероксидации биомембран клеток, но и с окислительной модификацией структурных и ферментных белков.
Так, при взаимодействии супероксиданион-радикала с белками клетки и внеклеточной среды образуются в значительном количестве низкомолекулярные фрагменты с молекулярной массой около 5000 Д. Подтверждением этого положения является обнаруженная нами закономерность прогрессирующего увеличения содержания МСМ в крови пациентов с фолликулярной и папиллярной формами РЩЖ.
Резюмируя приведенные выше данные в целом, следует заключить, что индукция образования свободных радикалов в клетках может служить промотором модификации структуры ДНК, малигнизации клеток, формирования инициации клеток и опухолевой прогрессии.
Объективными метаболическими критериями опухолевой прогрессии, в частности, метастазирования трансформированных клеток при фолликулярной и папиллярной формах РЩЖ, являются увеличение содержания в крови ПРЭ, МДА, ДК, МСМ, снижение активности СОД и уровня витамина Е в крови.
В соответствии с современными концепциями канцерогенеза о механизмах и стадийности развития неоплазий различной локализации очевидно, что возникновение онкогенной трансформации, индуцируемой различными канцерогенами экзогенной или эндогенной природы, не означает еще формирования онкологического заболевания.
Малигнизированные клетки подвергаются постоянной элиминации за счет специфических и неспецифических антицеллюлярных механизмов защиты, в частности, аллогенного торможения, кейлонного ингибирования канцеролиза, при участии макрофагов, системы комплемента, активных форм кислорода. Немаловажная роль в подавлении процессов опухолевой прогрессии отводится состоянию иммунологических механизмов защиты, обеспечивающих антителозависимый фагоцитоз, комплемент – зависимый цитолиз опухолевых клеток, антителозависимую токсичность NK-лимфоцитов, а также CD8-лимфоцитов.
В настоящее время очевидно, что в стадии промоции и опухолевой прогрессии при фолликулярной и папиллярной формах РЩЖ важная роль отводится В- и Т-зависимым иммунодефицитным состояниям.
Установлено, что на начальных стадиях развития фолликулярной и папиллярной форм РЩЖ не возникает сколько-нибудь выраженных изменений со стороны гуморального звена иммунитета: остаются в пределах нормы содержание в крови иммуноглобулинов классов G, A, M.
В то же время при развитии I–II стадий фолликулярной формы РЩЖ имеет место снижение уровня CD4-Т-лимфоцитов, CD16-лимфоцитов (рис. 9). В группе пациентов с папиллярной формой РЩЖ при I–II стадиях распространения неоплазии не обнаружено сколько-нибудь выраженных сдвигов представительства в крови CD3-Т-лимфоцитов, как и при фолликулярной форме патологии. Между тем количество CD16-лимфоцитов заметно снижается. Лишь на метастатических стадиях неоплазии также отмечено снижение содержания в крови CD3- и CD4-Т-лимфоцитов, выраженное, однако, в меньшей степени, чем при фолликулярной форме РЩЖ. Одновременно имеет место снижение уровня CD8-Т-лимфоцитов и CD16-лимфоцитов, выраженное в такой же степени, как и при фолликулярной форме РЩЖ (рис. 10).
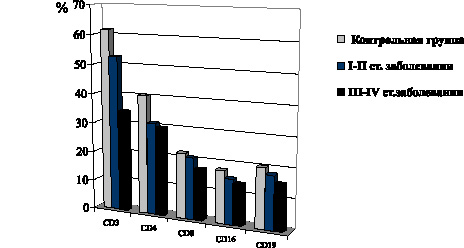
Рис. 9. Показатели содержания в крови отдельных субпопуляций Т-лимфоцитов и CD19-В-лимфоцитов у больных фолликулярной формой РЩЖ на I–II и III–IV стадиях распространения неоплазии
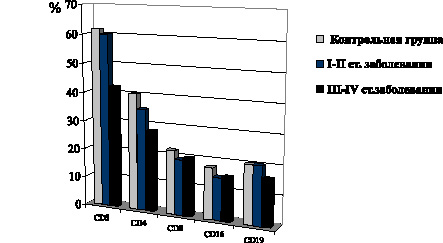
Рис. 10. Показатели содержания в крови отдельных субпопуляций Т–лимфоцитов и CD19–В–лимфоцитов у больных папиллярной формой РЩЖ на I–II и III–IV стадиях распространения неоплазии
Аналогичные изменения клеточного звена иммунитета на ранних стадиях распространения злокачественного новообразования отмечены и при раке прямой кишки, раке молочной железы, при первично-множественном синхронном раке молочной железы. Однако при указанных выше онкологических заболеваниях недостаточность клеточного звена иммунитета сочетается с выраженным падением содержания иммуноглобулинов классов G, A, M уже на начальных стадиях развития неоплазии.
Таким образом, одной из особенностей иммунодефицитного состояния при дифференцированных формах РЩЖ является недостаточность клеточного звена в виде снижения содержания в крови CD4-Т-лимфоцитов, CD16-лимфоцитов, формирующаяся уже на ранних стадиях опухолевого процесса и опережающая развитие недостаточности гуморального звена иммунных реакций.
Касаясь значимости изменений иммунного статуса следует отметить, что CD16-лимфоциты не несут маркерных молекул Т- и В-систем лимфоцитов, дифференцируются из общей клетки – предшественника Т- и В-лимфоцитов. В их мембранах отсутствует антигенспецифический рецептор. Однако есть рецепторы для Fc-фрагмента иммуноглобулинов. В связи с этим NK-клетки обеспечивают антигензависимую цитотоксичность. Аналогичная цитотоксичность может обеспечиваться нейтрофильными лейкоцитами, моноцитами, эозинофилами. Клеточный состав белой крови на I–II стадиях распространения фолликулярной и папиллярной форм РЩЖ, за исключением содержания лимфоцитов, не изменяется. Остается в пределах нормы и содержание иммуноглобулинов в крови, что свидетельствует в целом о достаточной антителозависимой цитотоксичности, обеспечиваемой фагоцитами.
Проведенная далее оценка иммунного статуса на метастатических стадиях РЩЖ (III–IV стадии) позволила выявить общие закономерности качественных и количественных изменений со стороны иммунной системы при дифференцированных формах РЩЖ. При фолликулярной форме заболевания имеет место выраженное прогрессирующее снижение представительства в крови CD4-Т-лимфоцитов. В то же время резко снижается уровень CD3-Т-лимфоцитов, уменьшается содержание CD8-Т-лимфоцитов, а уровень CD16–лимфоцитов остается стабильно низким.
При папиллярной форме РЩЖ на метастатических стадиях неоплазии также отмечается снижение содержания в крови CD3- и CD4-Т-лимфоцитов, выраженное, однако, в меньшей степени, чем при фолликулярной форме РЩЖ. Одновременно имеет место снижение уровня CD8-Т-лимфоцитов и CD16-лимфоцитов, выраженное в такой же степени, как и при фолликулярной форме РЩЖ.
Следует отметить, что снижение уровня NK-клеток в крови при развитии РЩЖ сочетается и с ослаблением антителозависимой цитотоксичности этих клеток.
Как известно, характерной особенностью клеток микроокружения опухоли является активация гликолитических реакций, протеолиза и соответственно развитие ацидотических сдвигов. В то же время установлено, что повышенная кислотность снижает pH-зависимую функцию ряда эффекторных клеток, в частности, NK-лимфоцитов, Т-лимфоцитов, антигенпрезентирующих клеток за счет усиления экспрессии HLA-G антигенов опухолевыми клетками.
Установлено, что на поздних стадиях развития неоплазии при папиллярной и фолликулярной формах РЩЖ формируется В-зависимый иммунодефицит, характеризующийся снижением субпопуляционного представительства в крови CD19-В-лимфоцитов, а также уровня иммуноглобулинов классов G, A, M.
Остается спорным вопрос о роли В-системы лимфоцитов в механизмах канцерогенеза. Антитела играют неоднозначную роль в развитии неоплазии. В ряде случаев возможно появление ростстимулирующих антител против онкоантигенов. Ряд антител, не обеспечивая разрушения опухолевых клеток, может экранировать опухолевые антигены и блокировать цитотоксические эффекты макрофагов, NK-клеток, CD8-T-лимфоцитов.
Тем не менее, очевидно, что снижение уровня IgG – основного класса иммуноглобулинов с высокой аффинностью к антигенам-аллергенам, обеспечивающим развитие противобактериального, антитоксического иммунитета, цитолитических комплементопосредованных реакций, свидетельствует о подавлении не только противоопухолевой, но и противоинфекционной защиты организма.
Снижение уровня IgM в крови, обеспечивающих первую линию защиты против клеток, несущих генетически чужеродную информацию, а также падение содержания в крови IgA, формирующих противовирусную и противобактериальную защиту слизистых оболочек, являются факторами риска развития инфекционных заболеваний у онкологических больных.
Резюмируя вышеизложенное, следует заключить, что к паранеопластическим расстройствам, формирующимся при малигнизации клеток щитовидной железы, в частности, при папиллярной и фолликулярной формах патологии, относятся: снижение содержания в крови CD16-лимфоцитов, CD4-Т-лимфоцитов, CD8-Т-лимфоцитов, соотношения CD4/CD8-Т-лимфоцитов, уровня CD19-В-лимфоцитов, IgG, IgM, IgA. Мониторинг указанных показателей позволяет выявить латентные формы РЩЖ, проявляющиеся формированием отдаленных метастазов на фоне незначительных изменений структуры щитовидной железы.
Обращает на себя внимание значение нарушений иммунного ответа в механизмах канцерогенеза, следует отметить, что иммунная система в ряде случаев может обеспечивать не отторжение опухоли, а её развитие. В то же время наблюдается выраженная дисфункция клеточного звена иммунитета, связанная в значительной мере с нарушением баланса «регуляторных» цитокинов, оказывающих протоонкогенное или антионкогенное действие.
В последнее время появилось достаточное количество работ в отечественной и зарубежной литературе, касающихся классификации и структуры цитокинов, механизмов их локального и дистантного действия.
Как известно, цитокины представляют собой регуляторные пептиды с полипотентным локальным и системным действием на клетки-мишени за счет специфического связывания высокоаффинными мембранными рецепторами. В настоящее время идентифицировано около 200 полипептидных веществ со свойствами цитокинов – плейотропностью и взаимозаменяемостью биологического действия, отсутствием антигенной специфичности, проведением сигнала за счет взаимодействия со специфическими клеточными рецепторами.
Цитокины оказывают биологические эффекты на различные типы клеток, обеспечивая регуляцию эмбриогенеза, иммунопоэза, репаративной регенерации, формирование защитных реакций на местном и системном уровнях.
На основании ряда исследований четко определены и общие свойства цитокинов, объединяющие их в самостоятельную систему регуляции.
Во-первых, цитокины являются белками или полипептидами с молекулярной массой от 5 до 50 кДа, не имеют антигенной специфичности, в то же время активируют антигениндуцированные реакции Т- и В-лимфоцитов.
Синтез цитокинов – индуцибельный процесс, возникающий в основном на поврежденной ткани инфекционной и неинфекционной природы. Один и тот же цитокин продуцируется различными по гистогенетическому происхождению клетками, действует на различные типы клеток, вызывая различные биологические эффекты через специфические клеточные рецепторные комплексы. Однако ряд цитокинов могут использовать общие субъединицы рецепторов.
В последнее время появляются сведения в литературе относительно роли нарушений баланса цитокинов в патогенезе заболеваний различной этиологии, в частности, инфекционной, иммуноаллергической природы, а также в развитии онкологических заболеваний различной локализации.
Так, в ряде исследований представлены данные о дисбалансе интерлейкинов и изменении профиля цитокинов, продуцируемых Т-хелперами 1 (Th1) и Th2 при различных злокачественных новообразованиях.
В настоящее время используется несколько классификаций цитокинов в зависимости от особенностей их биохимических и биологических свойств, а также типов рецепторов, связывающих те или иные разновидности цитокинов.
Основные группы цитокинов включают:
1) гемопоэтические факторы (CCCF-G, M, GM, ИЛ-3, ИЛ-4, ИЛ-7, ИЛ-9, ИЛ-12, ИЛ-13, ИЛ-14, эритропоэтин), стимуляторы роста и дифференцировки гемопоэтических клеток;
2) цитокины, регулирующие специфические иммунные реакции (ИЛ-1, ИЛ-2, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-8, ИЛ-15, трансформирующие факторы роста (ФНО-?), ?-интерфероны);
3) регуляторы неспецифической защиты организма от бактериальных и вирусных инфекций, многими действиями которых являются макрофаги и гранулоциты, к ним относятся провоспалительные цитокины (IFN-?, ИЛ-6, ФНО-?, хемокины, ИЛ-8, МСР-1, RANTES и др.);
4) факторы некроза опухоли: цитокины с цитотоксическим и регуляторным действиями (ФНО-?, ФНО-?);
5) факторы роста: регуляторы роста, дифференцировки и функциональной активности клеток различной структурной организации (факторы роста фибробластов, эндотелиальных клеток, эпидермиса, трансформирующий фактор роста);
6) цитокины, влияющие на воспаление (ИЛ-1, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-8 и др.) и апоптоз (ИЛ-3, ИЛ-5, ИЛ-6, ИЛ-12, ИФ-?).
В соответствии с приведенными выше классификациями, ИЛ-1, ИЛ-6, ФНО-? относятся к категории провоспалительных цитокинов, являются регуляторами иммунных реакций, неспецифической резистентности, а ГКСФ выступает стимулятором роста и дифференцировки гемопоэтических клеток.
Установлено, что развитие I–II стадий неоплазии при фолликулярной форме РЩЖ сочетается с выраженным увеличением содержания в крови провоспалительных цитокинов ИЛ-1, ФНО-? и ГКСФ, достигающее максимума на III–IV стадиях развития неоплазии (рис. 11).
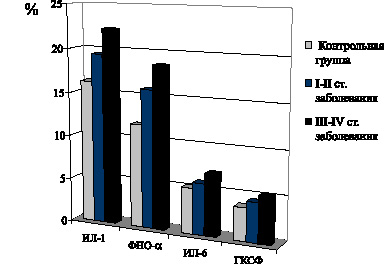
Рис. 11. Показатели содержания в крови цитокинов ИЛ-1, ФНО-? ИЛ-6 и ГКСФ у больных фолликулярной формой РЩЖ на I–II и III–IV стадиях распространения неоплазии
При папиллярной форме РЩЖ содержание в крови указанных цитокинов остается стабильно высоким на всех стадиях опухолевого процесса (рис. 12).
Касаясь биологической значимости возрастания уровня в крови ИЛ-1, необходимо отметить следующие данные литературы, свидетельствующие об адаптивном компенсаторно-приспособительном характере усиления продукции указанного цитокина моноцитарно-макрофагальными клетками, лимфоцитами и другими клеточными элементами. Как известно, ИЛ-1 осуществляет различные функции: индуцирует хемотаксис полиморфноядерных лейкоцитов, хемотаксис макрофагов, пролиферацию эндотелиальных клеток и остеобластов, стимулирует дифференцировку и пролиферацию B-клеток, высвобождение факторов, связанных с ростом и дифференцировкой миелоидной и лимфоидной клеточных линий, играет роль в регуляции и транскрипции гена ИЛ-2 и гена ИЛ-3 в определенных Т-клеточных линиях.
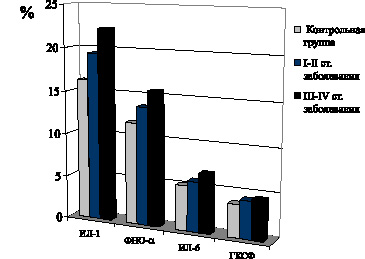
Рис. 12. Показатели содержания в крови цитокинов ИЛ-1, ФНО-? ИЛ-6 и ГКСФ у больных папиллярной формой РЩЖ на I–II и III–IV стадиях распространения неоплазии.
В то же время ИЛ-1 продуцируется макрофагами, эндотелиальными клетками, В- и Т-лимфоцитами, обладает множественными эффектами:
1) усиливает пролиферацию CD4-Т-лимфоцитов, рост и дифференцировку В-клеток;
2) способствует активации продукции антител и усиливает связывание NК-клеток с опухолевыми клетками;
3) действует на мононуклеарные фагоциты и клетки васкулярного эндотелия, стимулируя дальнейшую продукцию ими ИЛ-1 и вызывая синтез других цитокинов: ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-7, ИЛ-10 и ИЛ-12;
4) стимулирует процессы гемопоэза, начиная с уровня стволовых кроветворных клеток.
Однако следует отметить, что к числу биологических эффектов ИЛ-1 относится и его протоонкогенное действие. Согласно ряду данных, использование ИЛ-1 в экспериментальной онкологии приводит к улучшению васкуляризации опухоли, а добавление к культуре опухолевых клеток и стимулирует их пролиферацию.
В то же время отмечено, что ИЛ-1 способен активно ингибировать экспрессию на клетках антигенов гистосовместимости II класса, что препятствует реализации противоопухолевого иммунитета.
Содержание ИЛ-6 в крови больных дифференцированными формами РЩЖ на I–II стадиях распространения неоплазии не отличается от показателей контрольной группы, возрастая лишь на III–IV стадиях распространения опухолевого процесса.
Как известно, ИЛ-6 продуцируется активированными моноцитами или макрофагами, эндотелиальными клетками, фибробластами, активированными T-клетками, а также рядом клеток, не являющихся иммуноцитами. Некоторые эффекты, вызываемые ИЛ-6, аналогичны наблюдаемым при действии ИЛ-1 и ФНО-?. Однако основное действие ИЛ-6 связано с его участием в качестве кофактора при дифференцировке В-лимфоцитов, их созревании и преобразовании в плазматические клетки, секретирующие иммуноглобулины.
Обращает на себя внимание и тот факт, что большинство типов опухолевых клеток экспрессируют рецепторы для цитокинов семейств ИЛ-1 и ИЛ-6. Внутриклеточные сигнальные молекулы представлены транскрипционными факторами NFkB, STAT1, STAT3, запускающими пролиферацию, ингибирующими апоптоз и приводящими к синтезу ростовых факторов. Провоспалительные цитокины могут не только усиливать рост, но и метастазирование опухолевых клеток.
Содержание в крови ФНО-? возрастает при папиллярной и фолликулярной формах РЩЖ на начальных стадиях неоплазии, достигая максимума на поздних метастатических стадиях заболевани.
Что касается увеличения содержания в крови ФНО-? при дифференцированных формах РЩЖ, следует отметить, что он является единственным цитокином, обладающим прямым цитотоксическим эффектом в отношении опухолевых клеток. Цитотоксический эффект ФНО-?, с одной стороны, может реализоваться мембранным мономером ФНО-? при межклеточных контактах иммунокомпетентной клетки с клеткой–мишенью, а с другой стороны, тример ФНО-?, связанный с транспортными молекулами, может транспортироваться с кровотоком к эффекторным клеткам. Тример ФНО-? связывается с рецепторами ФНО-? на опухолевых клетках и денатурирует их. Несмотря на то что на всех клетках обнаруживается ФНО-рецептор, только мутантные клетки связываются с ФНО-? и разрушаются. Высокие концентрации ФНО-? определяются у больных при генерализованном злокачественном процессе и являются проявлением защитной реакции иммунной системы. В большинстве случаев, повышение концентрации ФНО-? приводит к его полимеризации и снижению противоопухолевого эффекта. Кроме того, высокие концентрации ФНО-? обладают негативным действием – вызывают развитие выраженных местной и общей воспалительной реакций, кахексии, угнетение активности моноцитов, тканевых макрофагов и других клеток и являются одним из патогенетических факторов развития у онкологических больных паранеопластических синдромов.
Установлено, что содержание в крови больных дифференцированными формами РЩЖ ГКСФ свидетельствует о возрастании его уровня на начальных стадиях заболевания, достигающего максимума в период метастазирования опухолевых клеток, то есть на III–IV стадиях распространения неоплазии.
Останавливаясь на значении возрастания уровня в крови больных фолликулярной и папиллярной формами РЩЖ ГКСФ, следует остановиться на ряде данных литературы. ГКСФ впервые описан как фактор, стимулирующий терминальную дифференцировку ряда миело-моноцитарных клеточных линий и образование миелоидных колоний клетками костного мозга.
ГКСФ синтезируется в организме человека многими типами клеток – моноцитами, макрофагами, фибробластами, эндотелиальными клетками.
Кроме клеток – предшественников ГКСФ увеличивает функциональную активность зрелых лейкоцитов – нейтрофилов, усиливает продукцию ими кислородных радикалов и антителозависимую цитотоксичность, уменьшает LPS-индуцированную продукцию провоспалительных цитокинов (ИЛ-1? и ФНО-?), ИФН-?, стимулирует синтез ИЛ-4, ИЛ-10, Th2 и гуморальные реакции.
Таким образом, развитие системных паранеопластических расстройств при дифференцированных формах РЩЖ в значительной мере обусловлено гиперпродукцией лимфоидной тканью, моноцитарно-макрофагальными клетками, фибробластами, провоспалительными цитокинами, обладающих широким спектром биологических эффектов локального и дистантного действий.
Мониторинг показателей содержания в крови провоспалительных цитокинов ИЛ-1, ИЛ-6, ФНО-?, ГКСФ может быть использован при оценке системных паранеопластических расстройств в динамике развития фолликулярной и папиллярной форм РЩЖ, особенно при «латентном» его течении.
Возрастание содержания в крови ИЛ-1, ИЛ-1, ФНО-? приводит к развитию стереотипных системных расстройств гормонального баланса в виде усиления продукции адренокортикотропного гормона, гонадотропного гормона, снижающих функциональную активность иммуноцитов, повышающих интенсивность липолиза, снижающих аппетит, и к другим соматическим расстройствам.
До настоящего момента остаются актуальными вопросы, касающиеся роли нарушений гормонального баланса в патогенезе развития неоплазий различной локализации, в том числе и дифференцированных форм РЩЖ. В работах отечественных и зарубежных авторов убедительно показана роль гиперэстогенемии в патогенезе развития дифференцированных форм РЩЖ.
Установлено, что эстрадиол в концентрации 10–8–10–1 усиливает размножение клеток щитовидной железы и этот эффект носит дозозависимый характер. В то же время очевидно наличие в нормальных и малигнизированных клетках щитовидной железы рецепторов к эстрогену и прогестерону, степень экспрессии которых коррелирует со степенью дифференцировки опухолевых клеток.
Следует отметить наличие в опухолевых клетках при РЩЖ фермента ароматазы-эстрогенсинтетазы, способного обеспечивать локальную гиперпродукцию эстрогенов и самоподдержание опухолевого роста.
Безусловно, важная роль в механизмах индукции канцерогенеза и последующих стадий опухолевой прогрессии при РЩЖ отводится нарушениям взаимодействия гормонов в гипоталамо-гипофизарно-тиреоидной системе.
До настоящего момента отсутствуют систематизированные сведения о характере динамического взаимодействия тиреотропного гормона, тироксина и трийодтиронина в процессе распространения неоплазии при дифференцированных фор-
мах РЩЖ.
Одной общей закономерностью нарушения взаимодействия в гипофизарно-тиреоидной системе на ранних стадиях опухолевого процесса (I–II стадии заболевания) при обеих гистологических формах РЩЖ является усиление центрогенной стимуляции щитовидной железы за счет гиперпродукции тиреотропного гормона, уровень которого в крови значительно возрастает (рис. 13).
В то же время содержание тироксина в крови снижается, а уровень трийодтиронина не изменяется. Результаты исследований показали, что одним из патогенетических факторов снижения продукции тироксина является антителозависимое подавление активности тиреопероксидазы (рис. 13).
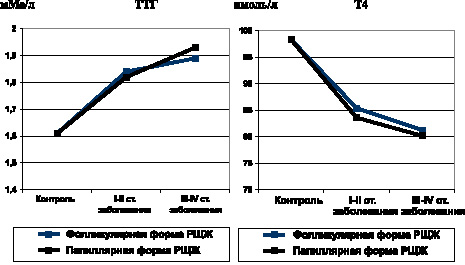
Рис. 13. Показатели уровня ТТГ и Т4 при фолликулярной и папиллярной формах РЩЖ на I-II и III-IV стадиях неоплазии
Развитие метастатических стадий опухолевого процесса при дифференцированных формах РЩЖ не обнаруживает параллелизм со сколько-нибудь выраженными изменениями гормонального статуса по сравнению с таковым на начальных стадиях неоплазии. Остается стабильно высоким уровень тиреотропного гормона, снижается уровень тироксина, уровень трийодтиронина не изменяется. Титр АТ к ТПО значительно превышает показатели группы контроля.
Таким образом, усиление центрогенного гормонального влияния на щитовидную железу за счет тиреотропного гормона не обеспечивает стимуляции продукции тироксина ни на ранних, ни на поздних стадиях развития дифференцированных форм РЩЖ.
В соответствии с полученными нами данными одним из патогенетических факторов нарушения гормонопродуцирующей функции щитовидной железы является подавление начальных этапов синтеза тироксина за счет антителозависимого ингибирования фермента ТПО, обеспечивающего процесс окисления атомарного йода до молекулярного.
Снижение продукции тироксина на фоне значительного увеличения содержания в крови тиреотропного гормона связано с уменьшением содержания рецепторов к ТПО на малигнизированных тиреоцитах и, соответственно, с нарушением захвата йода.
Информативными критериями развития начальных стадий РЩЖ и метастатических форм заболевания, особенно при латентном течении его, могут быть показатели содержания в крови тиреотропного гормона, тироксина и трийодтиронина, уровня АТ к ТПО, используемые в комплексе с традиционными методами обследования щитовидной железы на предмет выявления
неоплазии.
Обобщая в целом результаты проведенного нами комплексного обследования больных дифференцированными формами РЩЖ, следует отметить впервые выявленные закономерности системных паранеопластических расстройств относительно клеточного состава периферической крови, метаболического, иммунного, цитокинового статусов, изменений гормонального баланса, формирующихся на ранних стадиях развития РЩЖ и приобретающих определенные особенности в период опухолевой прогрессии.
Результаты комплексного обследования больных фолликулярной и папиллярной формами РЩЖ позволили расширить современные принципы диагностики папиллярной и фолликулярной форм РЩЖ, оценки эффективности комплексной терапии заболевания, сформулировать алгоритм диагностических приемов по оценке характера паранеопластических расстройств
при РЩЖ.