
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
1.1. Современные представления о патогенезе гипоксии. Классификация типов гипоксии и пусковые механизмы её развития
Гипоксия – типовой патологический процесс, осложняющий течение различных заболеваний.
Как известно, гипоксия определяет тяжесть течения ишемического поражения сердца, головного мозга, формирование полиорганной недостаточности при ДВС-синдроме [19, 28], шоковых [20] и коллаптоидных состояний [24, 47], является неизменным спутником заболеваний инфекционной и неинфекционной природы [49], а также стрессовых ситуаций [6, 11, 15, 53].
Тяжесть течения многих заболеваний и их исход в конечном итоге определяются особенностями вторичных неспецифических метаболических расстройств, степенью дестабилизации клеточных мембран, а также возможностями реактивации структурных и ферментных белков в условиях гипоксии.
Вышеизложенное указывает на необходимость дальнейшей детализации механизмов развития гипоксии на молекулярно-клеточном, органном, системном уровнях, а также патогенетического обоснования новых принципов медикаментозной коррекции метаболических и функциональных сдвигов при указанном типовом патологическом процессе.
В соответствии с общепринятыми классическими описаниями происхождения и классификации гипоксических состояний различают гипоксию экзогенного и эндогенного характера [46].
Гипоксия экзогенного характера может возникать как следствие уменьшения парциального давления кислорода во вдыхаемом воздухе при нормальном общем барометрическом давлении (нормобарическая гипоксия) и при общем снижении барометрического давления (гипобарическая гипоксия) [18]. Патогенетической основой развития гипоксии экзогенного типа является артериальная гипоксемия, а в ряде случаев и гипокапния, развивающаяся в результате компенсаторной гипервентиляции легких, приводящая к нарушениям кислотно-основного состояния и развитию газового алкалоза.
Для оценки закономерностей развития метаболических сдвигов при различных формах патологии более важны представления о современных принципах классификации гипоксии эндогенного типа по этиологическому фактору. В соответствии с этим различают дыхательную гипоксию, сердечно-сосудистую (циркуляторную гипоксию), гемическую, или кровяную гипоксию, и тканевую гипоксию [23, 34, 35].
Циркуляторная гипоксия может носить системный характер и развиваться при недостаточности сердечно-сосудистой системы, при ДВС-синдроме, при шоке различного генеза (кардиогенном, вазогенном, гиповолемическом), коллаптоидных состояниях [17, 31, 36].
Локальная циркуляторная гипоксия возникает при различных местных нарушениях периферического кровообращения: тромбозе, эмболии сосудов, в зоне ишемии, воспаления, стаза и др. формах патологии [31, 50].
Дыхательная (респираторная) гипоксия носит системный характер, связана с недостаточностью газообмена в легких при обструктивных, рестриктивных формах дыхательной недостаточности, а также при внелегочных формах патологии, обусловленных нарушением нервной и гуморальной регуляции дыхания, патологией грудной клетки и дыхательной мускулатуры [32].
Ограничение, затруднение внешнего дыхания при гипоксической гипоксии приводят в ряде случаев к развитию гипоксемии и гиперкапнии, т.е. формированию газового ацидоза, а затем и метаболического [32, 50].
В основе гемической гипоксии лежит уменьшение кислородной емкости крови в связи со снижением содержания гемоглобина в крови или его качественными сдвигами, например, при образовании карбоксигемоглобина, метгемоглобина и других врожденных или приобретенных аномалиях этого кислород-транспортирующего белка [31, 34, 35, 50].
К настоящему моменту детально описаны механизмы развития следующего варианта патологии дыхания – тканевой гипоксии [46, 50]. Последняя возникает в связи с нарушением экстракции кислорода тканями из притекающей крови и неспособностью клеток утилизировать кислород.
Однако пусковые механизмы развития тканевой гипоксии чрезвычайно разнообразны и могут быть связаны со следующими патогенетическими факторами:
1) ингибированием ферментов в процессе специфического и аллостерического связывания его активных центров, конкурентного торможения псевдосубстратами.
2) недостаточностью синтеза ферментов тканевого дыхания при дефиците специфических компонентов, изменениях физико-химических параметров внутренней среды, дефиците макроэргов при гипоксических состояниях любого генеза, поскольку все этапы синтеза ферментных, а также структурных белков в клетке являются энергозависимыми.
Одним из важнейших патогенетических факторов развития тканевой гипоксии является дезинтеграция структуры митохондриальных мембран, возникающая под влиянием различных этиологических факторов бактериально-токсической, иммуноаллергической природы, гормонального дисбаланса, нарушений электролитного баланса, при старении организма [2, 31, 39].
Тканевая гипоксия, безусловно, возникает вторично при различных типах первичной гипоксии – дыхательной, циркуляторной, гемической, инициирующих развитие ацидоза, активацию процессов липопероксидации, дестабилизацию всех биологических мембран, в том числе и митохондриальных [30].
Общепринятой является точка зрения о том, что в основе развития гипоксии лежат нарушения окислительно-восстановительных реакций в связи с дефицитом кислорода. В то же время высказывается точка зрения о возможности развития субстратного типа гипоксии, обусловленной недостаточностью субстратов окисления, например, глюкозы для нервных клеток, жирных кислот для миокарда [31, 34, 35, 46, 50].
Как следует из вышеизложенного, гипоксия, начинаясь как циркуляторная, дыхательная или гемическая, достаточно быстро приобретает смешанный характер.
В последние годы стали выделять 8 типов гипоксии: наряду с дыхательной, гемической, циркуляторной, тканевой, смешанной гипоксией выделяют так называемые гипероксигемическую, или гипербарическую, нормобарическую и гипобарическую гипоксии [13].
В связи с этим следует отметить, что острая гипоксемия того или иного генеза, а также гипероксия приводят к повреждению мембран митохондрий, пространственной дезорганизации дыхательных ферментативных ансамблей, локализованных на их внутренней мембране и соответственно к развитию тканевой гипоксии. Так что при многих гипоксических состояниях, сопутствующих различным заболеваниям инфекционной и неинфекционной природы, возникает нарушение экстракции кислорода тканями.
Касаясь патогенеза метаболических сдвигов, свойственных гипоксическим состояниям, следует отметить, что в организме человека более 90 % всего потребляемого кислорода восстанавливается с участием цитохромоксидазы митохондрий [39, 40, 41, 42], и лишь около 10 % кислорода метаболизируется в тканях с участием оксигеназ: диоксигеназы и монооксигеназы [25].
Наиболее многочисленны и сложны монооксигеназные реакции, протекающие в эндоплазматическом ретикулуме клеток при участии цитохрома Р-450 [15] и обеспечивающие гидроксилирование субстрата (стероидных гормонов, лекарственных препаратов и различных др. соединений) и, как правило, его инактивацию [25].
Диоксигеназы катализируют реакции, в которых в молекулу органического субстрата включаются оба атома молекулы кислорода (например, реакция окисления катехола молекулярным кислородом с раскрытием кольца).
В реакциях, связанных с переносом электронов, т.е. в реакциях окисления-восстановления, где, как указывалось выше, используется более 90 % потребляемого кислорода, атомы водорода, отщепленные дегидрогеназами от субстратов в цикле лимонной кислоты, передают свои электроны в цепь переноса электронов и превращаются также в Н+. Как известно, помимо 4 пар атомов водорода, поставляемых каждым оборотом цикла лимонной кислоты, образуются и другие атомы водорода, отщепленные дегидрогеназами от пирувата, жирных кислот и аминокислот в процессе их расщепления до Ацетил-СоА и других продуктов [35, 40, 41, 42, 43].
Таким образом, все атомы водорода, отщепляемые дегидрогеназами от субстратов, передают свои электроны в дыхательную цепь к конечному акцептору электронов – кислороду.
Касаясь последовательности транспорта электронов в окислительно-восстановительных реакциях, протекающих на внутренней мембране митохондрий, прежде всего следует отметить, что от всех НАД-зависимых реакций дегидрирования восстановленные эквиваленты переходят к митохондриальной НАДН-дегидрогеназе, затем через ряд железосерных ферментов передаются на убихинон М цитохрому b. Далее электроны переходят последовательно на цитохромы с1 и с, затем на цитохромы аа3 (цитохромоксидазу – медьсодержащий фермент). В свою очередь цитохромоксидаза передает электроны на кислород. Для того чтобы полностью восстановить кислород с образованием 2 молекул воды требуется 4 электрона и четыре Н+ [5].
В трех участках дыхательной цепи дыхание сопряжено с окислительным фосфорилированием и синтезом АТФ. Для того, чтобы окислительное фосфорилирование было сопряжено с дыханием, митохондриальная мембрана должна сохранять свою целостность, быть непроницаемой для Н+ и других ионов.
Как известно, снижение напряжения кислорода в тканях при гипоксии различного генеза лимитирует активность цитохромоксидазы и тем самым транспорт электронов по дыхательной цепи, сопряженной с синтезом АТФ. Полагают, что наиболее чувствительным к дефициту кислорода является начальный НАДН-зависимый участок дыхательной цепи [5, 7, 8, 10].
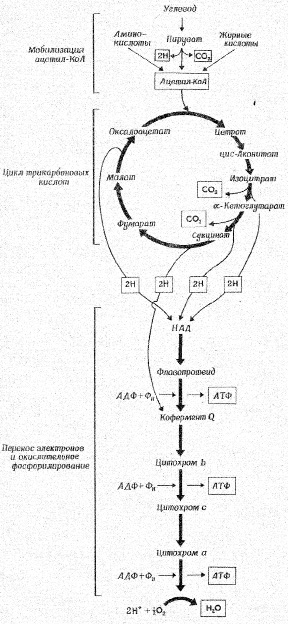
Схема дыхания. Конечные продукты каждой стадии даны в рамке.
Ленинджер А., 1999 [22].
Для нормального функционирования клеток необходимо, чтобы молекула кислорода, присоединив 4 электрона, полностью восстанавливалась до двух молекул воды [11]. При неполном восстановлении кислорода в случае присоединения только 2 электронов образуется перекись водорода, а в случае присоединения одного электрона – супероксидный анион-радикал (:О2•–). И перекись водорода и супероксидный анион- радикал крайне токсичны для клеток, повреждая клеточные мембраны в процессе взаимодействия с остатками полиненасыщенных жирных кислот мембран митохондрий [29, 36].
Вышеизложенное делает очевидным тот факт, что сопряжение окислительного фосфорилирования и дыхания на внутренней мембране митохондрий – чрезвычайно лабильный процесс, нарушение которого может быть связано с действием различных патогенетических факторов, в частности, гипоксического и гипероксического [37].
Терминальным звеном развития различных типов гипоксии: экзогенной, дыхательной, циркуляторной, гемической является избыточное накопление в ткани ионов водорода, развитие метаболического ацидоза с последующим повышением проницаемости мембран митохондрий и лизосомальных мембран, пространственной дезорганизацией дыхательных ансамблей, дефицитом АТФ [36, 38]. В то же время активация лизосомальных фосфолипаз обеспечивает развитие каскада реакций образования простагландинов, лейкотриенов, свободных радикалов с последующей дестабилизацией мембран клеток, в частности, митохондриальной [21, 48].
Таким образом, тканевая гипоксия в конечном итоге формируется вторично при гипоксиях различного генеза.
В условиях гипероксии, возникающей в процессе реперфузии предварительно ишемизированных тканей, а также при гипербарической оксигенации избыточные концентрации кислорода, не подвергающиеся тетравалентному восстановлению с образованием воды, становятся источником свободных радикалов, образуемых при одно- и трехэлектронном восстановлении кислорода [10].
