
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
3.10. Роль активации процесса липопероксидации в патогенезе поверхностных термических ожогов
Термическая травма занимает второе место в общей структуре травматизма вслед за механическими повреждениями тканей. Ожоги кожи – это часто встречающийся вид производственной и бытовой травмы. За последние два года отмечается нарастание частоты встречаемости термической травмы, что составляет в среднем 294,2 случая на 10 тыс. населения. Ежегодно в России ожоги получают около 400 000 человек, четверть из них подлежит госпитализации. Так, в 2007 году в приемное отделение ожоговых центров обратилось 42747 человек с ожогами. Из них было госпитализировано 46,4 %. В состоянии ожогового шока поступило 3471 (12,5 %) человек. В Саратовском ожоговом центре за год получают специализированное лечение порядка 1200 больных с термическими травмами различной степени тяжести, треть из них поступает из разных районов области [3, 18].
Этиологические факторы развития ожоговой травмы чрезвычайно гетерогенны включают действие высоких температур, пламени, электрического тока. Ожоговая травма может вызываться действием концентрированных кислот и щелочей [1, 3, 4].
Существует множество классификаций ожогов. Однако до настоящего времени отсутствует единая международная классификация термических поражений.
В зависимости от характера повреждающего фактора различают следующие виды ожогов:
1) термические ожоги, возникающие под влиянием паров, горячих жидкостей, пламени, раскаленных металлов и т.д.;
2) химические ожоги, образующиеся при воздействии крепких кислот, щелочей;
3) солнечные ожоги, формирующиеся под влиянием ультрафиолетовых волн коротких длин;
4) ожоги при многофакторных поражених, включающих действие различных термических факторов, наблюдающиеся у пострадавших при взрывах, пожарах, дорожно-транспортных происшествиях. Последние характеризуются высокой летальностью, так как одномоментно на человека воздействует несколько альтерирующих факторов: высокая температура окружающей среды, пламя, токсичные продукты горения, неблагоплиятные психогенные факторы и т.д. [3].
Несмотря на различия этиологических факторов и пусковых механизмов развития патологии, локальные или генерализованные ожоги, поверхностные или более глубокие характеризуются стереотипным комплексом морфофункциональных изменений в зоне травмы. Последний проявляется в развитии некроза и дистрофии с последующим выпадением, ограничением функции или развитием дисфункции. Тем не менее, термическая травма индуцирует развитие воспаления – типового патологического процесса с характерными стереотипными нарушениями структуры и функции тканей, а также расстройствами локальной гемодинамики.
В нашей стране широко используется классификация ожогов, принятая на XXVII Всесоюзном съезде хирургов в 1960 году [4]. Согласно данной классификации в зависимости от глубины поражения тканей различают ожоги I, II, IIIa, IIIб и IV степеней (рис. 3.1).
Ожоги I степени характеризуются повреждением поверхностных слоев эпидермиса и клинически проявляются покраснением и отеком кожи, болевыми ощущениями (в ожоговой зоне наблюдается стойкая артериальная гиперемия и воспалительная эксcудация). Репарация и регенерация поврежденных кожных покровов происходит в течение 3–4 дней.
Ожоги II степени характеризуются появлением пузырей, наполненных прозрачной желтоватой жидкостью. Под отслоившимся эпидермисом остается обнаженный его базальный слой.
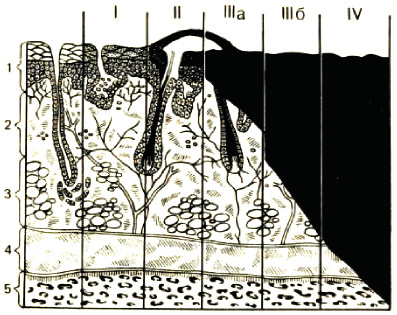
Рис. 3.1. классификация ожогов по степеням, в зависимости от глубины поражения тканей. По вертикали: 1 – эпидермис; 2 – дерма; 3 – подкожный жировой слой; 4 – мышцы;
5 – кость. По горизонтали: римскими цифрами обозначены степени ожога, черным цветом – глубина поражения (Б. С. Вихриева, В. М. Бурмистрова, 1986)
Ожоги III степени подразделяются на два вида. Ожоги IIIа степени (дермальные), для которых характерны поражения собственно кожи, но не на всю ее глубину. Наиболее часто повреждение ограничивается ростковым слоем эпидермиса лишь на верхушках сосочков, однако может наблюдаться некроз эпителия и поверхности дермы при сохранении более глубоких ее слоев и кожных придатков.
Таким образом, к поверхностным относятся ожоги I, II и IIIа степеней, при которых погибают только верхние слои кожи, и применяется, как правило, консервативное лечение, а заживление раны происходит за счет эпителизации из сохранившихся эпителиальных придатков кожи.
При ожоге IIIб степени омертвевает вся толща кожи и образуется некротический струп. Ожоги с частичным или полным поражением подкожного жирового слоя относят к ожогам IIIб степени.
Ожоги IV степени сопровождаются не только омертвением кожи, но и образований, расположенных глубже собственной фасции – мышц, костей, сухожилий, суставов.
Ожоги IIIб и IV степеней составляют группу глубоких ожогов, для которых необходимо оперативное восстановление кожного покрова [3, 4].
О роли активации свободнорадикального окисления липидов в структурной и функциональной дезорганизации биосистем при термической травме
Актуальность проблемы термической травмы определяется ее высокой распространенностью среди всех возрастных групп населения [3, 5, 7].
Несмотря на постоянное совершенствование современных принципов комплексной терапии ожогов, летальность при указанной форме патологии остается достаточно высокой в связи с развитием тяжелой аутоинтоксикации и полиорганной недостаточности. Вышеизложенное свидетельствует о целесообразности дальнейшего совершенствования принципов диагностики, оценки эффективности терапии и прогнозирования течения термических ожогов [3, 5, 7].
В настоящее время тяжесть термической травмы оценивается по определению площади ожоговой поверхности, глубины ожога, индекса Франка [3]. В тех случаях, когда площадь ожоговой поверхности занимает не более 15–20 % площади тела при поверхностных ожогах и не более 10 % при глубоких ожогах, речь идет об ожоговой ране. Несмотря на многообразие различных этиологических факторов и пусковых механизмов развития патологии, локальные или генерализованные ожоги, поверхностные или более глубокие характеризуются стереотипным комплексом морфофункциональных изменений в зоне травмы. Последние проявляются в последовательном развитии сосудистых изменений в виде спазма сосудистой стенки, артериальной и венозной гиперемии, стаза, а также тканевыми, дистрофическими и некротическими повреждениями с последующим выпадением, ограничением функции или развитием дисфункции [2, 3, 5, 6].
В настоящее время очевидно, что воспалительный процесс, независимо от локализации и особенностей действия этиологического фактора, характеризуется достаточно быстрым развитием синдрома системного воспалительного ответа. Последний, как известно, проявляется нарушениями со стороны сердечно-сосудистой и дыхательной систем, изменениями клеточного состава и белкового спектра периферической крови, развитием лихорадки. Однако до настоящего момента отсутствуют систематезированные сведения о состоянии процессов липопероксидации при термическом поверхностном поражении кожи, их динамических сдвигах в период острого воспаления и на фоне развития репаративной регенерации. Тем не менее, установление характера и механизмов развития системных метаболических расстройств позволило бы сформулировать новые объективные критерии оценки тяжести течения термической травмы, эффективности традиционных методов комплексной терапии и соответственно разработать новые принципы медикаментозной коррекции расстройств, свойственных синдрому системного воспалительного ответа.
Целью данного фрагмента исследования явилось изучение состояния процессов липопероксидации и антирадикальной защиты клеток крови больных с ожоговой раной на фоне традиционной комплексной терапии в динамике развития патологии.
Характеристика обследуемого контингента больных. В работе представлены результаты комплексного клинико-лабораторного обследования 30 больных с поверхностными ожогами (ожог I, II и IIIа степени) в динамике патологии, находившихся на стационарном лечении в Саратовском центре термических поражений в 2007–2010 гг. Оценка тяжести патологии проводилась традиционными методами, включающими определение площади ожоговой поверхности, глубины ожога [3, 5, 7].
Первый забор крови для исследования производился на 1-е сутки патологии. Патоморфологические изменения в зоне термической травмы при ожогах I и II степени характеризовались развитием реактивно-воспалительных процессов, протекающих по типу серозного отека. В области ожоговой раны наблюдалось покраснение, связанное с развитием стойкой артериальной гиперемии. Одним из симптомов развития термических ожогов являлась боль, обусловленная выраженным отеком и сдавлением нервных окончаний, а также высвобождением большого количества биологически активных веществ из поврежденных клеток. В зоне термической травмы при ожогах II степени отмечалось образование пузырей, заполненных прозрачной жидкостью, по составу близкой к плазме крови, вследствие резкого расширения капилляров, увеличения их проницаемости, сопровождающегося выходом жидкости под эпидермис. При ожоге IIIа степени образовывался поверхностный сухой светло-коричневый или белесовато-серый струп, местами наблюдалось развитие гиперемии и незначительного отека тканей [3, 5, 7].
Второй забор крови осуществлялся на 10-е сутки заболевания. В этот период времени при ожоге I и II степени начинался процесс эпителизации раны. В эти же сроки наблюдения в зоне ожога IIIа степени была видна четкая граница между погибшими и сохранившимися тканями: на фоне омертвевших тканей проступали розово-красные сосочки кожи, отмечалось формирование неширокого лейкоцитарного вала и начиналось отторжение струпа, которое продолжалось в течение 2–3-х недель [3, 5, 7].
Третий забор крови производился на 18-е сутки патологии (период выздоровления), когда в области термической травмы при ожогах I и II степени наблюдалась полная эпителизация, но в ряде случаев оставались краснота и пигментация кожных покровов. Вид ожоговой раны при ожоге IIIа степени был весьма характерен – на тонком слое грануляций появлялись множественные островки эпителизации, одновременно эпителий наползал и со стороны здоровой кожи до полной эпителизации поврежденной поверхности [3, 5, 7].
О развитии ситемных метаболических сдвигов при поверхностных ожогах кожи судили по степени интенсивности свободнорадикальной дестабилизации клеток крови, в частности по показателям содержания в крови промежуточных продуктов липопероксидации: диеновых конъюгатов (ДК) и малонового диальдегида (МДА). В качестве интегративных показателей стабильности биологических мембран использовано определение перекисной резистентности эритроцитов (ПРЭ). О состоянии антиоксидантной системы крови судили по показателям активности супероксиддисмутазы (СОД), каталазы, уровню витамина Е, SH-групп, которые определялись общепринятыми спектрофотометрическими методами исследования [6].
Для оценки степени выраженности аутоинтоксикации использовали определение в крови молекул средней массы (МСМ) спектрофотометрическим методом.
Результаты исследования показали, что на 1-и сутки с момента развития ожоговой раны отмечались интенсификация процессов липопероксидации и нарастание уровня промежуточных продуктов липопероксидации: МДА в эритроцитах и плазме крови, а ДК в эритроцитах – по сравнению с таковыми показателями контрольной группы (табл. 3.1) Избыточное накопление промежуточных продуктов липопероксидации сочеталось с недостаточностью механизмов антиоксидантной защиты клеток крови, на что указывало подавление активности СОД и каталазы эритроцитов, снижение уровня витамина Е в сыворотке крови, а также содержания общих SH-групп в крови по сравнению с таковыми показателями контрольных величин (табл. 3.1). Маркерами системного цитолиза клеток и выраженности аутоинтоксикации, характерными для этих сроков патологии, являлись снижение ПРЭ, а также возрастание уровня в крови МСМ (табл. 3.1).
Последующие наблюдения были проведены на 10-е сутки с момента поступления больных в стационар, когда начиналась эпителизация зоны ожога и отмечалось общее улучшение соматического статуса, снижение степени аутоинтоксикации и соответственно нормализация уровня МСМ в крови (табл. 3.1). Как оказалось, в этот период наблюдения был обнаружен параллелизм между улучшением общесоматического статуса больных, активацией процессов репаративной регенерации в зоне термической травмы и заметным снижением содержания в крови промежуточных продуктов липопероксидации. При этом отмечалась нормализация уровней ДК плазмы крови и эритроцитов и МДА эритроцитов. Уровень МДА плазмы крови еще превышал показатели контроля (табл. 3.1).
Таблица 3.1
Показатели содержания в крови промежуточных продуктов липопероксидации (малонового диальдегида, диеновых коньюгатов), перекисной резистентности эритроцитов, молекул средней массы, а также состояние антиоксидантной системы в крови у больных с ожоговой раной в различные сроки наблюдения
|
Сроки Изучаемые показатели |
Контрольная группа |
ОЖОГОВАЯ РАНА |
|||||
|
1-е сутки |
10-е сутки |
18-е сутки |
|||||
|
n = 15 |
n = 30 |
n = 30 |
n = 30 |
||||
|
M ± m |
M ± m |
Р |
M ± m |
Р |
M ± m |
Р |
|
|
ПРЭ, % гемолиза эритроцитов |
1,43 ± 0,08 |
2,1 ± 0,1 |
< 0,001 |
1,5 ± 0,1 |
> 0,5 |
1,3 ± 0,1 |
> 0,5 |
|
ДК (плазма |
1,43 ± 0,11 |
1,41 ± 0,2 |
> 0,5 |
0,4 ± 0,1 |
> 0,5 |
0,39 ± 0,1 |
> 0,5 |
|
ДК (эритроциты), ед/мл |
2,08 ± 0,5 |
3,3 ± 0,3 |
< 0,02 |
2,2 ± 0,2 |
> 0,5 |
2,1 ± 0,2 |
> 0,5 |
|
МДА (плазма крови), мкмоль/л |
0,82 ± 0,03 |
1,7 ± 0,2 |
< 0,001 |
1,3 ± 0,1 |
< 0,001 |
0,9 ± 0,1 |
> 0,5 |
|
МДА (эритроциты), мкмоль/л |
5,22 ± 0,24 |
6,1 ± 0,1 |
< 0,001 |
5,4 ± 0,3 |
> 0,5 |
5,3 ± 0,2 |
> 0,5 |
|
МСМ крови, усл.ед. |
0,24 ± 0,02 |
0,3 ± 0,01 |
< 0,01 |
0,26 ± 0,01 |
> 0,2 |
0,25 ± 0,1 |
> 0,2 |
|
SH-группы общие (ммоль/л) |
2,43 ± 0,03 |
1,2 ± 0,1 |
< 0,001 |
1,7 ± 0,1 |
< 0,001 |
2,3 ± 0,1 |
> 0,5 |
|
Каталаза эритроцитов (микроЕ/л) |
5,05 ± 0,77 |
3,3 ± 0,2 |
< 0,02 |
4,4 ± 0,2 |
> 0,2 |
5,01 ± 0,1 |
> 0,5 |
|
СОД цельной крови, (ед/мл) |
429 ± 38,3 |
308,7 ± 17,5 |
< 0,001 |
352,4 ± 13,3 |
> 0,5 |
385,3 ± 12,4 |
> 0,5 |
|
Вит. Е в сыворотке rрови, |
22,04 ± 0,4 |
11,6 ± 0,1 |
< 0,001 |
17,2 ± 0,1 |
< 0,001 |
21,1 ± 0,6 |
> 0,1 |
Одним из патогенетических факторов нормализации уровня промежуточных продуктов липопероксидации в крови пациентов с ожоговой травмой в указанный период наблюдения явилась активация ферментного и неферментного звеньев антиоксидантной системы крови. Так, активность каталазы эритроцитов, СОД и показатели ПРЭ возрастали до контрольных величин. Однако содержание витамина Е в сыворотке крови и уровень SH-групп оставались ниже соответствующих показателей контроля (табл. 3.1). И наконец, на 18-е сутки с момента поступления больных в стационар отмечались полная эпителизация ожоговой раны, нормализация уровня промежуточных продуктов липопероксидации в крови, что сочеталось с активацией процессов антирадикальной защиты клеток крови и улучшением общесоматического статуса пациентов (табл. 3.1).
Выводы
1. Термическая травма при ожогах кожи I, II и IIIа степени тяжести закономерно сопровождается развитием системных метаболических расстройств в виде активации процессов липопероксидации и соответственно избыточным накоплением в крови МДА и ДК.
2. Обнаружен параллелизм между тяжестью клинических проявлений термической травмы и уровнем МДА и ДК в крови: в период острого воспалительного процесса отмечается резкое увеличение содержания в крови промежуточных продуктов липопероксидакции и МСМ, а эпителизация зоны ожога и репаративная регенерация раневой поверхности происходят на фоне нормализации содержания в крови промежуточных продуктов липопероксидации и МСМ.
3. Ведущим патогенетическим фактором активации процессов липопероксидации при поверхностных термических ожогах кожи является недостаточность ферментного и неферментного звеньев антиоксидантной системы крови.
4. Выявленные нами закономерности метаболических и функциональных расстройств, характеризующихся системной дестабилизацией биологических мембран клеток под влиянием свободных радикалов, свидетельствуют о целесообразности включения в комплексную терапию больных с поверхностными термическими ожогами кожи антиоксидантов, антигипоксантов и мембранопротекторов не только местного, но и системного действия.
5. Установление патогенетической взаимосвязи характера системных метаболических расстройств с тяжестью клинических проявлений ожоговой раны позволяет рекомендовать использование мониторинга показателей содержания в крови МДА, ДК, витамина Е, активности СОД, каталазы, витамина Е для оценки эффективности терапии и прогнозирования течения патологии.
Указатель основной литературы
1. Алексеев А.А. Актуальные вопросы организации и состояния медицинской помощи пострадавшим от ожогов в Российской Федерации /А.А. Алексеев, В.А. Лав-
ров // II съезд комбустиологов России: Сборник научных трудов – М., 2008. – С. 3–5.
2. Белоцкий С.М., Авталион Р.Р.Воспаление. Мобилизация клеток и клиничекие эффекты. – М.:Изд-во БИНОМ, 2008. – 240 с.
3. Неотложная помощь при термической травме / Н.В. Островский, В.Б. Бабкин, И.Б. Белянина и др. – Саратов: Изд-во СМУ, 2006. – 35 с.
4. Ожоги. Руководство для врачей /Б.С. Вихреева, В.М. Бурмистрова. – Ленинград: «Медицина», 1986. – 270 с.
5. Патогенез типовых реакций организма на травму / Н.П. Чеснокова, П.В. Глыбочко, В.Ю. Барсуков и др. – Саратов: Изд-во СМУ, 2011. – С. 146–222.
6. Патологическая физиология/Н.П. Чеснокова, В.В. Моррисон, Г.Е. Брилль и др. – Саратов: Изд-во СМУ, 2010. – 545 с.
7. Шок как проявление реакций дезадаптации при стрессе/ П.В. Глыбочко, М.Ю.Ледванов, А.А. Свистунов и др. – М.: Изд-во «Академия Естествознания», 2009. – 528с.
8. Fried R. Enzymatic and new- enzymatic assay of superoxide dismutase/R. Fried Fried//Biochemie. – 1975. – Vol. 57. – P. 675–680.
