
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
1.1. Анализ современного состояния теории растворов электролитов
Теория растворов электролитов представляется одним из наиболее важных в технологическом отношении и сложных в теоретическом плане разделов химической науки. В основе современного состояния теории растворов электролитов и различных ее модификаций лежат электростатические представления классической теории Дебая-Хюккеля, которая, по существу, является теорией предельного разбавления.
Так, основное уравнение Дебая-Хюккеля дается в виде [1]:
![]() ,
,
где ![]() – потенциал самосогласованного поля системы ионов;
– потенциал самосогласованного поля системы ионов; 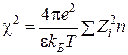 – величина, обратная дебаевскому радиусу экранирования
– величина, обратная дебаевскому радиусу экранирования ![]() .
.
Оно было получено в предположении, что ![]() в функции распределения Больцмана для плотности заряда:
в функции распределения Больцмана для плотности заряда:
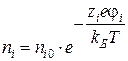 .
.
Данное условие в свою очередь предполагает малые концентрации электролита, т.е. когда расстояния между ионами большие. Только в этом случае возможно при разложении экспоненты 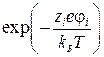 в ряд Маклорена оставить первые два члена:
в ряд Маклорена оставить первые два члена:
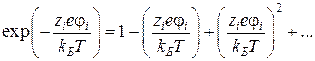
Следовательно, теория Дебая-Хюккеля, по определению является теорией разбавленных растворов, и все попытки ее модификации для более концентрированных растворов в рамках этой теории не имеют реальной основы, поскольку требует введения подгоночных параметров.
Далее, необходимо отметить противоречие электростатической теории растворов Дебая-Хюккеля с фундаментальной теоремой Ирншоу [2]. Согласно данной теореме, «любое статическое распределение зарядов не имеет устойчивых состояний». Следовательно, распределение ионов в растворах электролитов, по Дебаю-Хюккелю, является неподвижным и их поведение не может иметь физически приемлемых решений для устойчивых состояний.
Следует отметить, что дебаевский радиус ![]() является одним из основных понятий в современной теории плазмы [3]. По определению, это есть расстояние, на которое проникает в плазму внешнее электростатическое поле, нейтрализуемое полями диполей растворителя, индуцированными вследствие поляризации среды:
является одним из основных понятий в современной теории плазмы [3]. По определению, это есть расстояние, на которое проникает в плазму внешнее электростатическое поле, нейтрализуемое полями диполей растворителя, индуцированными вследствие поляризации среды:
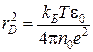 ,
,
где ![]() – диэлектрическая постоянная среды в вакууме. Значение
– диэлектрическая постоянная среды в вакууме. Значение ![]() раствора электролита можно принимать равным
раствора электролита можно принимать равным ![]() для чистого растворителя, вплоть до концентрированных растворов [4].
для чистого растворителя, вплоть до концентрированных растворов [4].
С другой стороны, дебаевский радиус ![]() представляет собой расстояние, на которое заряды в плазме собираются вокруг рассматриваемого заряда и экранируют его поле [5]. Данное определение является более точным для физики плазмы, поскольку дебаевский радиус, по порядку величины, равен расстоянию, которое заряд с тепловой скоростью
представляет собой расстояние, на которое заряды в плазме собираются вокруг рассматриваемого заряда и экранируют его поле [5]. Данное определение является более точным для физики плазмы, поскольку дебаевский радиус, по порядку величины, равен расстоянию, которое заряд с тепловой скоростью 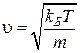 проходит за один период колебаний
проходит за один период колебаний ![]() , отвечающей частоте плазменных колебаний [6]:
, отвечающей частоте плазменных колебаний [6]:
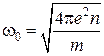 ,
,
Таким образом, электростатическая теория Дебая-Хюккеля, правильно формализующая один из основных параметров плазменного состояния вещества – дебаевский радиус ![]() , не учитывает, что это понятие является сопряженным с плазменной частотой. По определению, плазменная частота характеризует малое изменение плотности заряда относительно его среднего значения в режиме малых гармонических колебаний.
, не учитывает, что это понятие является сопряженным с плазменной частотой. По определению, плазменная частота характеризует малое изменение плотности заряда относительно его среднего значения в режиме малых гармонических колебаний.
Очевидно, что эти плазменные колебания и обеспечивают устойчивость систем зарядов в соответствии с теоремой Ирншоу, а также формализуют энергию коллективных многочастичных взаимодействий ионов в форме
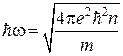 .
.
Таким образом, в теории Дебая-Хюккеля остается неуточненным ряд существенных взаимодействий и свойств ионов. Теория не учитывает, например, сольватацию ионов, особенности строения ионов, их поляризуемость и т.п., что существенно ограничивает ее применимость.
Дальнейшее развитие теории на разных этапах всегда было связано с многочисленными попытками ликвидировать ее недостатки. Краткий обзор существующих современных представлений приведен в [7].
Изложенное выше позволяет утверждать, что существующие теоретические модели растворов электролитов не могут объяснить с единых позиций многие экспериментальные факты и закономерности.
Вместе с тем, отдельные фрагменты теории свидетельствуют о перспективности привлечения для описания состояния ионов в растворах электролитов концепции «ионной плазмы», согласно которой, в растворах электролитов наблюдаются продольные акустические колебания совокупностей ионов с частотой ![]() , аппроксимируемых как «ионный звук» [8-11]. Предлагаемая трактовка состояния ионов электролитов позволила с единых позиций формализовать ионную подвижность и энергии многочастичных коллективных взаимодействий ионов, а также объяснить такие факторы, как эффекты Дебая-Фалькенгагена, эффект Вина, максимальное значение электропроводности
, аппроксимируемых как «ионный звук» [8-11]. Предлагаемая трактовка состояния ионов электролитов позволила с единых позиций формализовать ионную подвижность и энергии многочастичных коллективных взаимодействий ионов, а также объяснить такие факторы, как эффекты Дебая-Фалькенгагена, эффект Вина, максимальное значение электропроводности ![]() при больших градиентах напряжения (потенциала) и частоты.
при больших градиентах напряжения (потенциала) и частоты.
Однако данная концепция также не лишена недостатков. Так, полученное авторами уравнение для оценки электропроводности позволяет рассчитывать ее лишь при 25 °С, поскольку используемая в уравнении величина энергии водородной связи растворителя в жидкой фазе известна лишь при 25 °С и равна ![]() = 3,4 ккал/моль [12]. Следующим недостатком является использование величины
= 3,4 ккал/моль [12]. Следующим недостатком является использование величины ![]() , которая представляет собой внутреннюю энергию реального газа. Так же следует отметить, что данная концепция, апробирована только лишь для индивидуальных электролитов.
, которая представляет собой внутреннюю энергию реального газа. Так же следует отметить, что данная концепция, апробирована только лишь для индивидуальных электролитов.
