
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
1.2.2. Вязкость
Проблемы теории вязкости, ее механизма, зависимости от внешних факторов и внутренних характеристик системы, являются до сих пор дискуссионными. Вязкость является структурочувствительным свойством, характеризующим как индивидуальную, так и сложную по составу систему.
Современные теории вязкости зачастую носят эмпирический и полуэмпирический характер, в которых вязкость рассматривается как функция ряда параметров, как температура, мольный или удельный объем, энергия взаимодействия и др. Как правило, такие модели не претендуют на универсальность и содержат значительное количество эмпирических параметров. Вследствие этого, применимость моделей ограничена набором систем и условий.
Представляет значительный интерес термодинамическая теория скоростей химических реакций, развитая Эйрингом [41]. Механизм течения понимается как последовательность равновесных состояний, относительно определенного положения молекул, которое изменяется при течении. При этом структура жидкости описывается с позиции некоторой доли упорядоченности. В основе этой теории лежит дырочная модель жидкости и представления Я.И. Френкеля [42] о тепловом движении ее молекул, положений равновесия и их скачков из одного положения равновесия в другое. Теории Френкеля и Эйринга выводят и теоретически обосновывают одно и то же уравнение, но по своей сути исходят из различных предположений. Если Френкель жидкость сравнивает с кристаллическим состоянием, то Эйринг в большей степени приписывает жидкости свойства идеального газа. Это приводит как к различным выражениям для предэскпоненциального множителя, так и различному физико-химическому смыслу энергии активации вязкого течения. Обе эти теории обладают ограниченностью при описании температурных зависимостей во всем интервале существования жидкостей.
В физико-химических работах, для обработки экспериментальных данных о вязкости растворов электролитов, также используют модифицированное уравнение Эйнштейна [4]
![]() ,
,
где ![]() – «эффективный несжимаемый молярный объем»; C – молярная концентрация электролита.
– «эффективный несжимаемый молярный объем»; C – молярная концентрация электролита.
Уравнение Эйнштейна справедливо для разбавленных суспензий, в которых линии потока вокруг соседних частиц не взаимодействуют между собой, иначе движение ламинарное. Однако в более концентрированных суспензиях взаимодействие линий потока вокруг соседних частиц становится значительным, т.е. появляется турбулентность.
Единственным теоретическим уравнением для описания концентрационной зависимости вязкости водных растворов электролитов является уравнение Фалькенгагена [43]
![]() .
.
Здесь ![]() – относительная вязкость (
– относительная вязкость (![]() и
и ![]() – динамическая вязкость раствора и воды при одной и той же температуре); C – молярная концентрация; A – постоянная, является функцией свойств растворителя, подвижностей и зарядов ионов и температуры.
– динамическая вязкость раствора и воды при одной и той же температуре); C – молярная концентрация; A – постоянная, является функцией свойств растворителя, подвижностей и зарядов ионов и температуры.
Очевидно, что взаимодействие ион–растворитель должно формализовать сольватные числа ионов и их размеры, это не рассматривается в данной работе.
При увеличении концентрации, когда на вязкость раствора начинают оказывать заметное влияние другие виды взаимодействий в растворе, в частности, взаимодействие ионов растворенного вещества с молекулами растворителя, возникает необходимость вводить в уравнения новые поправки с эмпирическими коэффициентами, зависящими от температуры и концентрации.
Как показано в работе [44] концентрационную зависимость вязкости электролитных растворов часто интерпретируют с позиций полуэмпирического уравнения Джонса-Дола:
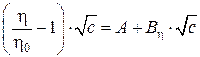 ,
,
где коэффициенты A и ![]() характеризуют взаимодействия ион–ион и ион-растворитель соответственно. Величина коэффициента
характеризуют взаимодействия ион–ион и ион-растворитель соответственно. Величина коэффициента ![]() и характер его зависимости от температуры и природы электролита для многих веществ получены экспериментально.
и характер его зависимости от температуры и природы электролита для многих веществ получены экспериментально.
Эйчер и Зволинский [41] для описания температурной зависимости вязкости воды и некоторых других жидкостей в интервале от –10 до 150 °С дают следующее выражение, содержащее три эмпирических параметра:
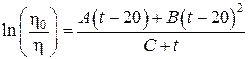 ,
,
где ![]() ,
, ![]() и
и ![]() – константы, характеризующие данную жидкость.
– константы, характеризующие данную жидкость.
На основе законов механики Ньютона, а так же Максвелла-Больцмана для распределения частиц по энергиям, Панченковым Г.В. получена более сложная зависимость вязкости от температуры и давления [45]:
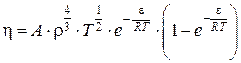 ,
,
где 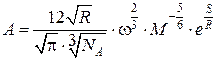 ; ρ – плотность; ω – собственный объем молекул в расчете на моль; M – молекулярный вес жидкости; S – энтропия образования связи;
; ρ – плотность; ω – собственный объем молекул в расчете на моль; M – молекулярный вес жидкости; S – энтропия образования связи; ![]() – число Авогадро; R – газовая постоянная; T – температура. Очевидно, что существенным недостатком данного метода является отсутствие концентрации электролита C.
– число Авогадро; R – газовая постоянная; T – температура. Очевидно, что существенным недостатком данного метода является отсутствие концентрации электролита C.
Несомненную роль в развитии теории вязкости жидкости установил Бачинский. Он показал линейную зависимость вязкости жидкости от ее удельного объема [46]:
![]() .
.
Уравнение Бачинского не применимо к ассоциированным жидкостям со сложной молекулярной структурой, но по существу верно обосновывает взаимосвязь вязкости со способностью молекул к свободному перемещению в объеме жидкости.
Балдановым М.М. и Тангановым Б.Б. [47, 48] предложена модель оценки вязкости индивидуальных электролитов:
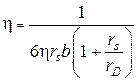 ,
,
отличающаяся от уравнения Стокса множителем 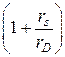 , учитывающим колебательный характер процесса и силу сопротивления среды для колеблющейся сферической частицы или иона.
, учитывающим колебательный характер процесса и силу сопротивления среды для колеблющейся сферической частицы или иона.
Данная модель действительна только при температуре 298К и внутренней энергии реального газа равной ![]() , а в случае смесей электролитов не учитывает мольные доли компонентов смесей.
, а в случае смесей электролитов не учитывает мольные доли компонентов смесей.
Предложены и другие уравнения для расчета вязкости бинарных систем, которые, как правило, являются менее общими и применимы к определенному кругу систем со сходными физическими и химическими свойствами.
Таким образом, в теории растворов изучению вязкости уделяется большое внимание, но встречаются противоречивые данные о величинах ![]() , определенных для одних и тех же систем. Тем самым, остаются актуальными попытки разработок строгих количественных моделей для исследования вязкости растворов электролитов.
, определенных для одних и тех же систем. Тем самым, остаются актуальными попытки разработок строгих количественных моделей для исследования вязкости растворов электролитов.
