
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
1.2.3. Диффузия
Теория диффузии представляет большой интерес как один из простейших примеров необратимых процессов, которые устанавливает связь между электропроводностью и свободной энергий. Благодаря диффузии происходит выравнивание концентраций путем самопроизвольного перемещения вещества. В растворах, содержащих одно растворенное вещество, происходит диффузия этого вещества из области повышенной концентрации в область пониженной концентрации.
Коэффициент диффузии является основным параметром, характеризующим процессы мембранного массопереноса, величина которого отражает не только характер взаимодействия мембран с компонентами фильтруемого раствора, но и взаимное влияние растворенных веществ и растворителя.
В большинстве случаев диффузионные процессы описываются законами Фика. Диффузионный транспорт жидкостей, подчиняющийся первому закону Фика, соответствует линейному характеру зависимости количества продиффундировавшего вещества от времени. В основе описания процесса лежит рассмотрение концентрации как функции расстояния. Течение жидкости характеризуется дифференциальным уравнением:
![]() ,
,
где ![]() – характеризует течение через мембрану; c – концентрация раствора; x – направление диффузии; D – коэффициент диффузии, характеризующий процесс массопереноса того или иного вещества через определенную преграду. Данное уравнение применимо только к стационарным процессам при
– характеризует течение через мембрану; c – концентрация раствора; x – направление диффузии; D – коэффициент диффузии, характеризующий процесс массопереноса того или иного вещества через определенную преграду. Данное уравнение применимо только к стационарным процессам при ![]() .
.
Нестационарные диффузионные процессы описываются вторым законом Фика:
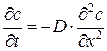 .
.
Величины коэффициентов диффузии веществ в водных растворах зависят от метода определения и условий, используемых в том или ином эксперименте. Так, определение значений D в случае растворов электролитов проводится экспериментально с использованием диафрагм [49]. В этом случае исследуют диффузионный перенос ионов через поры макропористого стекла, разделяющего раствор и чистый растворитель.
Характерной чертой диффузии водных растворов солей является отсутствие монотонных зависимостей величины коэффициента диффузии от концентрации. В процессе диффузии ионы в растворе движутся в одном направлении, задаваемом перепадом концентрации; при этом, очевидно, катионы и анионы, обладая различной подвижностью, создают в процессе перемещения локальные диффузионные потенциалы, учет которых представляет собой задачу высокого порядка сложности.
Диффузия в растворах электролитов зависит от подвижности ионов, которая связана с электропроводностью. Основные различия между этими двумя процессами заключаются в следующем:
а) электропроводность связана с движением положительно и отрицательно заряженных ионов в разных направлениях, при наличии внешнего поля с напряженностью E, а в процессе диффузии и те и другие движутся в одном направлении;
б) в процессе электропроводности при бесконечном разбавлении различные ионы электролита движутся независимо один от другого, тогда как при диффузии они вынуждены двигаться с одинаковыми скоростями, ибо в противном случае произошло бы разделение электрического заряда в растворе.
Можно считать, что оба процесса являются следствием малых возмущений молекулярного движения; в случае электропроводности роль возмущения играет внешнее электрическое поле, а при диффузии – градиент концентрации. В первоначальном выводе соотношения между двумя эффектами, который был дан Нернстом, роль движущей силы при диффузии играло осмотическое давление, аналогично электрическому полю при электропроводности. Но согласно современным взглядам, осмотическое давление нельзя сравнивать с истинным давлением в растворе. Эффективной движущей силой диффузии является градиент химического потенциала, обладающий размерностью силы на единицу количества растворенного вещества [4].
Основываясь на дырочной теории жидкости, в рамках теории переходного состояния имеет место связь между вязкостью и диффузией [41]:
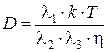 ,
,
где D – коэффициент диффузии; ![]() – расстояние между соседними молекулами в направлениях, выбранных по осям координат;
– расстояние между соседними молекулами в направлениях, выбранных по осям координат; ![]() – константа скорости процесса вязкого течения.
– константа скорости процесса вязкого течения.
В работе [50] на основании измерения электропроводности водных растворов селеновой кислоты и селената натрия различной концентрации в температурном интервале 288–318 К найдены коэффициенты самодиффузии. Для нахождения величин коэффициентов диффузии ионов при бесконечном разбавлении ![]() использовали уравнение:
использовали уравнение:
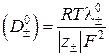 ,
,
где ![]() – заряд иона; F – константа Фарадея; остальные параметры имеют обычный смысл. Мольный коэффициент самодиффузии
– заряд иона; F – константа Фарадея; остальные параметры имеют обычный смысл. Мольный коэффициент самодиффузии ![]() при бесконечном разбавлении вычисляли по уравнению Нернста-Хаскеля:
при бесконечном разбавлении вычисляли по уравнению Нернста-Хаскеля:
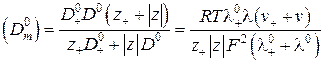 .
.
Здесь ![]() и
и ![]() – коэффициенты самодиффузии ионов при бесконечном разбавлении;
– коэффициенты самодиффузии ионов при бесконечном разбавлении; ![]() и
и ![]() – число ионов, получающееся при диссоциации молекулами электролита.
– число ионов, получающееся при диссоциации молекулами электролита.
Концепция плазмоподобного состояния ионов в растворах, разработанная в работе [51], позволила авторам оценивать диффузию растворов электролитов на основе уравнения Эйнштейна:
![]() ,
,
где b – подвижность ионов электролита.
Хотя в последнее время усовершенствуются методы определения коэффициентов диффузии для растворов электролитов, теории, способной с единых позиций объяснить диффузионные процессы, нет. Это связано со значительными экспериментальными трудностями. Поэтому исследования в области определения коэффициентов диффузии являются, и по сей день, важной задачей в построении общей теории растворов электролитов.
Таким образом, теория растворов электролитов является одним из наиболее важных в технологическом отношении и сложных в теоретическом плане разделов химической науки. Необходимость в расчетных уравнениях для определения многих важных свойств растворов определяет ее технологическую значимость. Само же построение общей теории растворов электролитов имеет методологическое значение не только для самих растворов, но и для всех конденсированных систем, к которым принадлежат и твердые тела.
Как было отмечено выше, развитие теории растворов наталкивается на большие трудности, обусловленные чрезвычайным обилием экспериментального материала. Вследствие чего, в настоящее время не существует единой теории растворов, а многочисленные их свойства описываются в рамках более или менее глубоких теоретических представлений, которые не всегда удовлетворительно соответствуют друг с другом. Поэтому исследования в области формирования единой концепции, лежащей в основе многих свойств растворов электролитов остаются актуальными в теоретическом и очень важными в практическом отношении и по сей день.
