
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
3.1. Методы определения сольватных чисел
Имеется ряд методов, с помощью которых определяют числа сольватации (или гидратные числа). Но, как правило, данные методы дают различные значения сольватных чисел для одних и тех же ионов [79]. Это связано с различного рода допущениями, применяемыми авторами данных методов, которые являются иногда необоснованными в полной мере.
Одним из классических способов определения чисел молекул, присоединенных к иону, является расчет по подвижности ионов [15], т.е. на основании данных по числам переноса. Число переноса катиона – это отношение подвижности катиона к сумме подвижностей катиона и аниона:
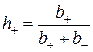 .
.
Соответственно число переноса аниона – это отношение подвижности аниона к сумме подвижностей аниона и катиона:
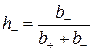 .
.
Сумма чисел переноса катиона и аниона равна единице:
![]() .
.
Этот способ определения чисел сольватации недостаточно точен, так как с увеличением концентрации числа переноса изменяются не только в связи с изменением количества растворителя, перенесенного ионами, но и в связи с изменением подвижности в результате межионного взаимо-
действия.
Другой метод определения чисел сольватации ионов основан на определении радиуса иона непосредственно из закона Стокса:
![]() .
.
По этому уравнению, из подвижности ![]() и вязкости среды
и вязкости среды ![]() , определяют величину r, а на основании r – объем иона
, определяют величину r, а на основании r – объем иона ![]() . Полученный объем сольватированного сравнивают с объемом несольватированного иона, основываясь на кристаллографическом радиусе иона
. Полученный объем сольватированного сравнивают с объемом несольватированного иона, основываясь на кристаллографическом радиусе иона ![]() . Разность между этими объемами является объемом сольватной оболочки:
. Разность между этими объемами является объемом сольватной оболочки:
![]() .
.
Если этот объем разделить на объем молекулы растворителя, то находят число сольватации иона.
О.Я. Самойловым [80] предложен термохимический метод определения чисел гидратации ионов. Метод основан на представлениях о том, что протон в растворе не закреплен за определенной молекулой воды и известное время пребывает у каждой молекулы. Благодаря этому можно считать, что протон сообщает всем молекулам воды определенный заряд и что каждая молекула воды выступает как положительный ион с зарядом, в ![]() раз меньшим заряда протона, если
раз меньшим заряда протона, если ![]() – число воды, приходящихся на один протон.
– число воды, приходящихся на один протон.
Известно, что теплота растворения соли зависит от концентрации ионов водорода в растворе. Так, теплота растворения ![]() и
и ![]() в растворах
в растворах ![]() зависит от концентрации кислоты. Самойлов объясняет это обстоятельство тем, что, благодаря наличию положительного заряда, на молекулах воды происходит их некоторое дополнительное отталкивание от положительных ионов и притяжение к отрицательным; так как размеры анионов больше, заряды в основном сказываются на взаимодействии воды с катионами. Дополнительное отталкивание уменьшает положительные тепловые эффекты и увеличивает отрицательные.
зависит от концентрации кислоты. Самойлов объясняет это обстоятельство тем, что, благодаря наличию положительного заряда, на молекулах воды происходит их некоторое дополнительное отталкивание от положительных ионов и притяжение к отрицательным; так как размеры анионов больше, заряды в основном сказываются на взаимодействии воды с катионами. Дополнительное отталкивание уменьшает положительные тепловые эффекты и увеличивает отрицательные.
В методе Улиха предполагается, что образование внутреннего гидратного слоя подобно процессу замерзания воды. Такое представление разделяют и многие другие авторы. Эли и Эванс, например, сравнивают сольватный слой с микроскопическим айсбергом, сформировавшимся вокруг частицы растворенного вещества. Так как уменьшение энтропии при замерзании воды составляет 6 кал/моль·град, то число гидратации
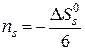 .
.
Иной способ определения сольватного числа основан на изменении диэлектрической постоянной раствора с концентрацией электролита. Это изменение можно описать уравнением:
![]() ,
,
где ![]() – диэлектрическая постоянная раствора;
– диэлектрическая постоянная раствора; ![]() – диэлектрическая постоянная растворителя;
– диэлектрическая постоянная растворителя; ![]() и
и ![]() – положительные коэффициенты для катиона и аниона. Считая, что молекулы растворителя, образующие внутренний гидратный слой вокруг иона, не участвуют в процессах ориентации и поляризации, т.е. в формировании величины диэлектрической постоянной, можно написать
– положительные коэффициенты для катиона и аниона. Считая, что молекулы растворителя, образующие внутренний гидратный слой вокруг иона, не участвуют в процессах ориентации и поляризации, т.е. в формировании величины диэлектрической постоянной, можно написать
![]() ,
,
здесь ![]() – минимальное число молекул во внутреннем гидратном слое, а
– минимальное число молекул во внутреннем гидратном слое, а ![]() – молекулярный вес воды. Сумму коэффициентов
– молекулярный вес воды. Сумму коэффициентов ![]() и
и ![]() находят экспериментально для той области концентраций, где сохраняется линейная зависимость диэлектрической постоянной от концентрации. Распределение этой суммы на ее составляющие проводят в соответствии с характером влияния катионов и анионов на вращательное движение молекул воды в первом гидратном слое.
находят экспериментально для той области концентраций, где сохраняется линейная зависимость диэлектрической постоянной от концентрации. Распределение этой суммы на ее составляющие проводят в соответствии с характером влияния катионов и анионов на вращательное движение молекул воды в первом гидратном слое.
А.Г. Пасынский с сотрудниками определил числа гидратации для ряда ионов, измеряя коэффициенты объемного сжатия по скорости распространения ультразвука в растворе и предполагая, что коэффициент объемного сжатия первичного гидратного слоя равен нулю, а ионы ![]() и
и ![]() полностью лишены первичной гидратной оболочки [4].
полностью лишены первичной гидратной оболочки [4].
Берналом и Фаулером рассчитаны сольватные числа исходя из структуры кристаллогидратов. Мищенко определил их по соотношению радиуса сольватированного иона и радиуса молекулы воды [4].
