
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
3.6. Определение теплот гидратаций ионов
Нам представляется возможным решение задачи определения теплот гидратации на основе следующих рассуждений [92].
Рассматривается некоторый положительный ион Ktz+ с зарядом ![]() или отрицательный ион Anz–. Перемещение рассматриваемого иона из вакуума в диэлектрическую среду сопровождается образованием сольватного комплекса из самого иона и ns молекул растворителя. В случае если растворителем является вода, то наблюдаемое ион-дипольное взаимодействие, сопровождается образованием гидратной оболочки из
или отрицательный ион Anz–. Перемещение рассматриваемого иона из вакуума в диэлектрическую среду сопровождается образованием сольватного комплекса из самого иона и ns молекул растворителя. В случае если растворителем является вода, то наблюдаемое ион-дипольное взаимодействие, сопровождается образованием гидратной оболочки из ![]() диполей молекул воды. Устойчивые состояния такого сольватного комплекса требуют ориентации молекул растворителя таким образом, чтобы их дипольные моменты совпадали с направлением поля центрального иона. Данный процесс требует затраты работы, равной убыли электрической энергии самого иона, что предопределяет диэлектрическую экранировку заряда:
диполей молекул воды. Устойчивые состояния такого сольватного комплекса требуют ориентации молекул растворителя таким образом, чтобы их дипольные моменты совпадали с направлением поля центрального иона. Данный процесс требует затраты работы, равной убыли электрической энергии самого иона, что предопределяет диэлектрическую экранировку заряда:
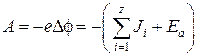 ,
,
где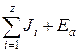 – сумма потенциалов ионизаций и энергий атомизаций, определяющих образование иона
– сумма потенциалов ионизаций и энергий атомизаций, определяющих образование иона ![]() .
.
Согласно закону сохранения энергии, данное уменьшение собственной энергии иона идет на приращение электрической энергии всего гидратного комплекса за счет возникающих квазиупругих сил [80]:
![]() .
.
Поскольку речь идет о приращении энергии, то знак перед правой частью равенства является положительным.
Если диэлектрик находится в изобарно-изотермических условиях, то избыток работы ![]() передается макроскопическому окружению в виде тепла
передается макроскопическому окружению в виде тепла ![]() . В таких условиях сольватный комплекс является термодинамически открытой системой, для которого справедливо основное уравнение термодинамики открытых систем:
. В таких условиях сольватный комплекс является термодинамически открытой системой, для которого справедливо основное уравнение термодинамики открытых систем:
![]() . (3.17)
. (3.17)
Приведенная выше последовательность событий формализуется известным выражением:
![]() . (3.18)
. (3.18)
Введение температуры ![]() в формулу (3.17) делает ее эквивалентной выражению (3.18), что является следствием физического содержания производства энтропии
в формулу (3.17) делает ее эквивалентной выражению (3.18), что является следствием физического содержания производства энтропии ![]() и потока энтропии
и потока энтропии ![]() .
.
Подставляя в (3.18) значения ![]() ,
, ![]() и имея в виду, что
и имея в виду, что ![]() есть искомая теплота гидратации, получаем уравнение:
есть искомая теплота гидратации, получаем уравнение:
![]() . (3.19)
. (3.19)
Далее, воспользуемся равенством ![]() , откуда следует
, откуда следует ![]() . Тогда
. Тогда
![]() ,
,
где ![]() – изменение энтропии;
– изменение энтропии; ![]() – изменение энтропии для одного моля растворителя при переходе его из жидкого состояния при отсутствии иона в сольватный комплекс, где состояние молекул растворителя адекватно их состоянию в структуре льда [4].
– изменение энтропии для одного моля растворителя при переходе его из жидкого состояния при отсутствии иона в сольватный комплекс, где состояние молекул растворителя адекватно их состоянию в структуре льда [4].
Таким образом, искомое выражение для теоретических оценок теплот гидратаций ионов имеет следующий вид:
![]() . (3.20)
. (3.20)
Результаты теоретических оценок ![]() для водных растворов приведены в табл. 3.3.
для водных растворов приведены в табл. 3.3.
Таблица 3.3
Результаты теоретических оценок теплот гидратации ![]() ионов
ионов
при Т = 298К
|
Ионы |
|
|
|
|
|
|
5,72 |
520 |
469 |
531 |
|
|
4,04 |
496 |
460 |
422 |
|
|
2,92 |
419 |
393 |
339 |
|
|
2,60 |
403 |
380 |
339 |
|
|
2,73 |
376 |
355 |
280 |
|
|
1,67 |
336 |
321 |
351 |
|
|
1,50 |
313 |
299 |
318 |
|
|
1,28 |
286 |
275 |
280 |
Из приведенной таблицы видно, что между результатами расчетов и литературными данными имеются значительные расхождения. Но поскольку справочные данные найдены делением суммы ![]() , определяемой из энергии кристаллической решетки
, определяемой из энергии кристаллической решетки ![]() и теплот растворения
и теплот растворения ![]() , на ионные составляющие путем достаточно произвольных допущений, представляется более целесообразно проверить достовер-
, на ионные составляющие путем достаточно произвольных допущений, представляется более целесообразно проверить достовер-
ность ![]() сравнением
сравнением ![]() с
с ![]() непосредственно. Это показано
непосредственно. Это показано
в табл. 3.4-3.6.
Величины ![]() ,
, ![]() и
и ![]() связаны между собой равенством [15]:
связаны между собой равенством [15]:
![]() .
.
Таблица 3.4
Результаты теоретических оценок суммарных теплот гидратаций ионов и их значения из экспериментальных энергий кристаллических решеток и теплот растворения
|
Электролит |
|
|
|
|
|
|
|
|
469 |
299 |
793 |
-49,02 |
768 |
744 |
|
|
460 |
299 |
766 |
-0,63 |
759 |
765 |
|
|
393 |
299 |
654 |
20,4 |
692 |
674 |
|
|
380 |
299 |
642 |
26,00 |
679 |
668 |
|
|
355 |
299 |
623 |
29,00 |
654 |
652 |
Таблица 3.5
Результаты теоретических оценок суммарных теплот гидратаций ионов и их значения из экспериментальных энергий кристаллических решеток и теплот растворения
|
Электролит |
|
|
|
|
|
|
|
|
469 |
321 |
830 |
-37,13 |
790 |
793 |
|
|
460 |
321 |
766 |
5,02 |
781 |
771 |
|
|
393 |
321 |
689 |
17,23 |
714 |
706 |
|
|
380 |
321 |
672 |
18,30 |
701 |
690 |
|
|
355 |
321 |
650 |
19,50 |
676 |
670 |
Таблица 3.6
Результаты теоретических оценок суммарных теплот гидратаций ионов и их значения из экспериментальных энергий кристаллических решеток и теплот растворения
|
Электролит |
|
|
|
|
|
|
|
|
469 |
275 |
759 |
- |
- |
- |
|
|
460 |
275 |
697 |
-6,44 |
735 |
691 |
|
|
393 |
275 |
644 |
20,5 |
668 |
667 |
|
|
380 |
275 |
624 |
27,8 |
655 |
652 |
|
|
355 |
275 |
593 |
35,6 |
630 |
629 |
Таким образом, предложенная нами теоретическая модель расчетов теплот гидратаций ионов, основанная на применении гидратных чисел позволяет получать результаты удовлетворительно соответствующие экспериментальным значениям энергий кристаллических решеток.
