
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
4.4. Определение коэффициентов диффузии растворов электролитов
Данная концепция оценки электропроводности и вязкости растворов электролитов может быть применима и для расчета коэффициента диффузии.
Согласно Дебаю и Фалькенгагену [113], в неравновесных условиях возможны гармонические колебания ионов. В процессах диффузии отсутствует внешняя сила, есть только градиент изменения концентрации ионов ![]() . Потенциальную энергию межионного взаимодействия можно представить равенством [98]:
. Потенциальную энергию межионного взаимодействия можно представить равенством [98]:
![]() , (4.22)
, (4.22)
где ![]() – заряд одного иона;
– заряд одного иона; ![]() – потенциал, создаваемый всеми остальными ионами в точке нахождения данного заряда
– потенциал, создаваемый всеми остальными ионами в точке нахождения данного заряда ![]() . Очевидно, что
. Очевидно, что ![]() . Тогда
. Тогда
![]() , (4.23)
, (4.23)
где коэффициент «1/2» показывает, что при суммировании ![]() , энергия
, энергия ![]() учитывается дважды. В этих условиях движение любых тел, в том числе и ионов при диффузии, согласно законам механики, возможно только лишь под действием силы
учитывается дважды. В этих условиях движение любых тел, в том числе и ионов при диффузии, согласно законам механики, возможно только лишь под действием силы ![]() в виде:
в виде:
![]() . (4.24)
. (4.24)
Следовательно, с учетом (4.23) выражение (4.24) можно дать в виде:
![]() .
.
Введем значение для эффективной силы ![]() :
:
![]() . (4.25)
. (4.25)
Согласно закону Стокса, в гидродинамике данная сила представляет собой силу вязкости (3.42), в которой ![]() – скорость дрейфа ионов по градиенту концентраций. Отсюда следует
– скорость дрейфа ионов по градиенту концентраций. Отсюда следует
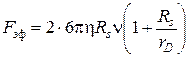 . (4.26)
. (4.26)
Известно, что отношение ![]() является стандартным понятием подвижности
является стандартным понятием подвижности ![]() :
:
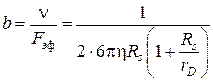 , (4.27)
, (4.27)
которая далее используется в законе Эйнштейна в виде:
![]() . (4.28)
. (4.28)
Таким образом, учитывая уравнение (4.27) и (4.21), получим уравнение для расчета коэффициента диффузии [114, 115], формализующих закон Эйнштейна–Стока:
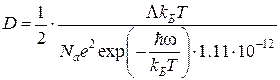 , см2·сек–1. (4.29)
, см2·сек–1. (4.29)
Рассчитанные значения коэффициентов диффузии ![]() по выражению (4.29) с использованием значений эквивалентных электропроводностей
по выражению (4.29) с использованием значений эквивалентных электропроводностей ![]() систематизированы в табл. 4.22–4.27 и на рис. 7–11. Для расчета использованы имеющиеся справочные данные электрической проводимости, общепринятые в химической термодинамике. Следует отметить, что справочные величины коэффициентов диффузии
систематизированы в табл. 4.22–4.27 и на рис. 7–11. Для расчета использованы имеющиеся справочные данные электрической проводимости, общепринятые в химической термодинамике. Следует отметить, что справочные величины коэффициентов диффузии ![]() отсутствуют для некоторых растворов электролитов.
отсутствуют для некоторых растворов электролитов.
Таблица 4.22
Концентрационная зависимость коэффициента диффузии
(![]() , см2·сек–1)
, см2·сек–1) ![]() при 291K и
при 291K и ![]() = 13,92
= 13,92
|
C, моль/л |
0,005 |
0,01 |
0,05 |
0,1 |
0,5 |
1 |
|
|
0,019 |
0,027 |
0,060 |
0,085 |
0,190 |
0,268 |
|
|
0,984 |
0,978 |
0,951 |
0,931 |
0,853 |
0,798 |
|
|
103,8 |
102 |
95,7 |
92 |
80,9 |
74,3 |
|
|
1,375 |
1,360 |
1,312 |
1,288 |
1,237 |
1,213 |
|
|
- |
- |
1,250 |
- |
1,200 |
- |
Таблица 4.23
Концентрационная зависимость коэффициента диффузии
(![]() , см2·сек–1)
, см2·сек–1) ![]() при 298K и
при 298K и ![]() = 26,25
= 26,25
|
C, моль/л |
0,005 |
0,01 |
0,02 |
0,05 |
0,1 |
|
|
0,014 |
0,020 |
0,028 |
0,044 |
0,062 |
|
|
0,989 |
0,984 |
0,978 |
0,965 |
0,951 |
|
|
146,09 |
143,03 |
140,48 |
135,68 |
131,39 |
|
|
1,972 |
1,946 |
1,918 |
1,877 |
1,845 |
|
|
- |
- |
- |
- |
- |
Таблица 4.24
Концентрационная зависимость коэффициента диффузии
(![]() , см2·сек–1)
, см2·сек–1) ![]() при 298K и
при 298K и ![]() = 17,80
= 17,80
|
C, моль/л |
0,5 |
1 |
2 |
3 |
4 |
5 |
|
|
0,174 |
0,230 |
0,329 |
0,408 |
0,465 |
0,537 |
|
|
0,867 |
0,828 |
0,763 |
0,716 |
0,683 |
0,644 |
|
|
95,5 |
90 |
80 |
70,3 |
62 |
50,5 |
|
|
1,471 |
1,451 |
1,399 |
1,311 |
1,212 |
1,047 |
|
|
- |
- |
- |
- |
- |
- |
Таблица 4.25
Концентрационная зависимость коэффициента диффузии
(![]() , см2·сек–1)
, см2·сек–1) ![]() при 291K и
при 291K и ![]() = 5,77
= 5,77
|
C, моль/л |
0,005 |
0,01 |
0,05 |
0,1 |
0,5 |
1 |
|
|
0,029 |
0,042 |
0,093 |
0,132 |
0,294 |
0,416 |
|
|
0,976 |
0,966 |
0,925 |
0,895 |
0,781 |
0,705 |
|
|
93,9 |
92,1 |
86,1 |
82,4 |
70,7 |
63,4 |
|
|
1,255 |
1,243 |
1,213 |
1,199 |
1,179 |
1,172 |
|
|
- |
1,157 |
- |
- |
- |
1,064 |
Таблица 4.26
Концентрационная зависимость коэффициента диффузии
(![]() , см2·сек–1)
, см2·сек–1) ![]() при 298K и
при 298K и ![]() = 28,02
= 28,02
|
C, моль/л |
0,1 |
0,5 |
1 |
2 |
3 |
5 |
|
|
0,075 |
0,127 |
0,192 |
0,279 |
0,351 |
0,424 |
|
|
0,941 |
0,901 |
0,854 |
0,795 |
0,749 |
0,706 |
|
|
128 |
118 |
113 |
107 |
98,7 |
85 |
|
|
1,816 |
1,748 |
1,765 |
1,795 |
1,757 |
1,606 |
|
|
- |
1,86 |
1,91 |
2,09 |
- |
- |
Таблица 4.27
Концентрационная зависимость коэффициента диффузии
(![]() , см2·сек–1)
, см2·сек–1) ![]() при 291K и
при 291K и ![]() = 18,59
= 18,59
|
C, моль/л |
0,005 |
0,01 |
0,05 |
0,1 |
0,5 |
1 |
|
|
0,016 |
0,023 |
0,052 |
0,073 |
0,164 |
0,232 |
|
|
0,986 |
0,981 |
0,957 |
0,940 |
0,871 |
0,823 |
|
|
124,4 |
122,4 |
115,8 |
112 |
102,4 |
98,3 |
|
|
1,644 |
1,627 |
1,577 |
1,553 |
1,532 |
1,557 |
|
|
- |
- |
1,560 |
1,534 |
1,539 |
1,604 |
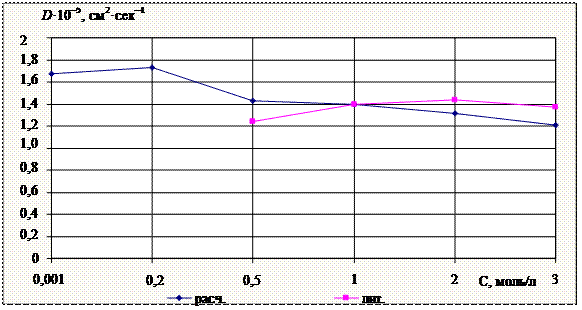

Рис. 7. Графическая зависимость коэффициента диффузии ![]() водного раствора
водного раствора ![]() от концентрации при 298K
от концентрации при 298K
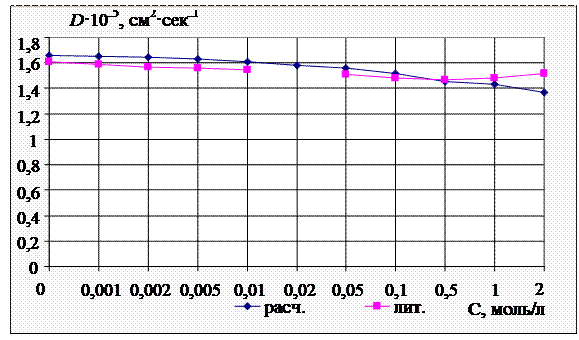

Рис. 8. Графическая зависимость коэффициента диффузии ![]() водного раствора
водного раствора ![]() от концентрации при 298K
от концентрации при 298K
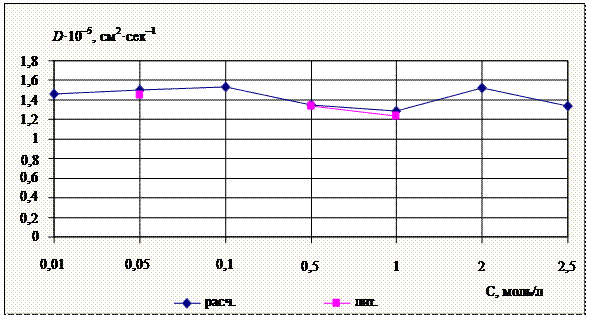

Рис. 9. Графическая зависимость коэффициента диффузии ![]() водного раствора
водного раствора ![]() от концентрации при 291K
от концентрации при 291K
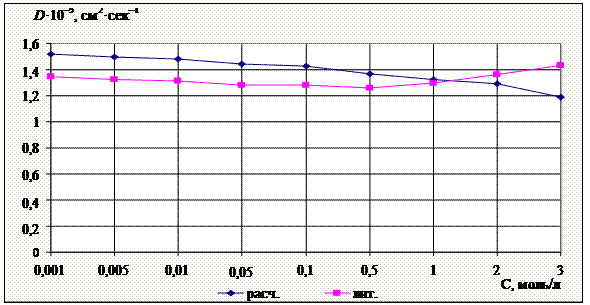

Рис. 10. Графическая зависимость коэффициента диффузии ![]() водного раствора
водного раствора ![]() от концентрации при 298K
от концентрации при 298K
