
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

ФЕРРИТЫ-ХРОМИТЫ ПЕРЕХОДНЫХ ЭЛЕМЕНТОВ: СИНТЕЗ, СТРУКТУРА, СВОЙСТВА
Иванов В В, Ульянов А К, Шабельская Н П,
2.1. Кинетика образования ферритов-хромитов цинка
Как следует из проведенного аналитического обзора, по синтезу сложных оксидных систем, содержащих катион Cr3+, имеется ограниченное количество публикаций. Наиболее изучены шпинели на основе феррита цинка. Данных по механизму и кинетике формирования шпинельной структуры составов на основе оксида хрома (III) или более сложных систем, содержащих оксиды железа (III), хрома (III), цинка, в литературе не приводится. Поэтому изучение особенностей формирования структуры шпинели в сложном твердом растворе состава ZnFe2–xCrxO4 является актуальной задачей. Эта система является удачной моделью для изучения механизма взаимодействия в сложной смеси оксидов, так как в ходе формирования структуры ZnFe2–xCrxO4 образуется непрерывный ряд твердых растворов замещения со структурой кубической шпинели; в данной системе на фазовой Т-х диаграмме не отмечено наличие каких-либо критических элементов (рис. 2.1) [91], что позволяет решить поставленную задачу – изучение механизма и кинетики формирования структуры – в модельных условиях.
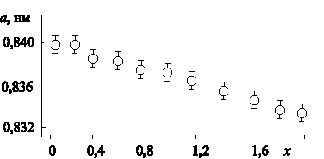
Рис. 2.1. Концентрационная зависимость параметра элементарной ячейки а твердых растворов ZnFe2–хCrхO4
Для приготовления образцов твердых растворов были составлены сырьевые смеси из оксидов железа (III), хрома (III) и цинка марки хч, отвечающие стехиометрическому соотношению компонентов ZnO, Fe2O3, Cr2O3 в твердых растворах шпинелей. Концентрация ионов Cr3 + изменялась от 0 до 100 мол. % через 10 мол. %. Исходные оксиды имели размер зерна не более 0,1 мм (проходили через сито 10000 отв./см2). Навеска исходных оксидов была тщательно перемешана в течение часа на воздухе и отформована в виде таблетки диаметром 20 мм под давлением 150 кг/см2. Синтезировали шпинели при температурах 800, 840, 860 и 900 °С. Термообработку проводили циклами по 10 часов (за исключением ZnFe2O4 и ZnCr2O4, для которых осуществляли дополнительные исследования состава через 5 часов). Полноту синтеза контролировали с помощью рентгенофазового анализа (РФА) на рентгеновском дифрактометре ДРОН-1,5. Для идентификации фаз использовали картотеку ASTM, параметры элементарных ячеек определяли по линии (440). На рис. 2.2 представлены типичные рентгенограммы образцов с параметром состава х = 0; 1,0; 2,0. Анализ рентгенограмм показывает, что образцы системы ZnFe2–хCrхO4 имеют структуру кубической шпинели. По мере замещения ионов Fe3+ ионами Cr3+ наблюдается закономерное увеличение значений межплоскостных расстояний (рис. 2.2): так, для самой интенсивной спектральной линии в ZnFe2O4 d = 0,2530 нм, в ZnFeCrO4 d = 0,2550 нм, в ZnCr2O4 d = 0,2560 нм.
На рис. 2.3 приведены рентгенограммы синтезированного при 900 °С образца шпинели с параметром х = 1,6 (формирование структуры шпинели в данном случае было наиболее длительно). Оценивалось количество шпинельной фазы и количество непрореагировавших оксидов. Видно, что после 20 часов термообработки наряду с продуктами взаимодействия и исходными оксидами на рентгенограмме присутствуют линии новой фазы (обозначенной фазой Z). Ее количество колеблется в пределах 5–10 %, а на начальном и заключительном этапе синтеза линии, характеризующие фазу Z, отсутствуют. Появление этой фазы можно связать, вероятно, с образованием твердых растворов состава Fe2–yCryO3 по следующему механизму. Как известно, наиболее вероятным является попарное взаимодействие исходных компонентов между собой. Реакция между тремя и более частицами одновременно не исключена, но менее вероятна. Итак, в результате взаимодействия в трехкомпонентной системе ZnO–Fe2O3–Cr2O3 возможны следующие реакции:
ZnO + Fe2O3 = ZnFe2O4
ZnO + Cr2O3 = ZnCr2O4
(2 – y)Fe2O3 + yCr2O3 = 2Fe2–yCryO3 (2.1)
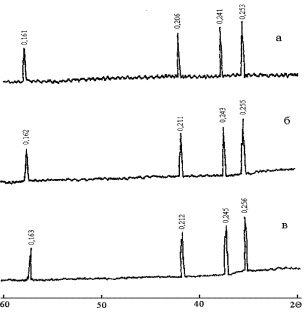
Рис. 2.2. Рентгенограммы образцов твердых растворов ZnFe2–xCrxO4:
а – x = 0,0; б – x = 1,0; в – x=2,0
Полученный твердый раствор оксида железа в оксиде хрома расходуется в процессе реакции с образованием шпинели:
Fe2–yCryO3 + ZnO = ZnFe2–yCryO4 (2.2)
В ходе синтеза шпинелей заданного состава было отмечено образование двух промежуточных фаз кубической шпинели [45] (аналогично наблюдаемому в [69]). На рентгенограмме образцов наблюдался эффект закономерного уширения и смещения центров тяжести линий с изменением х. Зависимость параметра элементарной ячейки a от содержания ионов хрома в составе твердого раствора ZnFe2–xCrxO4 на различных этапах синтеза приведена на рис. 2.4 [45]. По-видимому, здесь идет образование двух промежуточных фаз твердых растворов шпинельного типа с различным параметром a по реакциям (2.2) и
yZnFe2O4 + (2 – y)ZnCr2O4 = ZnFeyCr2–yO4 (2.3)

Рис. 2.3. Динамика синтеза шпинели ZnFe0,4Cr1,6O4.Продолжительность синтеза: а – 20 ч; б – 40 ч; в – 60 ч; г – 80 ч; д – 120 ч
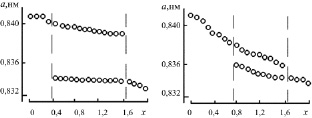
а б
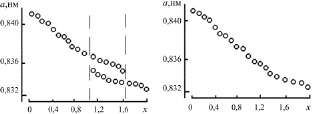
в г
Рис. 2.4. Изменение параметра решетки а твердых растворов ZnFe2–xCrxO4 в процессе синтеза. Продолжительность синтеза: а – 30 ч; б – 50 ч; в – 80 ч; г – 120 ч
При дальнейшей термообработке двухфазная область сужается. Происходит перераспределение ионов Fe3+ и Zn2+ по узлам кристаллической решетки (при этом изменяется параметр обращенности). Процесс формирования однофазной структуры завершается следующей реакцией:
хZnFe2–yCryO4 + (2 – x)ZnFeyCr2–yO4 = ZnFe2–xCrxO4.
Результаты анализа рентгенограмм приведены в табл. 2.1.
При расчете коэффициента диффузии D использовали формулу (1.1).
Расчет проводили, используя следующие допущения. В многокомпонентной смеси в случае твердофазного процесса один из компонентов «покрывает» другой. «Покрывающим» компонентом обычно является вещество, обладающее более низкой температурой плавления или большей подвижностью. В рассматриваемом случае это будет оксид цинка (см. п. 1.2.4). Решетку шпинели рассматривали как неподвижный кислородный каркас, в котором диффундирующие катионы металлов занимают окта- и тетраэдрические пустоты.
Таблица 2.1
Результаты анализа рентгенограмм смеси ZnО–Fe2О3–Cr2O3 в зависимости от продолжительности термообработки при 900 °С
|
Значения х |
Время обжига, ч |
Содержание, % по массе |
||||
|
Шпинель |
ZnO |
Fe2O3 |
Сr2О3 |
Фаза Z |
||
|
0,0 |
10 |
100 |
– |
– |
– |
– |
|
0,4 |
10 20 30 40 50 |
30 60 90 95 100 |
20 10 – – – |
20 10 – – – |
20 10 – – – |
10 10 10 5 – |
|
0,8 |
10 20 30 40 50 60 70 80 |
10 30 50 60 70 80 90 100 |
30 25 15 12 10 6 2 – |
30 25 15 12 10 6 2 – |
20 10 10 8 – – – – |
10 10 10 8 10 8 6 – |
|
1,2 |
10 20 30 40 50 60 70 80 90 100 |
5 10 15 30 50 70 90 95 95 100 |
35 30 25 25 15 10 3 – – – |
30 25 25 10 5 5 2 – – – |
30 30 25 25 15 10 3 – – – |
– 5 10 10 10 5 4 5 5 – |
|
1,6 |
10 20 30 40 50 60 70 80 90 100 110 120 |
5 7 12 20 30 50 80 85 90 95 95 100 |
33 32 30 25 20 15 10 10 5 – – – |
30 30 23 20 20 10 2 – – – – – |
32 31 30 30 20 15 3 – – – – – |
– – 5 5 10 10 5 5 5 5 5 – |
|
2,0 |
10 20 30 |
40 70 100 |
30 18 – |
– – – |
30 12 – |
– – – |
На практике диффузия является обычно результатом сочетания явлений: перемещения вещества в результате хаотического движения его частиц, вызванного кинетической энергией, и направленного их движения, обусловленного градиентом химического потенциала.
Температурную зависимость коэффициента диффузии вычисляли, используя уравнение Аррениуса (1.3): D = D0exp(–Q/(RT)). Пролагорифмировав последнее выражение, получим lnD0 = lnD + Q/(RT).
Результаты расчета D0 приведены в табл. 2.2. Эти величины имеют такой же порядок, как полученные в [167] данные по диффузии катионов цинка в монокристалл оксида магния (D0 = 1,48•10–5 см2/с).
Таблица 2.2
Данные для расчета коэффициента диффузии в твердом растворе ZnFe2–xCrxO4
|
Значения x |
T = 1073 K |
T = 1173 K |
Q, |
D0•105, см2/с |
||||
|
?•10–3, с |
D•1010, см2/с |
lgD |
?•10–3, с |
D•1010, см2/с |
lgD |
|||
|
0,0 |
108 |
2,315 |
–9,64 |
36 |
6,944 |
–9,16 |
115,61 |
9,767 |
|
0,2 |
324 |
0,772 |
–10,11 |
108 |
2,315 |
–9,64 |
113,20 |
2,545 |
|
0,4 |
540 |
0,463 |
–10,33 |
180 |
1,389 |
–9,86 |
113,20 |
1,527 |
|
0,6 |
540 |
0,463 |
–10,33 |
180 |
1,389 |
–9,86 |
113,20 |
1,527 |
|
0,8 |
828 |
0,302 |
–10,52 |
288 |
0,868 |
–10,06 |
110,79 |
0,745 |
|
1,0 |
828 |
0,302 |
–10,52 |
288 |
0,868 |
–10,06 |
110,79 |
0,745 |
|
1,2 |
1008 |
0,248 |
–10,61 |
360 |
0,694 |
–10,16 |
108,38 |
0,465 |
|
1,4 |
1116 |
0,224 |
–10,65 |
396 |
0,631 |
–10,20 |
108,38 |
0,423 |
|
1,6 |
1224 |
0,204 |
–10,69 |
432 |
0,579 |
–10,24 |
108,38 |
0,388 |
|
1,8 |
1152 |
0,217 |
–10,66 |
396 |
0,631 |
–10,20 |
111,63 |
0,590 |
|
2,0 |
324 |
0,772 |
–10,11 |
108 |
2,315 |
–9,64 |
113,20 |
2,544 |
Определение величины энергии активации диффузии Q проводили графическим методом по тангенсу угла наклона прямой в координатах lgD – 1/T (рис. 2.5). Данные для расчета приведены в табл. 2.2. Следовало ожидать, что с увеличением концентрации ионов Cr3+ в составе твердого раствора скорость диффузии будет уменьшаться (так как подвижность катионов уменьшается в ряду Zn2+ – Fe3+ – Cr3+ (см. п. 1.2.4)). Действительно, в интервале значений 0,4 ? x ? 1,6 концентрационная зависимость коэффициента диффузии (рис. 2.6) имеет линейный характер и монотонно уменьшается с увеличением параметра состава x. Однако в интервалах 0 ? x < 0,4 и 1,6 < x ? 2,0 наблюдали увеличение значения D (в 4–5 раз), что может быть связано с упрощением пути протекания процесса (отсутствуют реакции, описываемые уравнениями (2.1)–(2.3)). В пользу этого предположения свидетельствует и то, что в образцах с параметром х = 0 – 0,2 и 1,8 – 2,0 на рентгенограммах не проявляются линии, характерные для фазы Z (табл. 2.1).
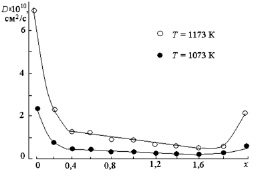
Рис. 2.6. Концентрационная зависимость коэффициента диффузии в твердых растворах ZnFe2–xCrxO4
Энергия активации процесса диффузии характеризуется избыточной кинетической энергией, которую приобретают элементы кристаллической решетки (чаще всего – катионы) для того, чтобы началось перемещение вещества по вакансионному механизму. Считается, что чем больше значение энергии активации, тем меньше (при прочих равных условиях) скорость реакции.
Согласно проведенным расчетам (табл. 2.2), энергия активации для всех составов различаются незначительно (отличие составляет порядка 6 %). Однако на концентрационной зависимости Q–x (рис. 2.7) можно выделить две области: I – наблюдается монотонное уменьшение энергии активации для интервала значений 0 ? x < 1,6 и II – значение Q для составов с параметром х ? 1,6 начинает увеличиваться. Такое поведение энергии активации может быть связано с изменением природы диффундирующих частиц. По-видимому, в интервале I диффузия осуществляется по типу (в) (рис. 1.2) за счет катионов Zn2+ и Fe3+, количество Zn2+ в составе твердого раствора увеличивается, что приводит к постепенному понижению энергетического барьера реакции. При x > 1,6 роль катионов Fe3+ становится несущественной, подвижность катионов Cr3+ ниже, и происходит смена механизма диффузии: в интервале II диффузия осуществляется по типу (а) (рис. 1.2).
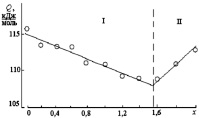
Рис. 2.7. Концентрационная зависимость энергии активации реакции
Для изученной реакции рассчитано значение температурного коэффициента скорости реакции по формуле
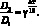 (2.4)
(2.4)
Для всех составов оно составляет ? = 1,108–1,116. На основании этого можно заключить, что при повышении температуры синтеза шпинелей ZnFe2–xCrxO4 на 10 градусов происходит увеличение скорости реакции приблизительно на 10 %.
Таким образом, в ходе изучения механизма и кинетики формирования структуры шпинели состава ZnFe2–xCrxO4 выявлено, что в процессе термообработки наблюдается образование твердого раствора оксида железа в оксиде хрома; в составах, близких к «чистым» ферриту и хромиту двухвалентных металлов указанный твердый раствор не образуется. Это приводит к снижению значений величины коэффициента диффузии для твердых растворов шпинелей ZnFe2–xCrxO4 в составах, обогащенных хромом. Для изученных составов рассчитаны значения энергии активации диффузии. На концентрационной зависимости Q выделены две области, которые могут быть связаны с различным механизмом диффузии. Проведен расчет величины предэкспоненциального множителя в выражении температурной зависимости коэффициента диффузии. Установлено, что повышение температуры термообработки исходной шихты на 10 К вызывает увеличение скорости реакции приблизительно на 10 %.