
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

ФЕРРИТЫ-ХРОМИТЫ ПЕРЕХОДНЫХ ЭЛЕМЕНТОВ: СИНТЕЗ, СТРУКТУРА, СВОЙСТВА
Иванов В В, Ульянов А К, Шабельская Н П,
2.3. Кинетика образования ферритов-хромитов никеля (II)
Твердые растворы состава NiFe2–xCrxO4 представляют интерес как магнитострикционные материалы [69]. На Т-х диаграмме шпинелей этой системы в зависимости от условий могут существовать четыре фазы (рис. 2.13): кубическая К (Fd3m), две тетрагональные – Т1 (I41/amd, c/a < 1) и Т2 (I41/amd, c/a > 1), ромбическая R (Fddd). Теоретические аспекты образования фаз с пониженной симметрией из кубической рассмотрены в ряде работ [169–177]. Фазовый переход кубическая – тетрагональная шпинель является переходом типа смещения. При этом часть анионов кислорода смещается из положений, характеризующих кубическую структуру, образуя тетрагонально удлиненный (c/a > 1) (рис. 2.14, б) или тетрагонально укороченный (c/a < 1) полиэдр (рис. 2.14, в).
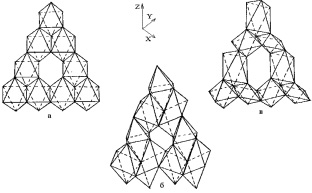
Рис. 2.14. Фрагмент шпинельной структуры с октаэдрическоой пустотой шпинели:
а – кубическая Fd3m-фаза; б – тетрагональная I41/amd c c/a > 1; в – тетрагональная I41/amd c c/a < 1
Для комнатной температуры концентрационная зависимость параметра элементарной ячейки твердых растворов NiFe2–xCrxO4 имеет вид, представленный на рис. 2.15. В состав этих шпинелей входит ян-теллеровский катион Ni2+. Установлено [38–40], что в интервалах 0 < х < 1,2 и 1,4 < х < 1,9 твердые растворы NiFe2–xCrxO4 кристаллизуются в пространственной группе Fd3m и относятся к структурному типу шпинели. Изменение параметра элементарной ячейки в зависимости от концентрации ионов хрома в феррите-хромите никеля (II) не удовлетворяет закону Вегарда. Это может быть обусловлено перераспределением по катионным подрешеткам ионов железа и никеля при увеличении х, а также изменением их электронной структуры в процессе образования твердого раствора NiFe2–xCrxO4. Закономерное непрерывное изменение параметра кубической элементарной ячейки а от состава в интервале 0 < х < 1,1 завершается скачком ?а = 0,003 нм при переходе от образца NiFe0,9Cr1,1O4 к образцу NiFe0,8Cr1,2O4. Кроме того, аналогичный по величине скачок на зависимости а(х) отмечен также при х в интервале от 1,4 до 1,5. Эти эффекты связаны, по-видимому, с двумя последовательными структурными превращениями феррита NiFe2–xCrxO4 из кубической Fd3m в тетрагональную Т1 фазу (при х = 1,2), а затем обратно в кубическую (при х = 1,4) (рис. 2.15). Степень тетрагональности феррита-хромита никеля (II), рассчитанная по параметрам а = 0,829 нм и с = 0,827 нм равна примерно 0,998, что совпадает с известными данными по NiFe0,8Cr1,2O4 [41]. Понижение симметрии кристаллов шпинелей NiFe2–xCrxO4 в интервале 1,2 ? х ? 1,4 вызвано присутствием ян-теллеровского иона Ni2+ в В-узлах. При х = 2,0 хромит никеля (II) имеет структуру тетрагональной шпинели со степенью тетрагональности c/a > 1 [119]. Это искажение вызывает катион Ni2+ в А-позиции.
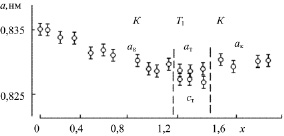
Рис. 2.15. Концентрационная зависимость параметра элементарной ячейки а твердых растворов NiFe2–хCrхO4
Образцы твердых растворов NiFe2–xCrxO4 были получены из оксидов железа (III), хрома (III) и никеля (II) марки хч по методике, приведенной выше (п. 2.1). Синтез образцов был осуществлен при температурах 1100, 1150 и 1200 °С. Параметры элементарных ячеек определяли по линии (440) (кубическая фаза), (440) и (404) (тетрагональная фаза). На рис. 2.16 приведены рентгенограммы образцов с параметром состава х = 0,0; 1,3; 1,9, синтезированных при температуре 1200 °С. Анализ рентгенограмм показывает, что образцы имеют структуру кубической шпинели при значениях параметра состава 0 < х ? 1,1 и 1,5 ? х < 2. Изоморфное замещение ионов железа (III) ионами хрома (III) приводит к увеличению межплоскостных расстояний (рис. 2.16, а, в). В тетрагональной фазе 1,2 ? х ? 1,4 (рис. 2.16, б) наблюдается появление дополнительной линии с d = 0,2104 нм и расщепление наиболее интенсивной спектральной линии с d = 0,2492 нм.
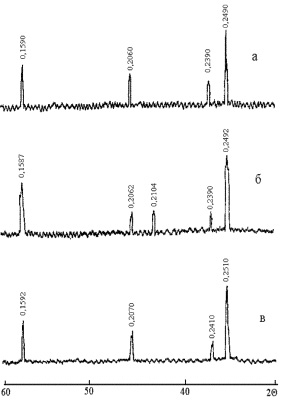
Рис. 2.16. Рентгенограммы образцов твердых растворов NiFe2–xCrxO4:
а – x = 0; б – x = 1,3; в – x = 1,9
При расчете коэффициента диффузии D использовали формулу (1.2). Результаты расчета приведены в табл. 2.4 и представлены на рис. 2.17. При расчете величины v использовали отношение плотности оксида двухвалентного металла (?NiO = 7,45 г/см3 [168]) к величине рентгеновской плотности ?рент шпинельного твердого раствора по [39]. Величина коэффициента диффузии феррита никеля (II) при температуре 1200 °С (D = 1,99•10–9 см2/с) хорошо согласуется с рассчитанной при 1255 °С по методу Больцмана-Матано для NiFe2O4 D = 2,2•10–9 см2/с [73].
Таблица 2.4
Данные для расчета коэффициента диффузии в твердом растворе NiFe2–xCrxO4
|
Значения x |
Относительное увеличение объема продукта v |
T = 1373 K |
T = 1473 K |
Q, |
D0•103, см2/с |
||||
|
?•10–3, с |
D•1010, см2/с |
lgD |
?•10–3, с |
D•1010, см2/с |
lgD |
||||
|
0,0 |
1,395 |
54 |
6,637 |
–9,18 |
18 |
19,912 |
–8,70 |
173,32 |
2,789 |
|
0,2 |
1,385 |
216 |
1,671 |
–9,78 |
72 |
5,014 |
–9,30 |
183,81 |
1,654 |
|
0,4 |
1,375 |
324 |
1,122 |
–9,95 |
108 |
3,367 |
–9,47 |
179,98 |
0,812 |
|
0,6 |
1,367 |
540 |
0,677 |
–10,17 |
180 |
2,032 |
–9,69 |
183,81 |
0,670 |
|
0,8 |
1,355 |
648 |
0,569 |
–10,24 |
252 |
1,464 |
–9,83 |
183,81 |
0,483 |
|
1,0 |
1,352 |
864 |
0,428 |
–10,37 |
288 |
1,284 |
–9,89 |
191,47 |
0,792 |
|
1,2 |
1,335 |
1152 |
0,325 |
–10,49 |
324 |
1,156 |
–9,94 |
218,28 |
6,364 |
|
1,4 |
1,330 |
1152 |
0,326 |
–10,49 |
324 |
1,160 |
–9,94 |
218,28 |
6,386 |
|
1,6 |
1,347 |
1008 |
0,368 |
–10,43 |
324 |
1,146 |
–9,94 |
187,64 |
0,517 |
|
1,8 |
1,347 |
540 |
0,687 |
–10,16 |
180 |
2,026 |
–9,69 |
183,81 |
0,668 |
|
2,0 |
1,340 |
108 |
3,455 |
–9,46 |
36 |
10,365 |
–8,98 |
183,81 |
3,420 |
На рис. 2.17 приведены концентрационные зависимости энергии активации (Q) и коэффициента диффузии (D). Согласно [85], формирование структуры хромита никеля (II) происходит за счет диффузии катионов хрома (III). Поскольку энергия связи Cr3+–O (190,1 кДж/экв) значительно больше энергии связи Fe3+–O (137,0 кДж/экв) [168], можно предположить, что в случае составов, обогащенных Fe3+, формирование структуры шпинели будет происходить преимущественно за счет диффузии трехвалентного катиона (по типу б, рис. 1.2). В связи с этим, следовало ожидать увеличения значений Q для всех шпинелей NiFe2–хCrхO4 с увеличением х. Такая зависимость Q(х) отмечена для 0 ? х < 1,6. Однако при х ? 1,6 наблюдается некоторое снижение энергии активации диффузии. Это может быть связано с тем, что в составах с заметным преобладанием ионов Cr3+, этот катион также начинает принимать участие в процессе диффузии.
В области существования тетрагональной фазы отмечено значительное увеличение энергии активации диффузии (на 12–13 %). По-видимому, в этом интервале составов возникают дополнительные кинетические затруднения. Аналогичный скачок отмечен на зависимости D0(х) (приблизительно в 6 раз) (табл. 2.4). Для объяснения такого хода кривых Q(х) и D0(х) мы предположили, что на кинетику процесса оказывает влияние структурный фактор. В связи с тем, что синтез шпинели проводили циклами по 10 часов, реально процесс формирования структуры также протекал дискретно. За 10 часов (36000 с) при коэффициенте диффузии (для оценочного расчета приняты: температура 1200 °С, образец NiFe0,8Cr1,2O4) D = 1,156•10–10 см2/c слой образовавшегося продукта составил 1,156•10–10см2/с·36000 с = 4,16•10–6 см2. Площадь поверхности зерна исходных оксидов для рассматриваемых условий Sз = ?dз2 = 3,14•(0,01 см)2 = 3,14•10–4 см2. Таким образом, за 10 часов (один цикл термообработки) слой образовавшегося продукта покрыл зерно на (4,16•10–6/3,14•10–4)•100 ? 1,3 % (рис. 2.18). При понижении температуры (охлаждении) под действием эффекта ЯТ структура искажается, образуется тетрагонально укороченная шпинель. По-видимому, в такой структуре за счет искажения кислородного каркаса (рис. 2.14, в) возникают дополнительные трудности для диффузии катионов по вакантным местам. В ходе последующих циклов нагревания процесс диффузии по «узким» местам приостанавливается до тех пор, пока повышение температуры термообработки не снимет искажение решетки (проявление эффекта ЯТ). Вследствие этого явления, по-видимому, скорость реакции формирования структуры в целом понижается.
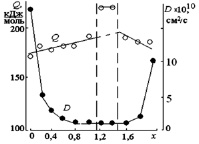
Рис. 2.17. Концентрационные зависимости энергии активации диффузии (Q) и коэффициента диффузии при температуре 1200 °С (D) в шпинелях NiFe2–xCrxO4
Если в ходе синтеза образуется тетрагонально удлиненная структура шпинели, это, вероятно, приведет к облегчению диффузионных процессов при последующих циклах термообработки. По-видимому, с этим связано расхождение в полученных значениях коэффициента диффузии для составов, близких к хромиту никеля (II). Как было отмечено ранее на примере твердых растворов
MFe2–xCrxO4 (M = Co, Zn), для составов, близких к «чистым» ферриту и хромиту двухвалентных катионов, наблюдается увеличение значений D в 4–5 раз. В случае твердых растворов NiFe2–xCrxO4 это правило выполняется только для составов, близких к ферриту никеля (II): увеличение значений D составляет 4,9–5,9 раз. Для составов, близких к хромиту никеля (II) увеличение значений D составило до 10 раз (табл. 2.4, рис. 2.17).
Для твердых растворов NiFe2–xCrxO4 рассчитаны значения температурного коэффициента скорости реакции ?. Величина ? составила 1,099 – 1,135.
Таким образом, в ходе изучения процессов формирования структуры твердых растворов NiFe2–xCrxO4 выявлено, что энергия активации процесса диффузии увеличивается с уменьшением содержания катионов Fe3+ в составе твердого раствора. В области формирования тетрагональной фазы с параметром c/a < 1 отмечено аномальное увеличение значений Q (на 12–13 %) и D0 (примерно в 6 раз), что может быть связано с кинетическими затруднениями, возникающими вследствие образования продукта с искаженной структурой, препятствующей диффузии катионов в зону реакции при последующих циклах термообработки. Величина температурного коэффициента скорости реакции имеет близкое значение с полученными для твердых растворов MFe2–xCrxO4 (M = Co, Zn).