
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

ФЕРРИТЫ-ХРОМИТЫ ПЕРЕХОДНЫХ ЭЛЕМЕНТОВ: СИНТЕЗ, СТРУКТУРА, СВОЙСТВА
Иванов В В, Ульянов А К, Шабельская Н П,
3.1. Формирование структуры шпинели по керамической технологии с введением в шихту галогенида щелочного металла
Из проведенного аналитического обзора и результатов изучения процессов формирования структуры в ходе топохимических реакций следует, что лимитирующей стадией в случае твердофазового спекания является перенос вещества в зону реакции. В данном случае процесс протекает в диффузионной области. Для повышения скорости реакции следует переводить процесс из диффузионной в кинетическую область. Наиболее доступным способом достижения такого результата является введение в состав шихты галогенида щелочного металла. Ранее было изучено влияние добавок анионов F–, Cl–, Br–, I– на процесс формирования структуры в системах ZnO–Fe2O3, NiO–Fe2O3, ZnO–Al2O3 [26, 27]. Сведений о механизме действия добавок галогенид-ионов на составы, содержащие Cr3+, в литературе не приводится. В указанных работах отмечено, что ускоряющее действие галогенид-ионов уменьшается в ряду F– > Cl– ? Br–, влияние I– несущественно. Для детального изучения действия галогенид-ионов в качестве добавки был выбран хлорид калия марки хч как наиболее доступный, дешевый и экологически безопасный.
Система ZnFe2–xCrxO4. Для изучения механизма и кинетики воздействия добавки хлорида калия на процесс образования шпинелей были выбраны образцы ZnFe2O4, ZnCr2O4, ZnFe0,4Cr1,6O4. Навески исходных оксидов были отвешены в соответствии со стехиометрическим соотношением компонентов, в состав шихты вводили 0,5–1 % (масс.) хлорида калия (сверх 100 %). Шихту тщательно гомогенизировали в течение часа на воздухе в присутствии этилового спирта, брикетировали в таблетки диаметром 20 мм под давлением 150 кг/см2 и обжигали при температуре 800 и 900 °С. Термообработку проводили в один прием, интервал исследования полноты протекания реакции – 0,5 часа [178]. Полноту синтеза контролировали с помощью РФА на рентгеновском дифрактометре ДРОН-1,5. Для идентификации фаз использовали картотеку ASTM, параметры элементарных ячеек определяли по линии (440). В табл. 3.1 приведены данные по исследованию процессов образования структуры.
Таблица 3.1
Данные для расчета энергии активации в системе ZnFe2–xCrxO4
|
Значения х |
T = 1073 K |
T = 1173 K |
Q, |
||||
|
?, с |
D•109, см2/с |
lgD |
?, с |
D•109, см2/с |
lgD |
||
|
0,0 |
7200 |
3,630 |
–8,440 |
3600 |
7,256 |
–8,139 |
72,95 |
|
1,6 |
18000 |
1,436 |
–8,843 |
9000 |
2,871 |
–8,542 |
72,95 |
|
2,0 |
14400 |
1,785 |
–8,748 |
7200 |
3,571 |
–8,447 |
72,95 |
Согласно проведенным исследованиям, скорость формирования структуры шпинели увеличивается при температуре термообработки 900 °С в 48 раз. Это может быть связано с изменением механизма процесса. По-видимому, в реакции участвует газовая фаза, в основном хлориды калия и цинка, и процесс протекает по схеме, описываемой реакциями (1.4)–(1.7). Для проверки этого предположения была проведена термообработка брикетированных образцов оксидов, разделенных алундовыми палочками. Зазор между таблетками составлял 2 мм. В навески оксидов двухвалентных металлов добавляли хлорид калия 0,5–1 % (масс.). Пары таблеток устанавливали на керамической подложке, изолировали от соседних и помещали в рабочее пространство печи (рис. 3.1). Термообработку проводили в течение 8 часов при температуре 900 °С. По окончании эксперимента провели анализ поверхности таблеток на наличие шпинельной фазы. Результаты эксперимента приведены в табл. 3.2.
Таблица 3.2
Роль газовой фазы в процессе формирования структуры шпинели ZnFe2–xCrxO4
|
Состав |
Наличие шпинельной фазы |
||
|
Верхняя таблетка |
Нижняя |
На верхней |
На нижней |
|
ZnO + KCl |
Fe2O3 |
нет |
есть |
|
ZnO + KCl |
0,5 Fe2O3 + 0,5 Cr2O3 |
нет |
есть |
|
ZnO + KCl |
Cr2O3 |
нет |
есть |
Таким образом, введение в состав исходной шихты хлорида калия направляет процесс синтеза по другому пути: вместо твердофазового мы имеем дело со спеканием с участием газовой фазы. Наличие газа облегчает перенос исходных оксидов в зону реакции и тем самым переводит процесс из диффузионной области в кинетическую. При этом энергия активации реакции значительно снижается (на 32–36 %, табл. 2.2 и 3.1).
По-видимому, ионы Cl– создают более рыхлый слой продукта. Это облегчает процесс диффузии исходных веществ через слой образовавшейся дефектной шпинели и тем самым ускоряет протекание реакции в целом. В пользу такого предположения свидетельствует тот факт, что в ходе изучения образцов шпинелей, полученных при введении в состав шихты хлорида калия выявлено, что таблетки увеличены в объеме, иногда на их поверхности были видны трещины (обычно для составов с преобладанием катионов железа (III)); пористость таких образцов оказывается выше (см. главу 4). Значения параметра элементарной ячейки совпадают по величине с рассчитанными для шпинелей, полученных в ходе топохимических реакций (при равных температурах термообработки).
Система CoFe2–xCrxO4. Образцы готовили аналогично описанному выше для системы ZnFe2–xCrxO4. В ходе изучения процессов фазообразования установлено, что формирование структуры шпинели для всех образцов твердых растворов CoFe2–xCrxO4 занимает не более 4 часов. Таким образом, достигнуто сокращение длительности термообработки в 100 раз.
Для установления участия в реакции газовой фазы провели эксперимент, аналогичный описанному для системы ZnFe2–xCrxO4. Результаты эксперимента приведены в табл. 3.3.
Таблица 3.3
Роль газовой фазы в процессе формирования структуры шпинели CoFe2–xCrxO4
|
Состав |
Наличие шпинельной фазы |
||
|
Верхняя |
Нижняя |
На верхней |
На нижней таблетке |
|
CoO + KCl |
Fe2O3 |
нет |
есть |
|
CoO + KCl |
0,5 Fe2O3 + 0,5 Cr2O3 |
нет |
следы |
|
CoO + KCl |
Cr2O3 |
нет |
следы |
Незначительное количество шпинельной фазы, обнаруженное в случае хромита и феррита-хромита кобальта (II) может быть объяснено недостаточной продолжительностью термообработки.
Система NiFe2–xCrxO4. Для изучения механизма и кинетики воздействия добавки хлорида калия на процесс образования шпинелей были выбраны образцы NiFe2O4, NiFeCrO4, NiFe0,6Cr1,4O4, NiCr2O4. Готовили образцы аналогично ZnFe2–xCrxO4. В табл. 3.4 приведены данные по исследованию процессов образования структуры.
Таблица 3.4
Данные для расчета энергии активации в системе NiFe2–xCrxO4
|
Значения |
T = 1173 K |
T = 1273 K |
Q, |
||||
|
?, с |
D•109, см2/с |
lgD |
?, с |
D•109, см2/с |
lgD |
||
|
0,0 |
10800 |
3,319 |
–8,479 |
5400 |
6,637 |
–8,178 |
86,00 |
|
1,0 |
21600 |
1,712 |
–8,766 |
9000 |
4,109 |
–8,386 |
108,60 |
|
1,4 |
25200 |
1,492 |
–8,826 |
10800 |
3,481 |
–8,458 |
105,17 |
|
2,0 |
14400 |
2,591 |
–8,586 |
7200 |
5,182 |
–8,285 |
86,00 |
Согласно проведенным исследованиям, скорость формирования структуры шпинели увеличивается в 13 раз при одновременном снижении температуры термообработки на 300 градусов. Энергия активации реакции шпинелеобразования в присутствии хлорида калия снижается на 50 %. Такой результат может быть связан с изменением механизма процесса. В ходе проведения эксперимента с пространственным разделением исходных оксидов получены следующие результаты (табл. 3.5).
Таблица 3.5
Роль газовой фазы в процессе формирования структуры шпинели NiFe2–xCrxO4
|
Состав |
Наличие шпинельной фазы |
||
|
Верхняя |
Нижняя |
На верхней |
На нижней |
|
NiO + KCl |
Fe2O3 |
следы |
есть |
|
NiO + KCl |
0,5 Fe2O3 + 0,5 Cr2O3 |
следы |
следы |
|
NiO + KCl |
Cr2O3 |
есть |
есть |
Для объяснения результатов эксперимента можно предположить, что в процессе массопереноса участвует галогенид трехвалентного металла (Me) (аналогично реакциям (1.4)–(1.7)):
KCl (т) = KCl (г);
6KCl (г) + Me2O3 (т) = 2MeCl3 (г) + 3K2O;
2MeCl3 (г) + NiO (т) + 3H2O (г) = NiMe2O4 (т) + 6HCl (г);
6HCl (г) + Me2O3 (т) = 2MeCl3 (г) + 3H2O (г).
Изменение технологии синтеза привело к изменению параметров элементарной ячейки шпинелей (табл. 3.6) (по данным [39] и [97]).
Таблица 3.6
Параметры элементарной ячейки твердых растворов NiFe2–xCrxO4
|
Значение х |
Без KCl |
С добавкой 1 % (масс.) KCl |
||||
|
a, нм |
c, нм |
c/a |
a, нм |
c, нм |
c/a |
|
|
0,0 |
0,8350 |
0,8302 |
||||
|
0,4 |
0,8326 |
0,8301 |
||||
|
0,8 |
0,8310 |
0,8300 |
||||
|
1,2 |
0,8298 |
0,8281 |
0,9980 |
0,8283 |
0,8280 |
0,9996 |
|
1,6 |
0,8310 |
0,8300 |
||||
|
2,0 |
0,8030 |
0,8360 |
1,041 |
0,8230 |
0,8300 |
1,009 |
Как видно из табл. 3.6, изменение условий формирования шпинелей оказывает влияние не только на величину параметров с и а, но и на их отношение. Причина такого влияния может быть связана, по крайней мере, с двумя факторами: во-первых, анионы хлора могут встраиваться в решетку шпинели (что противоречит данным, полученным при анализе содержания хлорид-ионов в конечном продукте); во-вторых, температура термообработки понижается, а это также может вызвать изменение значений а и с. Наиболее вероятным представляется второй фактор, так как в случае твердых растворов MFe2–xCrxO4 (M = Co, Zn) изменения параметра решетки не было отмечено (а температура термообработки этих составов не изменялась). Полученный результат согласуется с данными, приведенными в [21] для марганец-цинковой феррошпинели: с повышением температуры закалки отмечено увеличение параметра кристаллической решетки а.
В процессе одностадийного синтеза шпинелей состава NiFe2–xCrxO4 с добавлением 0,5–1 % (масс.) хлорида калия не было замечено эффекта увеличения либо уменьшения продолжительности синтеза для фаз с пониженной симметрией.
Система CuFe2–xCrxO4. Образцы готовили, как и в случае системы ZnFe2–xCrxO4. В ходе изучения процессов формирования фаз установлено, что образование структуры для всех образцов твердых растворов CuFe2–xCrxO4 занимает не более 4 часов. Таким образом, достигнуто сокращение длительности термообработки в 70 раз.
Для установления участия в реакции газовой фазы провели эксперимент, аналогичный описанному для системы ZnFe2–xCrxO4. Результаты эксперимента приведены в табл. 3.7.
Таблица 3.7
Роль газовой фазы в процессе формирования структуры шпинели CuFe2–xCrxO4
|
Состав |
Наличие шпинельной фазы |
||
|
Верхняя таблетка |
Нижняя |
На верхней таблетке |
На нижней |
|
CuO + KCl |
Fe2O3 |
нет |
есть |
|
CuO + KCl |
0,5 Fe2O3 + 0,5 Cr2O3 |
нет |
есть |
|
CuO + KCl |
Cr2O3 |
нет |
есть |
Таким образом, введение в состав исходной шихты хлорида калия направляет процесс синтеза по другому пути: вместо твердофазового мы имеем дело со спеканием с участием газовой фазы.
Один из возможных механизмов формирования тетрагональной фазы шпинели может быть следующий.
Тетрагональную шпинель состава CuFe2O4 получали из оксидов CuO и ?-Fe2O3 квалификации «ч.д.а.» с добавлением на стадии гомогенизации хлорида калия квалификации «ч.». Оксиды в соотношении 1:1 (с точностью 5•10–5 г) гомогенизировали со спиртом на воздухе и брикетировали в таблетки диаметром 20 мм. Далее образцы помещали на керамической подложке в муфельную печь и обжигали при температуре 900 °С в течение 6,5, 13 и 20,5 ч [179].
Рентгенографический анализ образцов проводили с помощью дифрактометра ДРОН-3 (CoK?-излучение, Fe-фильтр). Параметры элементарных ячеек шпинелей определяли по линиям 400 и 224 для I41/amd-фазы, по линии 440 для Fd3m–фазы.
Экспериментально установлено, что в процессе трехстадийной термообработки смеси оксидов CuO и ?-Fe2O3 при температуре 900 °С в течение примерно 20 ч образцы, содержащие синтезированную шпинель CuFe2O4, не однофазны (рис. 3.2). Образцы содержат примесные фазы в виде CuO и ?-Fe2O3 в количестве примерно 5–6 % (масс.). После первой стадии термообработки в течение 6,5 ч в образцах кроме тетрагональной шпинели и исходных оксидов обнаружены следы кубической шпинелеподобной фазы, близкой по составу к ?-Fe2O3. В образцах после третьей стадии термообработки данная шпинелеподобная фаза не обнаружена. Содержание примесных фаз простых оксидов снижается до 3–4 %.
Установлен необычный характер изменения структурных параметров тетрагональной шпинели в процессе синтеза, проявляющийся в характере изменений степени тетрагональности (c/a) (1,055 > 1,052 > 1,053) и объема формульной единицы шпинели (0,07365 > 0,07372 > 0,07370 нм3), которые были определены после каждой стадии синтеза. Данная особенность формирования структуры связана, по-видимому, с изменением характера перераспределения катионов по узлам катионной подрешетки тетрагональной шпинели.
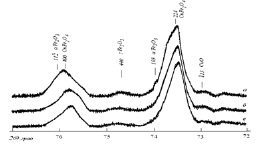
Рис. 3.2. Фрагменты дифрактограмм смеси оксидов CuO и Fe2O3 (1:1) после термообработки при 900 °С в течение 6,5 ч (а), 13 ч (б) и 20,5 ч (в) (отмечены линии тетрагональной шпинели и фаз исходных оксидов)
Факт образования на первой стадии синтеза дефектной шпинели, близкой по составу к кубической фазе ?-Fe2O3, позволяет предположить, что в распределении катионов по узлам решетки принимают участие и дефекты типа катионных вакансий ?. Для установления характера распределения катионов и вакансий в катионной подрешетке тетрагональной шпинели использовали методику, описанную в [123]. При определении степени обращенности ? тетрагональной шпинели использовали усредненный параметр 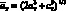 . Результаты расчетов представлены на рис. 3.3.
. Результаты расчетов представлены на рис. 3.3.
С учетом распределения катионов по тетраэдрическим и октаэдрическим позициям синтез бездефектной тетрагональной шпинели протекает по следующей схеме: CuO + Fe2O3 = (Cu1–?Fe?)[Fe2–?Cu?]O4.
В случае образования при синтезе дефектной шпинели состава ?-Fe2O3 процесс формирования тетрагональной шпинели может быть представлен следующим образом: CuO + 0,75 (Fe)[Fe1,667 ?0,333]O4 > (Cu1–?Fe?)[Fe2–?Cu?]O4. Он возможен за счет замещений 2Fe3 + + ? > 3Cu2+ в катионной подрешетке шпинели.
Если указанный процесс не протекает до конца, то в системе возможно образование дефектной тетрагональной шпинели:
CuO + 0,75(Fe)[Fe1,667?0,333]O4 > (Cu1–?Fe?)[Fe2–? + 2xCu?–3x?x]O4 + 3x CuO,
где x – параметр, характеризующий остаточную дефектность в структуре тетрагональной шпинели при ее образовании из дефектной кубической шпинели ?-Fe2O3. В этом случае часть оксида меди (II) окажется избыточной и должна присутствовать в образцах в виде примесной фазы.
Полученные результаты анализа не противоречат описанным выше экспериментальным данным по фазовому составу. Для синтезированной тетрагональной шпинели (Cu1–?Fe?)[Fe2–? + 2xCu?–3x?x]O4 после первой стадии синтеза параметры ? = 0,75 и x = 0,056. После второй и третьей стадии синтеза параметры ? и x принимают значения 0,725 ± 0,005 и 0,027 ± 0,006, соответственно (см. рис. 3.3). Относительное молярное содержание фазы CuO, равное 3x > 0,08, соответствует приблизительно 3 % (масс.), что практически совпадает с экспериментально зафиксированными значениями в образцах (3–4 %).
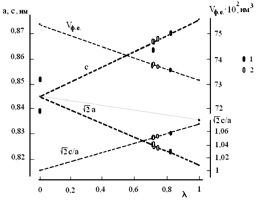
Рис. 3.3. Диаграммы «параметры ячейки a, c (объем формульной единицы Vф.е., степень тетрагональности (c/a)) – степень обращенности ?» для шпинелей вида (Cu1–?Fe?)[Fe2–? + 2xCu?–3x?x]O4 (обозначения: ? – данные работ [119, 123, 180], 2 – полученные в работе [179], штриховые линии отражают предполагаемое влияние степени обращенности тетрагональной шпинели на анализируемые параметры)
Отметим, что наличие в качестве примеси фаз ?- и ?-Fe2O3 в образцах после первичной термообработки может означать, что тетрагональная шпинель с остаточной дефектностью является промежуточной в следующем ряду фаз:
?-Fe2O3 > (Fe)[Fe1,667?0,333]O4 >
> (Cu1–?Fe?)[Fe2–? + 2xCu?–3x?x]O4 > (Cu1–?Fe?)[Fe2–?Cu?]O4.
Отметим также, что переход от частично дефектной тетрагональной шпинели (при ?= 0,725 и x = 0,027) к тетрагональной шпинели без дефектов (при ? = 0,725 и x = 0) сопровождается небольшими изменениями структурных характеристик. В связи с этим можно предположить и одновременное присутствие их в термообработанных при температуре 900 °С образцах в виде гомогенной смеси.