
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

Патогенетическое обоснование применения эпидермального фактора роста при термической травме
Лихачева А. Г., Телешева Л. Ф., Долгушин И. И., Осиков М. В.,
ЗАКЛЮЧЕНИЕ
Термическая травма (ТТ) представляет значимую медико-социальную проблему. Каждую минуту в мире один человек становится жертвой ожогов. 90–95 % ожогов – это доля термических травм. В Российской Федерации ожоги среди травм мирного времени занимают 4–5 место, составляя 550–600 тысяч в год. 71–91 % от общего числа пострадавших с ожогами составляют пациенты с нешокогенной ТТ с преимущественным поражением кожных покровов. Высокая летальность при ТТ обусловлена быстрым развитием полиорганной недостаточности в связи с интенсивной болевой импульсацией, гиповолемией и гемоконцентрацией, гипоксией, эндогенной интоксикацией, эскалацией процессов свободнорадикального окисления, а также изменением иммунного статуса организма [3, 7, 45, 110, 211 ]. При ТТ происходит изменение локальных и системных механизмов врожденного и адаптивного иммунитета, вторичный иммунодефицит является одним из ключевых звеньев в патогенезе ТТ [152, 160, 224, 256]. В литературе представлены обширные сведения об иммунологических аспектах патогенеза ТТ, включающие изменения активности клеточных и гуморальных факторов как in situ (кератиноцитов, нейтрофилов, дендритных клеток, тканевых базофилов, макрофагов, Т-клеток, тромбоцитов, фибробластов), так и на системном уровне (нейтрофилов, моноцитов, субпопуляций Т- и В-лимфоцитов, системы комплемента, иммуноглобулинов, цитокинов).
Понимание иммунологических аспектов патогенеза ТТ является предпосылкой для совершенствования методов диагностики и терапии, а также профилактики гнойно-септических осложнений, септического шока и полиорганной недостаточности в комбустиологии. Экспериментальное моделирование ТТ позволяет детально, в установленные сроки проследить динамику изменений иммунореактивности организма в сопоставлении с морфогенезом ожоговой раны, что позволяет с патогенетических позиций применять системные и локальные иммуномодуляторы не только для коррекции иммунного статуса, но и с целью цитопротекции, стимуляции репаративных процессов [152, 216]. В этом отношении неподдельный интерес вызывает эпидермальный фактор роста (ЭФР, EGF), его эффективность в плане заживления ожоговой раны, эпителизации и формирования рубцовой ткани после ТТ убедительно продемонстрирована в клинических и экспериментальных условиях [56, 73, 127, 149, 174, 180, 286, 297, 305, 306, 309]. EGF активирует пролиферацию и дифференцировку клеток в очаге ТТ, в первую очередь, фибробластов и эпидермоцитов, что способствует быстрому и качественному заживлению ран [123, 222]. Однако остаются не вскрытыми механизмы цитопротекторного действия EGF в отношении отдаленных от очага повреждения органов, связь локальных эффектов EGF с изменением иммунореактивности организма.
Нами установлены некоторые механизмы изменения иммунореактивности у больных после ТТ. При динамическом наблюдении отмечаются неоднозначные изменения количественного состава лейкоцитов и популяционного спектра лимфоцитов в периферической крови: увеличение количества нейтрофилов и моноцитов сочетается с лимфоцитопенией и эозинопенией. Лимфоцитопения обусловлена депрессией количественного представительства эффекторов клеточного и гуморального иммунитета: CD3+, CD4+, CD8+, CD22+. Нейтрофильный лейкоцитоз в периферической крови обусловлен активацией миелопоэза в ответ на поступление стимулирующих миелопоэз факторов из очага повреждения при ТТ. Одним из механизмов лимфоцитопении выступает усиление гибели лимфоцитов путем апоптоза, в кровотоке возрастает количество лимфоцитов, несущих маркер готовности и морфологические признаки апоптоза.
Основными регуляторами врожденного и адаптивного иммунитета при ТТ, изменяющими количественный состав и функциональную активность иммунокомпетентных клеток, гуморальных факторов в очаге воспаления, периферической крови, органах иммуногенеза и кроветворения, являются цитокины. При оценке цитокинового профиля крови у больных с ТТ обнаружены значимые изменения на 1–10 сутки, к 20 суткам концентрация цитокинов не отличалась от контрольной группы. Концентрация ИЛ-1β увеличивалась на 1 и 10 сутки наблюдения, уровень ИЛ-4 уменьшался на 1 сутки, а ИФН-γ – на 10 сутки наблюдения. На 10 сутки термической травмы у больных снижалась концентрация в сыворотке ЭФР. Концентрация ТФР-β1 статистически значимо не изменялась во все сроки наблюдения.
Установлено, что общее количество лейкоцитов, общее количество нейтрофилов, палочкоядерных и сегментоядерных нейтрофилов в периферической крови возрастает по мере повышения концентрации ИЛ-1β в сыворотке. Наиболее сильная положительная корреляция отмечена на 10 сутки после ТТ, что свидетельствует об известной стимуляции миелоидного ростка костного мозга этим провоспалительным цитокином после ТТ. Количество в кровотоке лимфоцитов, клеток, несущих общий маркер Т-лимфоцитов (CD3+), Т-хелперов (CD4+) и Т-цитотоксических (CD8+) снижается по мере снижения концентрации ИФН-γ в сыворотке. Показано, что снижение уровня ИФН-γ в сыворотке после ТТ обусловлено изменением кооперации макрофагов с CD4-лимфоцитами при участии белка B7-H1 (PD-L1) [272, 298].
Нами исследована секреторная активность мононуклеаров периферической крови у больных с ТТ. Секреция ИЛ-1β повышается на 1 и 10 сутки, продукция ИФН-γ снижается на 10 сутки наблюдения, производство ЭФР снижается на 10 сутки после ожога. Как видно, изменения секреторной активности мононуклеаров полностью совпадают с результатами по исследованию уровня цитокинов в сыворотке. Данный факт подтверждают сильные корреляционные связи между показателями.
Таким образом, у больных после ТТ развивается нейтрофильный лейкоцитоз и иммуносупрессия в связи с уменьшением количества эффекторов клеточного и гуморального иммунитета (CD3+, CD4+, CD8+, CD22+). Наряду с этим, повышено количество лимфоцитов, несущих маркер поздней активации (CD71+). Механизмами изменения иммунорективности при ТТ выступают усиление апоптоза лимфоцитов, увеличение концентрации в сыворотке и продукции мононуклеарами периферической крови ИЛ-1β, снижение – ИФН-γ.
Нами исследована иммунореактивность организма и особенности морфологии очага повреждения при экспериментальном моделировании ТТ. Для этого была отработана модель ТТ у крыс, унифицированная по глубине и площади поражениях кожи, которая позволила в установленные сроки проследить динамику изменений показателей врожденного и адаптивного иммунитета в сопоставлении с формированием и эволюцией морфологии ожоговой раны. По данным ряда авторов, крыса представляется приемлемым объектом для исследования иммунореактивности при ТТ [258].
При экспериментальной ТТ в периферической крови на 3–14 сутки
наблюдения развивается лейкоцитоз, обусловленный увеличением количества
нейтрофилов. Лимфоцитопения, зафиксированная на 7–14 сутки наблюдения,
вероятно, является следствием, как было показано выше у больных с ТТ,
во-первых, усиленной гибели лимфоцитов в кровотоке путем апоптоза,
во-вторых, уменьшением продукции одного из факторов пролиферации
лимфоцитов ИФН-γ. Наконец, нельзя исключить роли миграции лимфоцитов из
кровотока в очаг повреждения для участия в репаративных
реакциях.
Функциональная активность фагоцитов периферической крови при экспериментальной ТТ изменяется неоднозначно. С одной стороны, увеличивается поглотительная способность фагоцитов с 1 по 21 сутки наблюдения, при этом возрастает как количество активно фагоцитирующих клеток, так и интенсивность захвата объектов фагоцитоза по показателям интенсивности фагоцитоза и фагоцитарного числа. С другой стороны, спонтанный НСТ-тест возрастает на 1–14 сутки, а функциональный резерв фагоцитов, оцениваемый в индуцированном НСТ-тесте, снижается на 3–7 сутки наблюдения. Функциональная активность фагоцитов полностью восстанавливается к 28 суткам после ТТ. Следует отметить, что, по данным других исследователей, мониторинг НСТ-теста после ТТ имеет важную прогностическая роль: выживаемость крыс в эксперименте выше, если первоначально НСТ-тест повышается, а затем постепенно снижается, непрерывный рост НСТ-теста приводит к неблагоприятным исходам [287]. Кроме того, гиперергия нейтрофилов после ТТ лежит в основе развития эндотелиальной дисфункции и синдрома полиорганной недостаточности за счет воздействия АФК и ферментов лизосомального происхождения [251, 231]. Изменение реактивности нейтрофилов при ТТ связано с Тoll-подобными рецепторами (TLR), особенно TLR-2 и TLR-4 [202, 248].
При оценке адаптивного иммунитета при экспериментальной ТТ фиксируется иммунодепрессия. Клеточный иммунный ответ подавлен на 7–28 сутки наблюдения, гуморальный – снижается на 7–14 сутки после ТТ и восстанавливается к 21 суткам. По данным ряда исследователей, иммунодефицит после термической травмы у крыс обусловлен снижением количества Т-хэлперов и цитотоксических Т-лимфоцитов в связи со снижением продукции ИЛ-2 и ИФН-γ [151, 217].
Динамика клеточного представительства в очаге повреждения ТТ отражает известные закономерности его эволюции: на начальных этапах превалируют полинуклеарные лейкоциты, которые постепенно заменяются мононуклеарами и фибробластами. При исследовании микропрепаратов кожи у крыс на 7 сутки после ТТ клеточный состав представлен преимущественно полиморфно-ядерными лейкоцитами, лимфоцитами и гистиоцитами, в динамике наблюдения с 7 по 28 сутки прогрессивно снижается количество нейтрофилов, с 21 суток снижается количество лимфоцитов и гистиоцитов, с 14 суток эксперимента возрастает содержание фибробластов. Очевидно, что представительство и динамика клеточного состава очага повреждения при ТТ связаны с изменением клеточного состава лейкоцитов в периферической крови. По данным корреляционного анализа, количество нейтрофилов в очаге повреждения нарастает по мере их увеличения в периферической крови, а количество лимфоцитов в кровотоке уменьшается по мере увеличения их представительства в очаге.
Для мониторинга заживления ожоговой раны и его сопоставления с изменением иммунореактивности при ТТ нами использованы показатели площади ожоговой раны, уменьшение площади раневого дефекта относительно исходного размера на 1 сутки наблюдения, а также скорость эпителизации очага повреждения. Заживление ожоговой раны сопровождалось постепенным уменьшением площади раневого дефекта к 7 суткам наблюдения в среднем на 21 %, к 14 суткам – на 49 %, к 21 суткам – на 72 % и к 28 суткам – на 93 % в сравнении с исходной площадью раны. Максимальная скорость эпителизации раневого дефекта наблюдалась между 21 и 28 сутками. Полного заживления раны к 28 суткам после ТТ не происходило.
С использованием корреляционного анализа при экспериментальной ТТ установлена тесная связь скорости заживления раневого дефекта кожи, иммунореактивности организма по показателям врожденного и адаптивного иммунитета, а также морфологии очага повреждения, в частности представительства в нем нейтрофилов, лимфоцитов и фибробластов. Площадь раневого дефекта при термической травме снижается, а скорость его эпителизации увеличивается по мере снижения количества нейтрофилов в крови и в очаге повреждения, увеличения количества лимфоцитов в крови и в очаге повреждения, снижения функциональной активности фагоцитов, восстановления Th1- и Th2-зависимого иммунного ответа. Кроме того, на 7 и 14 сутки экспериментальной ТТ площадь раневого дефекта уменьшается, а скорость его эпителизации растет по мере снижения представительства в очаге нейтрофилов и увеличения – лимфоцитов и фибробластов.
На следующем этапе работы нами исследовано влияние локального применения ЭФР на иммунореактивность организма и ее связь с репаративными процессами после повреждения при ТТ. Локальное применение ЭФР у больных с ТТ приводит на 10 сутки к снижению содержания нейтрофилов за счет палочкоядерных и сегментоядерных форм, повышению количества лимфоцитов в периферической крови без достижения уровня здоровых людей. Кроме того, увеличивается представительство CD3+, CD4+, CD8+, CD22+ лимфоцитов и лимфоцитов, несущих маркеры поздней активации (CD71+, HLA-DR+). На 20 сутки после ТТ количество лейкоцитов, лейкоцитарная формула, а также представительство популяций лимфоцитов не отличались от соответствующих показателей группы здоровых людей.
Одним из механизмов увеличения общего количества лимфоцитов и их субпопуляций в периферической крови у больных на 10 сутки после ТТ является снижение интенсивности апоптоза. Уменьшалось содержание лимфоцитов, экспрессирующих маркер готовности к запрограммированной гибели (CD95+), а также имеющих морфологические признаки апоптоза. Полагаем, что одним из механизмов снижения апоптоза лимфоцитов в условиях локального применения ЭФР может быть ограничение вторичной альтерации в очаге повреждения, снижение продукции и/или выброса аутокоидов, в том числе с проапоптогенным действием. Общее содержание лимфоцитов, CD3+, CD4+, CD8+ лимфоцитов в крови увеличивается по мере снижения количества лимфоцитов, несущих признаки готовности к апоптозу и его морфологические признаки.
Обнаружено, что в условиях локального применения ЭФР у больных с ТТ в сыворотке снижается концентрация ИЛ-1β и повышается концентрация ИФН-γ, хотя их уровень не достигает значений в группе здоровых людей. Полагаем, что ЭФР, содержащийся в препарате «Эбермин» и применяемый локально у больных с термической травмой, не поступает в системный кровоток и не оказывает прямого системного действия, т.к. нами не обнаружено достоверных изменений концентрации ЭФР в сыворотке по сравнению с контрольной группой.
Локальное применение ЭФР у больных с термической травмой приводит к достоверному снижению продукции ИЛ-1β мононуклеарами периферической крови и на правах тенденции к повышению продукции ИФН-γ. Причем, уровень в сыворотке ИЛ-1β снижается по мере уменьшения его продукции мононуклеарами. Установлено, что количество нейтрофилов в крови снижается по мере уменьшения концентрации ИЛ-1β, а количество лимфоцитов, в том числе CD3+, CD4+, CD8+, CD71+, HLA-DR+, увеличивается по мере увеличения уровня ИФН-γ.
Полагаем, что обнаруженные изменения иммунореактивности имеют связь с локальными эффектами ЭФР в очаге повреждения при термической травме. Для проверки этого предположения применяли ЭФР при экспериментальной термической травме, аналогично тому, как у больных после термического поражения кожи. Установлено, что локальное применение ЭФР при экспериментальной термической травме приводит к изменению иммунореактивности у крыс. Так, на 3–14 сутки наблюдения уменьшается выраженность в периферической крови нейтрофильного лейкоцитоза и лимфоцитопении, количество лимфоцитов восстанавливалось до уровня интактных животных.
Кроме того, снижалась функциональная активность фагоцитов на 3–14 сутки наблюдения, что обусловлено уменьшением количества циркулирующих нейтрофилов и восстановлением активности отдельного фагоцита. Функциональный резерв фагоцитов, оцениваемый в индуцированном НСТ-тесте, не изменялся и был снижен при сравнении с группой интактных животных. Как видно, локальное применение ЭФР приводит к более раннему восстановлению функциональной активности фагоцитов при термической травме по показателям НСТ-теста и поглотительной способности фагоцитов.
Локальное применение ЭФР при экспериментальной ТТ приводит к восстановлению клеточного адаптивного иммунитета на 7–28 сутки наблюдения и не оказывает значимого влияния на выраженность гуморального иммунного ответа крыс.
При экспериментальной ТТ в условиях локального применения ЭФР отмечены изменения морфологии ожоговой раны. На 7–14 сутки наблюдения уменьшается представительство нейтрофилов, лимфоцитов и гистиоцитов, увеличивается количество фибробластов. К 28 суткам в очаге уменьшается количество фибробластов. Все это создает предпосылки для завершения альтеративных и сосудисто-экссудативных реакций и более ранней активации процессов восстановления поврежденных тканей.
Локальное применение ЭФР приводит к статистически значимому сокращению площади и ускорению скорости эпителизации раневого дефекта при сравнении с контрольной группой крыс в интервале наблюдения с 3 по 21 сутки. Полного заживления раны к 28 суткам после термической травмы не происходило. Установлено, что протекторные эффекты ЭФР в очаге повреждения имеют значимую связь с изменением иммунореактивности при ТТ: количеством в крови нейтрофилов и лимфоцитов, функциональной активностью фагоцитов, выраженностью клеточного адаптивного иммунитета, а также представительством в очаге повреждения нейтрофилов, лимфоцитов, гистиоцитов, фибробластов.
Полагаем, что локальное применение ЭФР при ТТ приводит к ограничению вторичной альтерации в очаге повреждения и как следствие нейтрофильной инфильтрации. В свою очередь, снижение масштабов повреждения в очаге повреждения препятствует гиперергическому характеру развития воспалительного процесса: эскалации сосудисто-экссудативных реакций, потере автономности очага и избыточному поступлению аутокоидов в системный кровоток, о чем свидетельствуют изменения иммунореактивности. В частности, это выражается в снижении нейтрофильного лейкоцитоза в периферической крови, функциональной способности фагоцитов, секреторной активности мононуклеаров, ограничении апоптоза лимфоцитов и сдерживании иммунодепрессии. В свою очередь, благоприятный фон иммунореактивности организма способствует реализации пролиферативных и репаративных реакций в очаге повреждения, что подтверждается более ранним представительством фибробластов. Нельзя исключить и прямое стимулирующее репарацию влияние ЭФР. Известно, что ЭФР через специфические мембранные рецепторы стимулирует таксис противовоспалительных клеток, модулирует пролиферацию и дифференциацию восстанавливающихся после повреждения клеток, особенно эпидермоцитов, активирует пролиферацию фибробластов и влияет на продукцию ими простагландинов, протеогликанов, коллагена, ростовых факторов и ряда цитокинов, включая колониестимулирующие факторы, интерлейкины и интерфероны [123, 222].
Взаимосвязь иммунореактивности, клеточного состава очага повреждения и скорости заживления ожоговой раны при термической травме в условиях локального применения эпидермального фактора роста представлена на интегральной схеме (рис. 10).
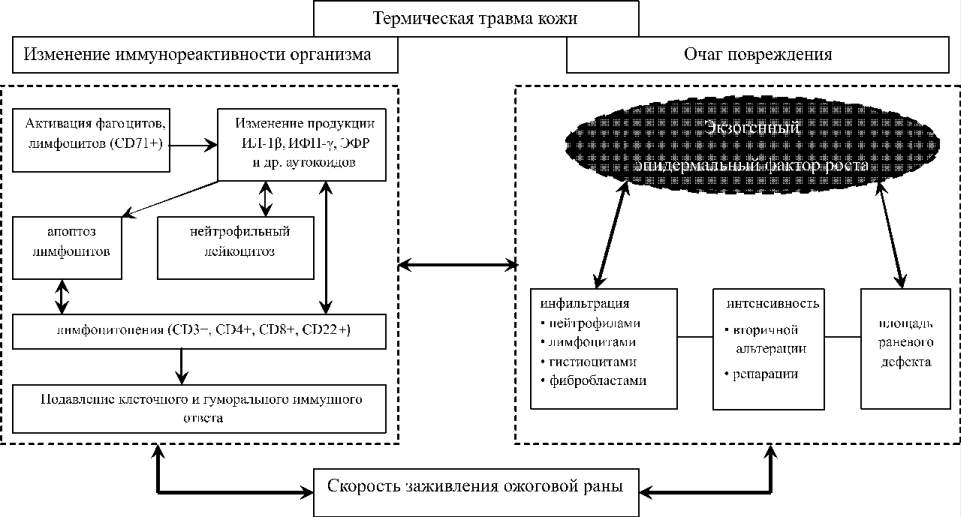
Рис. 10. Взаимосвязь иммунореактивности, клеточного состава очага
повреждения и скорости заживления ожоговой раны при термической травме
в условиях локального применения эпидермального фактора роста.
Двусторонние стрелки обозначают установленные статистически значимые
(p < 0,05) связи между показателями