
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

Патогенетическое обоснование применения эпидермального фактора роста при термической травме
Лихачева А. Г., Телешева Л. Ф., Долгушин И. И., Осиков М. В.,
1.1. Изменения локального и системного врожденного иммунитета при термической травме
Воспаление, развивающееся при ТТ, является типовым патологическим процессом, включающим местные альтеративные, сосудисто-экссудативные и репаративные реакции с вовлечением большого количества клеток кожи, а также системные изменения со стороны клеточных и гуморальных факторов крови, органов и систем организма [224, 256, 260].
Существует представление, что первоначальные изменения в коже после воздействия термического фактора происходят с кератиноцитами. Они приобретают многие черты макрофагов под влиянием провоспалительных цитокинов – ИЛ-1 и ИЛ-6, ФНО-α, а также ИФН-γ, ИЛ-4 и ИЛ-17 [290]. На поверхности активированных кератиноцитов увеличивается количество рецепторов для молекул адгезии, что позволяет им вступать в прямые контакты с иммунными клетками. Помимо этого, кератиноциты экспрессируют молекулы CD80+, CD86+, CD40+, благодаря которым эпителиальные клетки превращаются в антигенпрезентирующие [280]. Наконец, кератиноциты приобретают способность выделять ИЛ-1, ФНО-α, ИЛ-6, а также ГММЭ-КСФ, ИЛ-7, фактор активации фибробластов, хемокины, способные привлекать в кожу нейтрофилы, моноциты, клетки Лангерганса и Т-лимфоциты [274]. Все происходящие изменения являются лишь частью событий, создающих условия для запуска в коже иммунных процессов.
Роль нейтрофилов в очаге термического повреждения не менее важна. Особую роль играет метаболическая активность нейтрофилов, заключающаяся в разрушении омертвевших тканей за счет выделения ферментов во внеклеточную среду [35]. Секретируя протеазы, катепсины, миелопероксидазу, катионные белки, кислые гидролазы, коллагеназу, эластазу, они воздействуют на межклеточный матрикс очага воспаления, приводя к его деградации [28]. Продукты стимулированных нейтрофилов влияют на бластную трансформацию лимфоцитов, вызывают дегрануляцию тучных клеток, действуют на тромбоциты, активируют систему комплемента, хемотаксис макрофагов, калликреин-кининовую систему, систему свертывания и фибринолиза и др. Таким образом, нейтрофилы являются источниками разнообразных медиаторов, поддерживающих каскад реакций воспалительного процесса [41, 48, 49].
Внимание некоторых исследователей врожденного локального иммунитета в коже при ТТ сосредоточено на дендритных клетках. Их роль связана, во-первых, с поглощением, процессингом и презентацией антигенов, во-вторых, с миграцией и прицельной активацией CD4+ Т-лимфоцитов, наконец, с опосредованной Toll-подобными рецепторами продукцией таких иммунорегуляторов как цитокины [265]. Показана роль дендритных клеток в активации хемотаксиса и микробоцидных эффектов нейтрофилов in situ [81]. Дисфункция дендритных клеток при ТТ выражается в изменении экспрессии HLA-DR и Тoll-подобного рецептора 4 типа (TLR-4) [110].
При термическом повреждении эпидермиса изменяется активность наиболее лабильных клеток дермы – тканевых базофилов [17]. Их гранулярный компонент, содержащий биологически активные вещества, играет важную роль в развитии воспаления. В коже лаброциты локализуются в верхних слоях дермы вокруг кровеносных сосудов. Их дегрануляция приводит к выбросу гистамина, серотонина, кининов, гепарина, фактора активации тромбоцитов, гиалуроновой кислоты, фактора хемотаксиса эозинофилов и др. [30, 16]. Эффекты биологически активных веществ тучных клеток приводят к разрыву клеточных контактов между элементами сосудистого эндотелия, что облегчает миграцию лейкоцитов в очаг воспаления, агрегацию тромбоцитов и нейтрофилов, хемотаксис лейкоцитов [47]. Таким образом, тканевые базофилы кожи являются регуляторами местного гомеостаза. На рис. 1 представлена последовательная смена ключевых клеточных элементов, координирующих воспалительные и иммунные реакции в очаге ТТ.
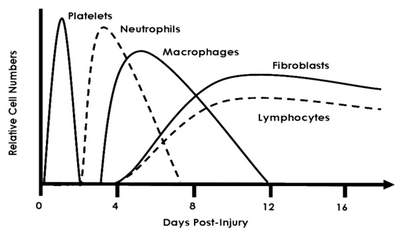
Рис. 1. Последовательная смена представительства ключевых клеток
в очаге термического повреждения кожи. По [247]
При термических повреждениях кожи после активации и реализации эффектов нейтрофилов в очаге повреждения накапливаются макрофаги, они приобретают более выраженные антимикробные свойства, в т.ч. благодаря фагоцитозу антимикробных компонентов нейтрофилов (миелопероксидаза и катионные белки). В результате макрофаги приобретают ранее не свойственную им способность галоидировать белки – способность, исходно присущую нейтрофилам. Внутриэпидермальные макрофаги, или клетки Лангерганса (КЛ) – постоянная клеточная популяция, входящая в состав многослойного эпителия [23]. Эти клетки образуют «интраэпидермальную» фагоцитарную систему, содержат на мембране белки HLA 1 и 2 класса и участвуют в иммунном ответе [156]. В экспериментальных условиях ex vivo при ТТ показано, что депрессия активности Т-лимфоцитов in situ, мигрировавших в очаг повреждения из кровотока, обусловлена нарушением антигенпрезентирующей функции КЛ и дендритных клеток [129, 279].
Макрофаг является ключевой клеткой, координирующей процесс заживления раны и регулирующей переход процесса от сосудисто-экссудативной стадии к стадии репарации. Предложена и находит подтверждение гипотеза о центральной роли макрофагов в эпидермальной пролиферативной единице. Известно, что макрофаги представлены 3 субпопуляциями: М1 – участники фагоцитарных реакций; М2 – регуляторы репаративных процессов; Мох – защитники от окислительного стресса. Адгезия макрофагов (М1) к экстрацеллюлярному матриксу является ключевым событием, запускающим процесс превращения их в так называемые макрофаги репарации (М2). За счет синтеза ИЛ-1, ИЛ-6, ИЛ-10, ИЛ-8, ФНО-α, макрофагальных воспалительных пептидов (MIP), моноцитарного хемотаксического протеина (МСР-1), TGF-a, TGF-b, инсулиноподобных факторов роста и др. они приводят к активации фибробластов, гладких миоцитов и эндотелиоцитов в очаге ТТ.
В последние годы внимание многих исследователей привлечено к антимикробным пептидам фагоцитарного и иного происхождения, участвующим в реализации врожденного иммунитета в коже, в частности дефенсинам, дермицидинам и кателицидинам, их перспективную роль в профилактике и терапии гнойно-септических осложнений при ТТ трудно переоценить [69, 201, 236, 266].
Факторы врожденного иммунитета, такие как дермицидины DCD-1 и DCD-1L, производимые экзокринными потовыми железами, играют определяющую роль в стимуляции кератиноцитов и макрофагов кожи через активацию G-белка, МАР-киназного пути и NF-κВ продукции цитокинов и хемокинов, что повышает микробоцидность кожи [201, 257]. У больных с ТТ наблюдается снижение уровня катионных белков, предрасполагающее к развитию септических осложнений. Пептид из тучных клеток дермы катестатин, обладающий широким спектром иммуномодулирующего действия, претендует на роль основного связующего звена между нейроиммуноэндокринной системами организма и кожи [67].
Активация продукции цитокинов макрофагами опосредована Тоll-подобными рецепторами TLR2 и TLR4 [89]. Выработка цитокинов в макрофагах происходит под стимулирующим влиянием нейросенсорных пептидов, которые выделяются в первые минуты после повреждения из пептидергических нервных волокон, участвующих в ноцирецепции. Связывание макрофагов со специфическим белками экстрацеллюлярного матрикса стимулирует фагоцитоз микроорганизмов и разрушенных фрагментов тканей. Макрофагальные факторы роста имеют важнейшее значение для образования и роста ткани в раневых дефектах, поскольку у животных с экспериментальной моноцитопенией, вызванной гидрокортизоном в сочетании с локальным применением антимоноцитарных антител, процесс заживления раны резко нарушается.
Активность макрофагов имеет определяющее значение в развитии иммунной дисфункции после ТТ. Это связано, во-первых, с синтезом оксида азота (II) и потенцированием оксидативного стресса, регуляцией экспрессии цитокинов, во-вторых, с активацией циклоксигеназы и образованием дериватов арахидоновой кислоты, в-третьих, модуляции Th-1 и Th-2 направленного иммунного ответа, изменением активности γδ-Т-лимфоцитов и др. Полагают, что глубокое понимание взаимосвязей между активностью макрофагов в очаге термического поражения и развитием иммунной дисфункции обеспечит формирование плацдарма для разработки широкого спектра иммуномодуляторов для терапии ожоговых больных [176, 244]. Особый акцент участия макрофагов в патогенезе иммунной дисфункции при ожогах делают на продукции простагландинов, в частности Е2, ФНО-α и оксида азота (II) [243]. Полагают, что эти агенты ответственны за развитие ранней дисфункции лимфоцитов при ТТ [185].
Активация iNOS и повышение продукции NO макрофагами в очаге повреждения и моноцитами в крови имеет значение в модуляции иммунологических функций, изменении пролиферации лимфоцитов и спленоцитов при экспериментальной ТТ, в том числе, за счет изменения продукции ИЛ-10 [200, 242]. NO и пероксинитрит макрофагально/моноцитарного происхождения рассматривают как один из факторов патогенеза полиорганной недостаточности при ожогах [99, 130, 236]. Полагают, что одним из механизмов гиперергии макрофагов после ТТ является избыточная активация МАРК – зависимых путей внутриклеточной сигнализации [58]. В повреждении легочной ткани при термической травме имеет значение активация лейкоцитов через адгезивные молекулы (ICAM-1, VCAM-1), что запускает активацию JNK-зависимого сигнального пути и экспрессию iNOS [100, 163, 241].
В процессе репарации кожи при ТТ важная роль отводится Т-клеткам. Моноциты/макрофаги, активированные медиаторами Т-хелперов (СD4 +), выделяют фиброгенные цитокины, вызывающие пролиферацию фибробластов и синтез коллагена. Причем не только от выраженности иммунного ответа, но и от его характера будет зависеть характер рубцевания раны при ТТ. Активация Тh2 с повышением продукции IL-4, IL-5, IL-10 и IL-13 связана с фиброгенезом, тогда как Тh1-опосредованный ответ подавляет образование соединительной ткани за счет продукции ИФН-γ и IL-12.
В процессах репарации кожи при ТТ важная роль принадлежит тромбоцитам, которые не только формируют первичную гемостатическую пробку, но и секретируют ряд медиаторов заживления раны, такие как тромбоцитарный фактор роста (PDGF), привлекающий и активирующий макрофаги и фибробласты.
К настоящему времени хорошо известно, что фибробласты секретируют множество факторов роста, биологически активных полипептидных медиаторов. Важнейшими из них являются кислый и основной фибробластические факторы роста, сосудистый эндотелиальный фактор роста, трансформирующий фактор роста β, кератиноцитовый фактор роста, факторы роста тромбоцитарного ряда и др. В процессе воспаления и заживления раны при ТТ эти факторы оказывают влияние на рост и функции клеток раны, активно участвуют в ангиогенезе. Важнейшая их роль заключается также в осуществлении внутриклеточных связей, последовательном вовлечении в процесс различных клеточных элементов, что в конечном итоге и обеспечивает заживление раны. Скорость образования грануляционной ткани определяется уровнем экспрессии рецепторов к фибронектину и фибрину на фибробластах [192]. Впоследствии провизорный матрикс заменяется на более полноценную коллагеновую структуру, вероятно под влиянием TGF-b. Под действием не вполне определенных факторов фибробласты претерпевают апоптоз, соответственно синтез белков внеклеточного матрикса прекращается и богатая клетками грануляционная ткань превращается в рубец [113]. Нарушение процесса апоптоза фибробластов рассматривают как один из возможных механизмов келоидообразования.
Кроме локальных изменений в очаге термического повреждения фиксируются и системные изменения клеточных и гуморальных факторов врожденного иммунитета. Изменения количества и активности иммунокомпетентных клеток и гуморальных факторов в крови могут быть зафиксированы доступными методами и являться диагностическими и прогностическими критериями тяжести ТТ.
При ТТ наблюдается повышение реактивности нейтрофилов. Это приводит после ТТ к накоплению и активации нейтрофилов в периферической крови и разрушению изначально интактных органов вне очага поражения: легких, печени и др. Показано, что активация циркулирующих фагоцитов, особенно на 3-7 день после ТТ, связана с Тоll-подобными рецепторами (TLR), особенно TLR-2 и TLR-4 [248]. Активация TLR-2 и TLR-4 приводит к увеличению продукции ИЛ-1β, ИЛ-6, ИЛ-10, ИЛ-17, TNF-α, MCP-1, MIP-1α, MIP-1β и RANTES, что, в частности, имеет решающее значение в развитии острого повреждения легких и респираторного дистресс-синдрома взрослых [202]. У больных с ТТ на фоне подавления цитотоксической активности макрофагов наблюдается высокий уровень естественной и антителонезависимой цитотоксичности нейтрофилов, что связано с появлением в крови юных гранулоцитов. В эксперименте показана прогностическая роль мониторинга НСТ-теста после ТТ: выживаемость выше, если первоначально НСТ-тест повышается, а затем постепенно снижается, непрерывный рост НСТ-теста приводит к неблагоприятным исходам [287].
Гиперергия нейтрофилов после ТТ может лежать в основе повреждения многих органов и систем, развития синдрома полиорганной недостаточности за счет воздействия АФК и ферментов лизосомального происхождения [183, 251, 270]. В экспериментальных условиях после ТТ кожи площадью 20–40 % от поверхности тела показано прицельное накопление и реализация деструктивных эффектов нейтрофилов в легких и в печени, но не в почках и кишечнике уже через 6-12 час, сохраняющееся до 7 суток после повреждения [70]. Избыточная активация нейтрофилов, повышение ими продукции АФК и ферментов имеют определяющее значение в повышении проницаемости сосудов не только in situ, но и отдаленно и приводить к развитию отеков тканей и органов после ТТ [136]. Убедительно продемонстрирована роль Е- и Р-селектинов на эндотелиальных клетках в секвестрации и активации нейтрофилов в очаге повреждения и за его пределами после ТТ [136]. Определенное значение в активации циркулирующих нейтрофилов после ТТ имеет их взаимодействие с С5 компонентом комплемента [262]. Установлена роль фактора активации тромбоцитов, Са2+ и протеинкиназы С – опосредованных внутриклеточных сигнальных путей в изменении активности нейтрофилов при ТТ [121, 229].
Именно избыточное накопление фагоцитов в очаге ТТ в сочетании с их
дисфункцией ответственны за оксидативный стресс и его
патофизиологические последствия [212]. Развитие последнего также связано
с дефицитом цинка и блокадой систем антиоксидантной защиты организма
[104, 105]. Окислительный стресс после ожога является ведущим фактором
патогенеза эндотелиальной дисфункции, которая, в свою очередь,
инициирует и/или потенцирует развитие синдрома системного
воспалительного ответа [231]. Показана роль АФК, продуктов пероксидации
липидов, накапливающихся в крови после ТТ, в NF-κВ опосредованной
активации синтеза
ИЛ-1β, ФНО-α, ИЛ-6 в эндотелиоцитах и кардиомиоцитах
[148,
231]. Установлена регулирующая, антиоксидантная роль гемоксигеназы-1
в реализации функции нейтрофилов и протекции тканей от их деструктивных
эффектов при ожогах, связанная с блокадой p47(phox) и p67(phox)
субъединиц НАДФН-оксидазного комплекса [175]. Одним из направлений
экспериментальной антиоксидантной терапии при ТТ является применение
лептина, который в дозе 10 мкг/кг приводит к снижению повышенной
активности миелопероксидазы нейтрофилов и как следствие к протекции от
полиорганной недостаточности [90]. Развитие сердечной дисфункции через
24 ч после ТТ предотвращает локальная блокада р38 субъединицы
МАР-киназы, что рассматривается как новый терапевтический
подход [146].
В тоже время, у обожженных больных фиксируется чрезвычайная вариабельность функциональной активности нейтрофилов, в т.ч. генерации АФК, поглотительной способности, что имеет связь с развитием инфекционных осложнений: представлены сведения как о повышении, так и о снижении функциональной активности, функционального резерва фагоцитов, причем, независимо от масштабов повреждения кожи [64, 76, 77, 212, 215, 230, 267, 271]. Так, наряду с многочисленными сведениями о гиперактивности нейтрофилов, приводят данные о снижении фагоцитарной активности нейтрофилов, включая окислительный взрыв и образование фагосом при термической травме, независимые от состояния цитоскелета и окружающих гуморальных факторов [92, 209].
Установлена роль повышения концентрации в плазме у больных с ожогами растворимой формы межклеточной адгезивной молекулы SICAM-1, ответственной за чрезмерную активацию циркулирующих нейтрофилов и как следствие повреждение кожи и расширение зоны вторичной альтерации в коже [53]. Не менее важным представляется нарушение биологической программы гибели нейтрофилов в очаге ТТ путем апоптоза. Обнаружена обратная корреляция между фрагментацией ДНК нейтрофилов и дисфункцией органов на 10 сутки после травмы и роль ИЛ-18 в этом процессе [54, 214]. Механизм задержки апоптоза нейтрофилов у больных с ТТ обусловлен снижением экспрессии генов семейства Bcl-XL, Bax и Bad [150].
Еще одним неблагоприятным предиктором инфекционных осложнений является нарушение хемотаксиса фагоцитов – подавление миграции фиксируется уже через 24 ч после ожога и достигают максимума на 72–120 ч наблюдения, коррелируя с размером очага повреждения [86, 111]. Механизм снижения хемотаксической активности нейтрофилов связан с нарушением полимеризации и деполимеризации актиновых филаментов [280].
Дисфункция нейтрофилов у больных с ТТ может быть опосредована дефицитом или дефектом некоторых опсонинов, например, компонентов комплемента, маннозо-связывающих лектинов (МСЛ) и др. Так, дефицит МСЛ значительно повышает восприимчивость к послеожоговой инфекции, вызванной синегнойной палочкой и др. микроорганизмами, а также является фактором риска тромбообразования и ДВС-синдрома [172, 196, 197, 269].
Отечественными исследователями под руководством И.И. Долгушина показано, что нейтрофилы выделяют продукты пептидной природы – нейтрофилокины с молекулярной массой 15–68 кД. Причем, нейтрофилокины интактных клеток обладают иммунодепрессивными свойствами, а активированных – иммуностимулирующими. Первые снижают хемотаксис, образование АФК, фагоцитарную, лизосомную активность нейтрофилов, вторые, наоборот, стимулируют эти функции. Убедительно продемонстрирована иммуномодулирующая функция нейтрофилокинов при термической и механической травме [11, 12, 13].
Дисфункцию врожденного иммунитета при ТТ трудно отделить от изменений адаптивного иммунитета, функционирующих в тесной взаимосвязи, равно как и невозможно определить удельный вес каждого из видов иммунитета в патогенезе иммунореактивности и развития гнойно-септических осложнений, сепсиса и полиорганной недостаточности. Полагают, что именно адаптивный иммунитет играет ключевую роль в протекции от полимикробного сепсиса и регуляции терминального этапа воспалительного процесса при ожогах [255].