
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

Патогенетическое обоснование применения эпидермального фактора роста при термической травме
Лихачева А. Г., Телешева Л. Ф., Долгушин И. И., Осиков М. В.,
2.6. Морфология ожоговой раны при экспериментальной термической травме
Системные изменения врожденного и адаптивного иммунитета при термической травме обусловлены формированием и эволюцией очага повреждения. Интенсивность клеточных и гуморальных реакций, протекающих в очаге термической травмы, определяет выраженность вторичной альтерации и, как следствие, интенсивность системных изменений.
Микроскопическое изучение гистологических срезов кожи у крыс после ТТ проводили на микроскопе «Leika DMRXA» (Германия). Морфометрические исследования осуществляли с помощью компьютерной программы анализа изображений «Image Scope M» (Россия, Москва), проводящий цифровые преобразования изображения гистологических структур и компьютеризированный подсчет параметров выбранных объектов. Установлено, что на 7 сутки эксперимента дно раны покрыто струпом, в дерме наблюдается инфильтрация полиморфно-ядерными лейкоцитами, лимфоцитами, кровоизлияния, отек (рис. 2).
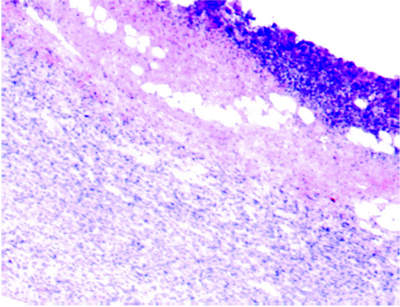
Рис. 2. Микропрепарат очага термической травмы, 7 сутки эксперимента (х100, окраска гематоксилином и эозином)
На 14 сутки наблюдения поверхность раны покрыта слоем из ядерного детрита, фибрина, лейкоцитов, лизированных эритроцитов. В подлежащей ткани густая неотграниченная лейкоцитарная инфильтрация полиморфно-ядерными лейкоцитами, лимфоцитами, венозное полнокровие, диапедезные кровоизлияния. В зоне раны придатки кожи не определяются. По краю раны в отдельных препаратах появляется слой из 2–3 эпителиальных клеток, отделяющий некротический слой, фибробласты приобретают параллельную ориентировку, большое количество гистиоцитов. Появляется слой вертикальных сосудов. Под струпом появляется узкий слой фибробластов, ориентированных параллельно дну раны (рис. 3).
На 21 сутки ТТ в области дна раны виден только струп, в дерме
полнокровие, лейкоцитарная инфильтрация из полиморфно-ядерных
лейкоцитов, дефект эпителиальной выстилки, прикрытый струпом. Придатки
кожи отсутствуют. В краях раны под эпителием видны диапедезные
кровоизлияния, «надвигается» эпителиальный пласт с ороговевающим слоем.
Количество слоев клеток в эпидермисе по краям раны 6–8. Тучных клеток
нет, в области края –
все тучные клетки дегранулированы, местами только россыпь
гранул (рис. 4).
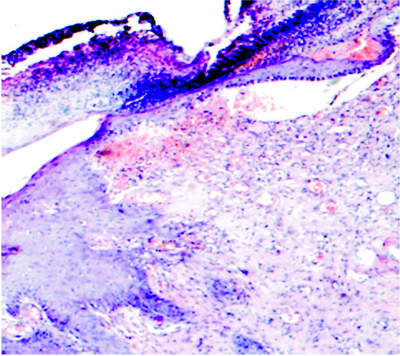
Рис. 3. Микропрепарат очага термической травмы, 14 сутки эксперимента (х100, окраска гематоксилином и эозином)
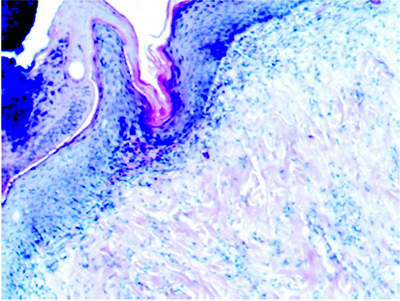
Рис. 4. Микропрепарат очага термической травмы, 21 сутки эксперимента (х100, окраска гематоксилином и эозином)
На 28 сутки эксперимента дно раны покрыто струпом, содержащим ядерный детрит, фибрин, лейкоциты, лизированные эритроциты. Под ним ткань густо инфильтрирована нейтрофилами, наблюдается венозное полнокровие. С края раны эпителиальный пласт нарастает на дно раны, фиксируется 2–3 слоя, а по краю раны 4–5 слоев клеток многослойного плоского ороговевающего эпителия, с широким роговым слоем. Коллагеновые волокна приобретают параллелльное расположение относительно поверхности раны. В дерме васкулит, повышенное количество клеток вокруг сосудов, зерен гемосидерина (рис. 5).
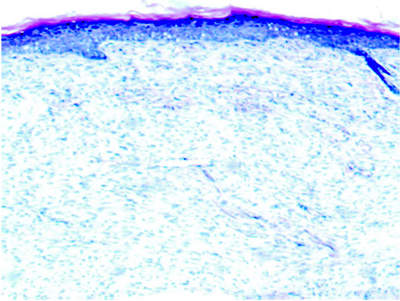
Рис. 5. Микропрепарат очага термической травмы, 28 сутки эксперимента, дно раны покрыто эпителием (х100, окраска гематоксилином и эозином)
Для морфометрической оценки динамических изменений в очаге повреждения при термической травме использованы количественные показатели клеток в слое эпителия в дне и краях раны, клеточный состав дна и края раны, ширина клеточного эпителиалного слоя, а также дифференцированный подсчет количества нейтрофилов, лимфоцитов, гистиоцитов и фибробластов. Результаты представлены в табл. 16.
Максимальное количество клеток и ширина клеточного слоя по краю раны фиксируются на 7 и 14 сутки, к 21 и 28 суткам они снижаются и значимо отличаются от соответствующих показателей 7 и 14 суток. Динамика клеточного представительства в очаге термической травмы отражает известные закономерности эволюции очага повреждения: на начальных этапах превалируют полинуклеарные лейкоциты, которые постепенно заменяются мононуклеарами и фибробластами.
Таблица 16
Количественный состав клеток ожоговой раны при экспериментальной термической травме (М ± m)
|
Группы животных
Показатели |
Группа 4к 7 сутки ТТ n = 10 |
Группа 5к 14 сутки ТТ n = 10 |
Группа 6к 21 сутки ТТ n = 10 |
Группа 7к 28 сутки ТТ n = 10 |
|
Кол-во клеток в эпител. пласте дна раны, |
– (струп) |
– (струп) |
– (струп) |
2,77 ± 0,08 |
|
Кол-во клеток в эпител. пласте края раны, |
7,28 ± 0,44 |
8,55 ± 0,29 |
5,97 ± 0,62 |
4,20 ± 0,16* # |
|
Ширина клеточного слоя дна раны, мкм |
– (струп) |
– (струп) |
– (струп) |
43,40 ± 1,75 |
|
Ширина клеточного слоя края раны, мкм |
11,96 ± 0,87 |
9,93 ± 0,33 |
5,75 ± 0,63* |
8,78 ± 3,10 |
|
Нейтрофилы, ед./ поле зрения |
70,53 ± 7,98 |
27,96 ± 1,63* |
4,95 ± 1,70*# |
0,08 ± 0,05*#^ |
|
Лимфоциты, ед./ поле зрения |
12,95 ± 0,06 |
15,73 ± 1,68 |
7,04 ± 0,44*# |
7,04 ± 0,81*# |
|
Гистиоциты, |
18,10 ± 0,22 |
14,68 ± 0,58 |
13,27 ± 1,79* |
11,32 ± 0,31* |
|
Фибробласты, ед./ поле зрения |
2,70 ± 0,48 |
11,92 ± 1,18* |
17,08 ± 3,64* |
16,28 ± 0,49*# |
Примечание. * – статистически значимые (p < 0,05) различия с группой 4к, # – группой 5к, ^ – группой 6к по критерию Манна–Уитни.
На 7 сутки эксперимента в очаге ожоговой раны присутствуют значительное количество нейтрофилов, лимфоцитов и гистиоцитов с преобладанием клеток нейтрофильного ряда. К 14 суткам термической травмы количество нейтрофилов снижается более чем в 2 раза по сравнению с 7 сутками, увеличивается представительство лимфоцитов и фибробластов. На 21 сутки эксперимента количество нейтрофилов в очаге снижается в 14 раз по сравнению с 7 сутками и в 5,6 раза по сравнению с данными на 14 сутки, представительство лимфоцитов также снижается в 2,3 раза по сравнению с 14 сутками. В это же время существенно возрастает содержание фибробластов (в 6,3 раза по сравнению с 7 сутками и на 43 % по сравнению с 14 сутками наблюдения). На 28 сутки термической травмы нейтрофилы практически исчезают из очага повреждения (не более 1 клетки в поле зрения), значимо по сравнению с 7 и 14 сутками снижается содержание лимфоцитов, при этом, количество гистиоцитов и фибробластов остается на уровне показателей 7–14 суток.
Таким образом, в очаге термической травмы на 7 сутки наблюдения клеточный состав представлен преимущественно полиморфно-ядерными лейкоцитами, лимфоцитами и гистиоцитами. Количество нейтрофилов с 7 по 28 сутки прогрессивно снижается, с 21 суток снижается количество лимфоцитов и гистиоцитов, с 14 суток эксперимента возрастает содержание фибробластов.
Очевидно, что представительство и динамика клеточного состава очага повреждения при термической травме связаны с изменением клеточного представительства лейкоцитов в периферической крови. Такие корреляции могут быть обусловлены, с одной стороны, эмиграцией клеток крови в очаг повреждения, а значит уменьшением количества лейкоцитов в кровотоке. С другой – выраженность альтеративных реакций в очаге зависит от деструктивных эффектов находящихся здесь фагоцитов и иммуноцитов, что в свою очередь, определяет интенсивность выброса аутокоидов в системный кровоток, и как следствие ответ костного мозга реализуется в виде продукции лейкоцитов de novo, что приводит к увеличению количества лейкоцитов в крови. Для подтверждения высказанных предположений при исследуемой экспериментальной термической травме был применении корреляционный анализ, его результаты представлены в табл. 17, 18.
Таблица 17
Корреляционная матрица между количественным составом лейкоцитов в периферической крови и клеточным составом очага повреждения на 7 сутки экспериментальной термической травмы
|
Показатели в очаге повреждения Показатели в периферической крови |
Нейтрофилы, |
Лимфоциты, |
Гистиоциты, |
|
Палочкоядерные нейтрофилы, •109/л |
R = 0,41 р < 0,05 |
R = 0,11 р > 0,05 |
R = 0,06 р > 0,05 |
|
Сегментоядерные нейтрофилы, •109/л |
R = 0,68 р < 0,05 |
R = 0,03 р > 0,05 |
R = −0,02 р > 0,05 |
|
Нейтрофилы, •109/л |
R = 0,72 р < 0,05 |
R = 0,19 р > 0,05 |
R = 0,04 р > 0,05 |
|
Лимфоциты, •109/л |
R = −0,15 р > 0,05 |
R = −0,64 р < 0,05 |
R = −0,09 р > 0,05 |
|
Моноциты, •109/л |
R = 0,07 р > 0,05 |
R = 0,02 р > 0,05 |
R = 0,29 р > 0,05 |
Примечание. R – коэффициент корреляции Спирмена, p – показатель значимости связи.
Установлено, что на 7 и 14 сутки после термической травмы имеется положительная связь между количеством палочкоядерных и сегментодерных нейтрофилов в периферической крови и их абсолютным количеством в очаге повреждения, причем эта связь сильная для сегментоядерных клеток и средней силы – для палочкоядерных, что свидетельствует о преимущественной эмиграции в очаг повреждения сегментоядерных нейтрофилов. Кроме того, наблюдается отрицательная сильная связь между количеством лимфоцитов в кровотоке и их представительством в очаге повреждения. Таким образом, количество нейтрофилов в очаге повреждения нарастает по мере их увеличения в периферической крови, а количество лимфоцитов в кровотоке уменьшается по мере увеличения их представительства в очаге.
Таблица 18
Корреляционная матрица между количественным составом лейкоцитов в периферической крови и клеточным составом очага повреждения на 14 сутки экспериментальной термической травмы
|
Показатели в очаге
Показатели |
Нейтрофилы, |
Лимфоциты, |
Гистиоциты, |
|
Палочкоядерные нейтрофилы, •109/л |
R = 0,49 р < 0,05 |
R = 0,16 р > 0,05 |
R = 0,08 р > 0,05 |
|
Сегментоядерные нейтрофилы, •109/л |
R = 0,63 р < 0,05 |
R = 0,17 р > 0,05 |
R = 0,06 р > 0,05 |
|
Нейтрофилы, •109/л |
R = 0,61 р < 0,05 |
R = 0,09 р > 0,05 |
R = 0,11 р > 0,05 |
|
Лимфоциты, •109/л |
R = −0,19 р > 0,05 |
R = −0,78 р < 0,05 |
R = −0,07 р > 0,05 |
|
Моноциты, •109/л |
R = 0,04 р > 0,05 |
R = 0 р > 0,05 |
R = 0,33 р > 0,05 |
Примечание. R – коэффициент корреляции Спирмена, p – показатель значимости связи.
Для количественной оценки заживления ожоговой раны у крыс использовали в динамике наблюдения расчетные показатели: площадь ожоговой раны, уменьшение площади раневого дефекта относительно исходного размера на 1 сутки наблюдения, а также скорость эпителизации очага повреждения. Для оценки динамики эпителизации измеряли площадь раневого дефекта методом контактной планиметрии с использованием прозрачной полиэтиленовой пленки, которую предварительно подвергали антисептической обработке. Пленку накладывали во время перевязки, обводили контур дефекта на пленке маркером. В дальнейшем сопоставляли пленку с листом миллиметровой бумаги и, перенося контур, подсчитывали площадь дефекта. При этом, площадь раны в последующих измерениях определяли в %, принимая за 100 % площадь ожоговой раны до лечения, результат выражали в % за сутки. Скорость эпителизации (VS) рассчитывалась по формуле :
VS = S − Sn/t,
где S – начальная площадь раны до лечения (в дальнейшем, площадь при предыдущем измерении);
Sn – площадь при последующем измерении;
t – число дней между измерениями [4].
Результаты представлены в табл. 19. Заживление ожоговой раны сопровождалось постепенным уменьшением площади раневого дефекта к 7 суткам наблюдения в среднем на 21 %, к 14 суткам – на 49 %, к 21 суткам – на 72 % и к 28 суткам – на 93 % в сравнении с исходной площадью раны. Максимальная скорость эпителизации раневого дефекта наблюдалась между 21 и 28 сутками. Полного заживления раны к 28 суткам после термической травмы не происходило.
Таблица 19
Показатели заживления ожоговой раны
при экспериментальной ТТ (М ± m)
|
Показатели Группы животных |
Площадь ожоговой раны, см2 |
Снижение площади раневого дефекта, % |
Скорость эпителизации очага термической травмы, % |
|
Группа 2к 1 сутки ТТ (n = 6) |
13,21 ± 0,45 |
0 |
0 |
|
Группа 3к 3 сутки ТТ (n = 6) |
13,21 ± 0,45 |
0 |
0 |
|
Группа 4к 7 сутки ТТ (n = 6) |
10,39 ± 0,55 |
21,07 ± 4,42# ^ |
82,21 ± 23,31# ^ |
|
Группа 5к 14 сутки ТТ (n = 6) |
6,6 ± 0,3# ^ & |
49,59 ± 3,36# ^ & |
251,23 ± 24,31#^& |
|
Группа 6к 21 сутки ТТ (n = 6) |
3,71 ± 0,28#^&@ |
71,5 ± 2,58#^&@ |
296,95 ± 47,48#^& |
|
Группа 7к 28 сутки ТТ (n = 6) |
0,8 ± 0,16#^&@~ |
93,3 ± 1,25#^&@~ |
536,1 ± 26,35#^&@~ |
Примечание. # – статистически значимые (p < 0,05) различия с группой 2к, ^ – с группой 3к, & – с группой 4к, @ – с группой 5к, ~ – с группой 6к по критерию Манна–Уитни.
Полагаем, что интенсивность заживления ожоговой раны напрямую зависит от иммунореактивности организма. Данное положение подтверждают результаты корреляционного анализа по выявлению зависимости снижения площади раневого дефекта и увеличения скорости эпителизации очага термической травмы от показателей врожденного и адаптивного иммунитета у крыс.
Учитывая, что максимальные изменения иммунореактивности крыс зафиксированы на 7 и 14 сутки после термической травмы, то и корреляционный анализ проводили в эти сроки наблюдения. Результаты представлены в табл. 20, 21.
Таблица 20
Корреляционная матрица между показателями заживления ожоговой раны и показателями иммунореактивности
на 7 сутки после экспериментальной ТТ
|
Показатели в очаге повреждения
Показатели |
Площадь ожоговой раны, см2 |
Снижение площади раневого дефекта, % |
Скорость эпителизации очага ТТ, % |
|
Лейкоциты, •109/л |
R = 0,68 р < 0,05 |
R = −0,81 р < 0,05 |
R = −0,71 р < 0,05 |
|
Нейтрофилы, •109/л |
R = 0,56 р < 0,05 |
R = −0,72 р < 0,05 |
R = −0,60 р < 0,05 |
|
Лимфоциты, •109/л |
R = −0,09 р > 0,05 |
R = 0,06 р > 0,05 |
R = 0,09 р > 0,05 |
|
НСТ-тест спонтанный, активность, % клеток |
R = 0,31 р < 0,05 |
R = −0,18 р > 0,05 |
R = −0,20 р > 0,05 |
|
НСТ-тест спонтанный, интенсивность, у.е. |
R = 0,22 р > 0,05 |
R = −0,07 р > 0,05 |
R = −0,14 р > 0,05 |
|
Активность фагоцитоза, % клеток |
R = 0,24 р > 0,05 |
R = −0,52 р < 0,05 |
R = −0,37 р < 0,05 |
|
Интенсивность фагоцитоза, |
R = 0,24 р > 0,05 |
R = −0,52 р < 0,05 |
R = −0,37 р < 0,05 |
|
ГЗТ, мл |
R = −0,97 р < 0,05 |
R = 0,74 р < 0,05 |
R = 0,95 р < 0,05 |
|
Количество АОК в селезенке, •104 ед. |
R = −0,38 р < 0,05 |
R = 0,23 р > 0,05 |
R = 0,26 р > 0,05 |
Примечание. R – коэффициент корреляции Спирмена, p – показатель значимости связи.
Таблица 21
Корреляционная матрица между показателями заживления ожоговой раны и показателями иммунореактивности
на 14 сутки после экспериментальной ТТ
|
Показатели в очаге
Показатели |
Площадь ожоговой раны, см2 |
Снижение площади раневого дефекта, % |
Скорость эпителизации очага ТТ, % |
|
Лейкоциты, •109/л |
R = 0,12 р > 0,05 |
R = −0,14 р > 0,05 |
R = −0,17 р > 0,05 |
|
Нейтрофилы, •109/л |
R = 0,12 р > 0,05 |
R = −0,14 р > 0,05 |
R = −0,14 р > 0,05 |
|
Лимфоциты, •109/л |
R = −0,15 р > 0,05 |
R = 0,17 р > 0,05 |
R = 0,43 р > 0,05 |
|
НСТ-тест спонтанный, активность, % клеток |
R = 0,33 р < 0,05 |
R = −0,37 р < 0,05 |
R = −0,44 р > 0,05 |
|
НСТ-тест спонтанный, интенсивность, у.е. |
R = 0,13 р > 0,05 |
R = −0,09 р > 0,05 |
R = −0,17 р > 0,05 |
|
Активность фагоцитоза, % клеток |
R = 0,24 р > 0,05 |
R = −0,46 р < 0,05 |
R = −0,46 р < 0,05 |
|
Интенсивность фагоцитоза, у.е./клетку |
R = 0,12 р > 0,05 |
R = −0,57 р < 0,05 |
R = −0,57 р < 0,05 |
|
ГЗТ, мл |
R = −0,92 р < 0,05 |
R = 0,89 р < 0,05 |
R = 0,67 р < 0,05 |
|
Количество АОК в селезенке, •104 ед. |
R = −0,18 р > 0,05 |
R = 0,18 р > 0,05 |
R = 0,29 р > 0,05 |
Статистически значимые связи показателей заживления ожоговой раны обнаружены с количественным представительством лейкоцитов, лимфоцитов, нейтрофилов в крови, функциональной активностью фагоцитов, выраженностью клеточного и гуморального иммунного ответа крыс. В частности, площадь раневого дефекта и снижение скорости эпителизации нарастают по мере увеличения количества лейкоцитов, нейтрофилов, снижения количества лимфоцитов в периферической крови, активации киллинговой и поглотительной способностей фагоцитов, снижения выраженности реакции ГЗТ и количества АОК в селезенке после повторной иммунизации эритроцитами барана.
Кроме того, площадь очага повреждения кожи после ТТ, а также скорость эпителизации ожоговой раны зависят от количественного и качественного представительства клеток в очаге. Так, на 7 и 14 сутки экспериментальной ТТ площадь раневого дефекта уменьшается, а скорость его эпителизации растет по мере снижения представительства в очаге нейтрофилов и увеличения – лимфоцитов и фибробластов (табл. 22, 23).
Таблица 22
Корреляционная матрица между показателями заживления ожоговой раны и клеточным составом очага повреждения
на 7 сутки ТТ у крыс
|
Показатели в очаге повреждения Показатели в периферической крови |
Площадь ожоговой раны, см2 |
Снижение площади раневого дефекта, % |
Скорость эпителизации очага ТТ, % |
|
Нейтрофилы, ед./ поле зрения |
R = 0,19 р > 0,05 |
R = −0,42 р < 0,05 |
R = −0,50 р < 0,05 |
|
Лимфоциты, ед./ поле зрения |
R = −0,26 р > 0,05 |
R = 0,15 р > 0,05 |
R = 0,41 р < 0,05 |
|
Гистиоциты, ед./ поле зрения |
R = −0,21 р > 0,05 |
R = 0,12 р > 0,05 |
R = 0,09 р > 0,05 |
|
Фибробласты, ед./ поле зрения |
R = −0,24 р > 0,05 |
R = 0,65 р < 0,05 |
R = 0,36 р < 0,05 |
Таблица 23
Корреляционная матрица между показателями заживления ожоговой раны и клеточным составом очага повреждения
на 14 сутки после ТТ у крыс
|
Показатели в очаге
Показатели |
Площадь ожоговой раны, см2 |
Снижение площади раневого дефекта, % |
Скорость эпителизации очага ТТ, % |
|
Нейтрофилы, ед./поле зрения |
R = 0,18 р > 0,05 |
R = −0,28 р > 0,05 |
R = −0,62 р < 0,05 |
|
Лимфоциты, ед./поле зрения |
R = −0,08 р > 0,05 |
R = 0,29 р > 0,05 |
R = 0,69 р < 0,05 |
|
Гистиоциты, ед./поле зрения |
R = −0,21 р > 0,05 |
R = 0,06 р > 0,05 |
R = 0,12 р > 0,05 |
|
Фибробласты, ед./поле зрения |
R = −0,81 р < 0,05 |
R = 0,41 р < 0,05 |
R = 0,81 р < 0,05 |
Таким образом, с использованием методов корреляционного анализа при экспериментальной ТТ установлена тесная связь между скоростью заживления раневого дефекта кожи и показателями иммунореактивности организма, а также морфологическими изменениями в очаге повреждения.