
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
1.1. Физические свойства воды
Физические свойства в полной мере изложены во многих работах. Вода (Н2O) – простейшее устойчивое химическое соединение водорода с кислородом, бесцветная жидкость с температурой кипения 100 °С. Химическая формула воды такая простая: Н2О; Н–О–Н [1–8]. Размер одной молекулы воды составляет около 3 Å (ангстрем) или примерно 0,28 нм (нанометра).
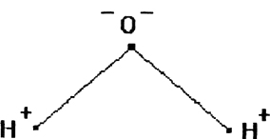
Рис. 1. Схема строения
молекулы воды
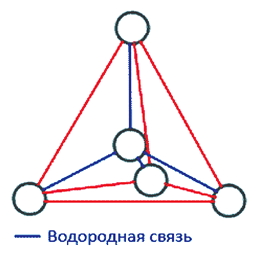
Рис. 2. Тетраэдрическая структура молекулы воды
Вода состоит из одного относительно большого атома кислорода и двух небольших атомов водорода, вокруг которого вращается облачко общих отрицательно заряженных электронов (рис. 1). Угол H–O–H молекулы H2O в газообразном и жидком виде колеблется от 104,5 до 109°
Во льду все молекулы связаны между собой водородными связями. При этом четыре связи каждой молекулы локально организованы в тетраэдрическую структуру, четыре близлежащие молекулы располагаются в вершинах трехгранной пирамиды, в центре которой находится пятая молекула
воды (рис. 2).
Положительно заряженное ядро атома кислорода, ввиду своей большой массы и заряда, сильнее притягивает к себе электронное облачко, оголяя при этом ядра водорода.
Три ядра в молекуле воды образуют равнобедренный треугольник с двумя протонами водорода в основании и кислородом в вершине. Расстояние O–H 0,9568 Å (0,1 нм); H–H – 1,54 Å (0,15 нм). Модель молекулы воды, предложенная Нильсом Бором [9], показана на рис. 3.
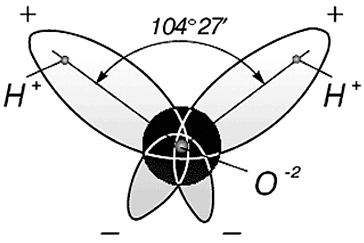

а б
Рис. 3. Строение молекулы воды, предложенное Н. Бором [9]:
а – угол между связями H–H;
б – внешний вид электронного облака молекулы воды
Свойства воды в основном зависят от водородных связей. Из-за большой разности электроотрицательности атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По причине этого, а также того, что ион водорода не имеет внутренних электронных слоев и обладает малыми размерами, он может проникать в электронную оболочку отрицательно поляризованного атома соседней молекулы. Благодаря этому каждый атом кислорода притягивается к атомам водорода других молекул и наоборот.
Каждая молекула воды может участвовать максимум в четырех водородных связях: два атома водорода – каждый в одной, а атом кислорода – в двух; в таком состоянии молекулы находятся в кристалле льда. При таянии льда часть связей рвется, что позволяет уложить молекулы воды плотнее; при нагревании воды связи продолжают рваться, и плотность ее растет, но при температуре выше 4 °С этот эффект становится слабее. При испарении рвутся все оставшиеся связи. Разрыв связей требует много энергии, отсюда высокая температура и удельная
теплота плавления и кипения и высокая теплоемкость. Вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями. Строение электронного облака молекулы воды таково, что во льду каждая молекула связана четырьмя водородными связями с ближайшими к ней молекулами, координационное число молекул в структуре льда равно четырем. О размере молекулы можно судить по величине расстояния между ближайшими молекулами во льду, составляющего 2,67 Å (0,267 нм). Соответственно молекуле воды можно приписать радиус равный 1,38 Å (0,138 нм). Дипольный момент воды равен 1,87 Дебая. Электрический дипольный момент – векторная физическая величина, характеризующая, наряду с суммарным зарядом электрические свойства системы заряженных частиц (распределения зарядов) в смысле создаваемого ею поля и действия на нее внешних полей.
Исследования показали, что в воде сохраняется ближняя упорядоченность, свойственная структуре льда. Следовательно, тенденция каждой молекулы воды к окружению четырьмя ближайшими молекулами и к образованию с ними водородных связей свойственна как жидкому, так и твердому состоянию. Расстояние между ближайшими молекулами при плавлении льда изменяется от 2,76 Å (0,276 нм) до 2,90 Å (0,29 нм). Свойственное среднее расположение ближайших молекул ведет к очень рыхлой, ажурной структуре. Именно с этим связаны аномальные свойства воды.
Почти шарообразная молекула воды имеет заметно выраженную полярность, так как электрические заряды в ней расположены асимметрично. Каждая молекула является миниатюрным диполем с высоким дипольным моментом.
Полярность молекул, наличие в них частично некомпенсированных электрических зарядов создает группировки молекул – ассоциаты. Полностью соответствует формуле Н2O лишь вода, находящаяся в парообразном состоянии. В температурном интервале от 0 до 100 °С концентрация отдельных (мономерных молекул) жидкой воды не превышает 1 %. Все остальные молекулы воды объединены в ассоциаты различной степени сложности, и их состав описывается общей формулой
[Н2O]Х. Причиной образования ассоциатов являются водородные связи. Они возникают между ядрами водорода одних молекул и электронными «сгущениями» у ядер кислорода других молекул воды.
Неравномерное распределение электрических зарядов приводит к тому, что молекула воды поляризуется, становится маленьким магнитиком.
В магнитном поле Земли молекулы воды, находящейся в жидком состоянии, собираются в некие нестабильные конструкции под действием притяжения разноименно заряженных полюсов. Нестабильность таких конструкций определяется слабостью водородных связей между молекулами воды, называемых иногда водородными мостиками.
Тетраэдрическая форма отдельной молекулы повторяется в кристаллической структуре льда. Возможно, определенную роль здесь играет то, что угол H–O–H молекулы H2O почти равен идеальному тетраэдрическому углу 109°, а молекулы воды, как мы знаем, объединяются с помощью водородных связей, которые они образуют именно в направлении O–H. Эти трехгранные пирамиды могут также объединяться в некую сверхструктуру. Во льду такая сложная трехмерная сверхструктура из тетраэдров простирается на весь объем (рис. 4).
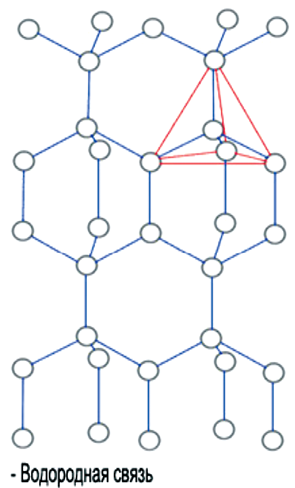
Рис. 4. Структура Н2О льда
Льдообразная молекула воды содержит как простые молекулы воды, так и кластера льдообразных структур (рис. 5).
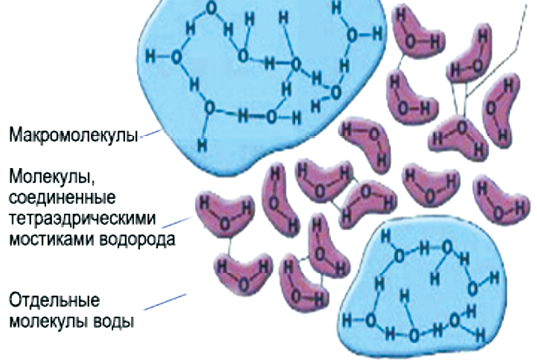
Рис. 5. Структура льдообразной воды
