
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

Сологуб Т. В., Романцова М. Г., Кремень Н. В., Александрова Л. М., Аникина О. В., Суханов Д. С., Коваленко А. Л., Петров А. Ю., Ледванов М. Ю., Стукова Н. Ю., Чеснокова Н. П., Бизенкова М. Н., Понукалина Е. В., Невважай Т. А.,
2.2.3. Сравнительная оценка использования цитофлавина и неотона в целях нормализации энергетического обеспечения миокарда
Как известно, в основе ишемического повреждения миокарда лежит диспропорция между энергетическими потребностями миокарда и интенсивностью коронарного кровотока. В громадном большинстве случаев причиной коронарной недостаточности является атеросклероз, который чаще всего поражает переднюю нисходящую (межжелудочковую) ветвь левой коронарной артерии, затем огибающую ветвь левой коронарной артерии и позднее - правую коронарную артерию [36]. Клиническая картина ишемической болезни сердца (ИБС) формируется при сужении коронарной артерии на 75 % и более. Однако в ряде случаев причинами коронарной недостаточности могут быть врожденные или приобретенные аномалии структуры коронарных артерий на фоне их воспалительного поражения инфекционной, аллергической природы, расстройств гормонального баланса, водно-электролитного гомеостаза, коагуляционного потенциала и реологических свойств крови и т.д. [20, 37].
Непосредственной причиной острой и хронической коронарной недостаточности при атеросклерозе является обструкция сосуда при формировании атеросклеротической бляшки, развитии стенозирующего атеросклероза и, наконец, тромбоза структурно измененных сосудов [36].
Следует отметить, что развитие структурных изменений коронарных сосудов неизменно дополняется изменением их функциональной активности в ответ на различные вазопрессорные и вазодилатирующие воздействия. В условиях нормы коронарные сосуды обладают исходно высоким базальным тонусом, что предопределяет возможность их интенсивной дилатации и значительного увеличения коронарного кровотока за счет избыточного усиления образования метаболитов изнашивания, активации адренергических, холинергических влияний и других гуморальных и нервных воздействий [36]. Активными вазодилататорами коронарных сосудов в условиях нормы являются ацетилхолин, катехоламины, аденозин, инозин, NO, простагландин A, простагландин E, простациклин, снижение РО2, повышение РСО2 в миокарде и др. Выраженным коронароспастическим эффектом обладают Аg II, тромбоксан, вазопрессин, нейропептид V, эндотелин и др. Резкое увеличение концентрации эндотелина в миокарде само по себе может вызвать коронарную недостаточность и ишемию миокарда.
Как известно неповрежденный эндотелий сосудов, в том числе и коронарных, обладает выраженной антикоагулянтной, антитромботической и антиагрегационной активностью за счет образования простагландина G2, NO, АДФ-азы, синтеза тромбомодулина, а также антикоагулянтов: гепаринсульфата, кофакторов серпинов, тканевого активатора плазминогена, активаторов празминогена урокиназного типа и др. [17, 35].
В случае повреждения эндотелия при атеросклеротическом поражении сосудов, а также под влиянием бактериальных, токсических, иммуноаллергических факторов обнажаются субэндотелиальные структуры с выраженными адгезивными и прокоагулянтными свойствами, среди них коллаген, фактор фон Виллибранда, фибронектин, фибриноген, ламинин, тромбин, тромбоксан А2 и др. Образование тромба в коронарных сосудах манифестирует коронарную недостаточность.
Таким образом, развитие коронарной недостаточности и ишемии миокарда - сложный процесс динамического взаимодействия структурных изменений сосудистой стенки, её прокоагулянтных и антикоагулянтных факторов, а также нарушений нервного, гормонального и метаболического статусов организма в целом.
Установлено, что факторами риска развития ИБС являются дислипидемия, в частности, гиперхолестеринемия, увеличение содержания в крови ЛПНП, триглицеридов, снижение уровня антиатерогенных фракций - ЛПВП, нарушение углеводного обмена при сахарном диабете I и II типа, развитие стрессовых ситуаций и активация процессов липопероксидации при ишемии и т.д. [36].
Несмотря на многогранность пусковых механизмов развития ИБС, существует несколько основных направлений терапии указанной патологии, включающей следующие воздействия:
1) использование коронародилататоров, антиагрегантов, тромболитиков, обеспечивающих возрастание коронарного кровотока, адекватное энергетическим потребностям миокарда. Однако в условиях реперфузии миокарда после длительной ишемии возможно дальнейшее повреждение миокарда за счет ионного дисбаланса - чрезмерного поступления Са++ в миокардиоциты и вымывания ионов К+, а также в процессе активации липопероксидации;
2) применение антиоксидантов и антигипоксантов;
3) снижение энергетических потребностей миокарда и его сократительной способности за счет использования бета-адреноблокаторов и антагонистов Са++ ;
4) использование препаратов одновременно оказывающих коронародилатирующий эффект и снижающих нагрузку на сердце;
5) обеспечение нормализации метаболического статуса, устранение дислипидемии, гипергликемии [37].
Обращает на себя внимание тот факт, что вышеперечисленный комплекс способов медикаментозной коррекции не является исчерпывающим. До настоящего времени остается дискуссионным вопрос о целесообразности использования при ишемии миокарда тех или иных антиоксидантов, антигипоксантов, макроэргических соединений - АТФ и креатинфосфата в связи с их быстрым дефосфорилированием и распадом в кровотоке и тканях [19].
Целью настоящего исследования явилась сравнительная оценка эффективности воздействия цитофлавина - комплексного препарата, сочетающего в себе свойства антиоксиданта и антигипоксанта, и экзогенного креатинфосфата (неотона) на ряд интегративных показателей состояния энергообеспечения миокарда в условиях ишемии.
Эксперименты по изучению метаболических особенностей миокарда в норме и при патологии проведены на 80 беспородных белых крысах самцах массой 250-300 г.
В гомогенатах миокарда изучено содержание АТФ и креатинфосфата с помощью наборов Био-Ла-Тест чешской фирмы «Лахема». Одновременно проведена оценка активности ряда ферментов гомогенатов миокарда и сыворотки крови, участвующих в процессах энергообеспечения миокарда - сукцинатдегидрогеназы (СДГ), лактатдегидрогеназы (ЛДГ) [17, 18], а также аспартатаминотрансферазы (АсАТ) (с помощью наборов Био-Ла-Тест чешской фирмы «Лахема»).
Сравнительные серии экспериментов проведены в следующих группах животных:
● в группе животных с экспериментальной ишемией миокарда, достигаемой окклюзией коронарной артерии по методу H.Selye. в модификации А.Б. Саидова и соавторов [43, 55] без медикаментозной коррекции;
● в группе животных с экспериментальной ишемией миокарда на фоне внутривенного введения цитофлавина сразу после окклюзии коронарной артерии в дозе 1.5 мл/кг и далее в течение трех суток наблюдения (1 раз в сутки внутривенно в указанной дозе);
● в группе животных с экспериментальной ишемией миокарда на фоне внутривенного введения неотона в дозе 1.5 мл/кг сразу после окклюзии коронарной артерии и далее 1 раз в сутки.
Влияние гипоксии и соответственно неотона на метаболизм миокарда исследовано в динамике: спустя 60 мин и 72 часа после окклюзии.
Как оказалось в группе животных с экспериментальной ишемией миокарда возникали выраженные метаболические расстройства в миокарде в динамике патологии.
Так, спустя 60 мин с момента развития окклюзии коронарной артерии возникало снижение содержания в гомогенатах миокарда креатинфосфата примерно на 25 % и уровня АТФ - на 20 %. Полученные нами результаты соответствуют общепринятым представлениям нарушения энергообеспечения миокарда в условиях ишемии. Касаясь значимости выявленного феномена, следует отметить возможность одномоментного развития реакций адаптации и дезадаптации в условиях энергодефицита, требующих определенной медикаментозной коррекции. С одной стороны, в условиях ишемии усиливается дефосфорилирование АТФ при участии 5-нуклеотидазы с образованием аденозина, обеспечивающего при определенных условиях коронародилатирующий эффект. С другой стороны, дефицит АТФ и креатинфосфата в ишемизированном миокарде приводит к подавлению всех энергозависимых реакций: трансмембранного переноса ионов, сопряжения процессов возбуждения и сокращения актомиозинового комплекса в миокарде, всех этапов синтеза белка [7].
Высказывается точка зрения о том, что наименее чувствительной к развитию ишемии миокарда является система окисления янтарной кислоты. В связи с этим представляется интерес сопоставить состояние активности ЛДГ и СДГ гомогенатов миокарда в динамике ишемии.
Результаты проведенных нами исследований свидетельствовали о том, что уже через 60 мин с момента развития ишемии возникало подавление активности СДГ гомогенатов миокарда (р<0.01) в то время, как активность ЛДГ (р<0.001) гомогенатов миокарда не отличалась от показателей контроля; одновременно отмечалось снижение активности АсАТ гомогенатов миокарда (р<0.001).
Как известно, подавление активности трансаминаз может служить косвенным показателем нарушения окислительных процессов в цикле Кребса, поскольку необходимые для переаминирования альфа-кетокислоты (α-кетоглутаровая, щавелевоуксусная) обеспечиваются реакциями ЦТК. Прямым доказательством подавления цикла Кребса является угнетение активности СДГ - флавопротеина сукцината с образованием фумарата.
Сравнительная серия экспериментов по изучению влияния цитофлавина на энергетическое обеспечение миокарда в те же сроки наблюдения (60 мин с момента развития ишемии) позволила обнаружить положительные метаболические эффекты. Так, содержание креатинфосфата гомогенатов миокарда (р<0.01) достоверно возрастало, а АТФ (р<0.01) не изменялось по сравнению с соответствующими показателями группы контроля. Это свидетельствует об активации под влиянием цитофлавина креатинфосфокиназной реакции. Одновременно возрастала активность СДГ (р<0.01) и АсАТ (р<0.001) гомогенатов миокарда, что свидетельствует об активации окисления субстратов в цикле Кребса, усилении переаминирования аминокислот с α-кетокислотами - продуктами цикла Кребса.
Спустя 72 часа с момента развития ишемии миокарда возникало прогрессирующее снижение содержания АТФ (р<0.01) и креатинфосфата (р<0.01) в гомогенатах миокарда. При этом активность СДГ гомогенатов миокарда (р<0.01) оставалась низкой, как и в предыдущий период наблюдения, а активность ЛДГ (р<0.01) и АсАТ (р<0.001) гомогенатов миокарда заметно снижалась по отношению к таковым показателям контрольной группы животных и более раннему периоду ишемии миокарда.
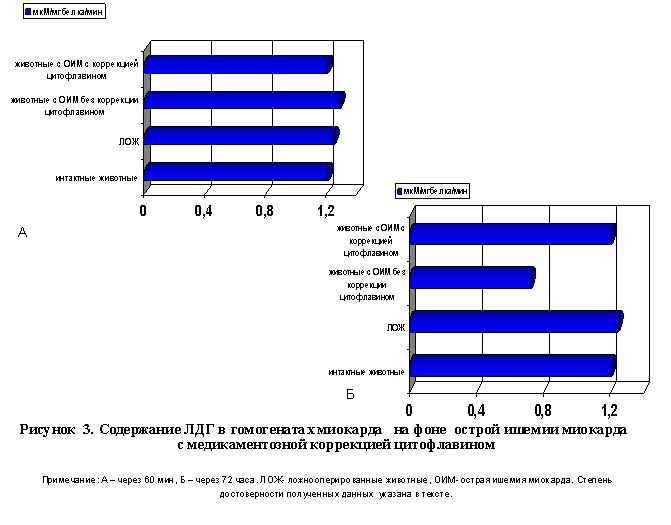
Сравнительные исследования с внутривенным введением цитофлавина спустя 72 часа с момента развития ишемии миокарда, свидетельствовали о положительных метаболических эффектах указанного препарата. Наблюдалось резкое увеличение содержания АТФ (р<0.01) и креатинфосфата (р<0.01) гомогенатов миокарда по отношению к таковым показателям группы сравнения без медикаментозной коррекции в соответствующий период ишемии миокарда. При этом уровень указанных макроэргов достигал показателей нормы. Многократное применение цитофлавина в динамике ишемии миокарда приводило и к нормализации показателей активности СДГ (р<0.01), ЛДГ (р<0.01), АсАТ (р<0.01) гомогенатов миокарда.
Таким образом, использование комплексного препарата цитофлавина обеспечивало ускорение нормализации энергетического обеспечения миокарда за счет активации гликолитической реакции и окисления субстратов в цикле трикарбоновых кислот, а также реакций перефосфорилирования с участием креатинфосфокиназы.
В сравнительной серии наблюдений с использованием той же экспериментальной модели ишемии миокарда изучены те же интегративные показатели энергообеспечения миокарда на фоне внутривенного введения неотона.
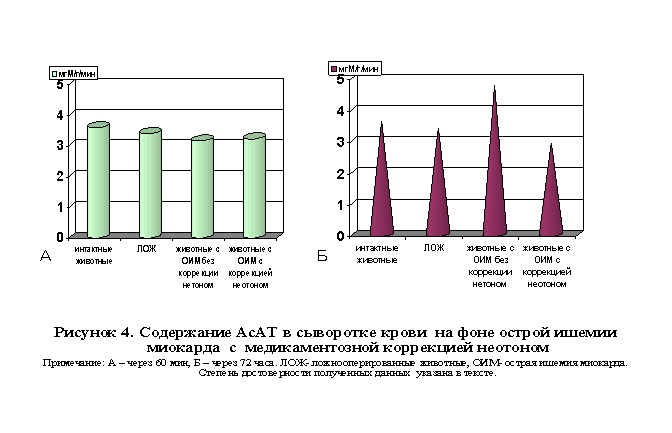
Как оказалось, спустя 60 мин с момента окклюзии коронарной артерии в гомогенатах миокарда отмечалось снижение содержания АТФ (р<0.01) и креатинфосфата (р<0.01) по сравнению с таковыми показателями интактных и ложнооперированных животных. Одновременно возникало снижение активности СДГ гомогенатов миокарда (р<0.01) - флавопротеина, катализирующего дегидрирование сукцината с образованием фумарата, а также АсАТ гомогенатов миокарда (р <0.001). Активность ЛДГ гомогената миокарда (р <0.001) в ранний период наблюдения оставалось без изменений.
Одновременно имело место повышение активности АсАТ сыворотки крови (р <0.001) при отсутствии изменений ЛДГ сыворотки крови (р <0.001).
В группе животных с экспериментальной ишемией миокарда на фоне внутривенного введения неотона спустя 60 мин после окклюзии коронарной артерии содержание в гомогенатах миокарда СДГ (р<0.01) и креатинфосфата (р<0.01) возрастало, а содержание АТФ гомогенатов миокарда (р<0.01) практически не изменялось по сравнению с группой животных с экспериментальной ишемией миокарда без медикаментозной коррекции. Одновременно несколько возрастала активность АсАТ гомогенатов миокарда (р<0.001) , не достигая однако показателей группы интактных животных. В сыворотке крови активность АсАТ (р<0.001) снижалась также, не достигая показателей нормы. Активность ЛДГ гомогенатов миокарда (р<0.001, рис. 3) и сыворотки крови (р<0.001) оставалась в пределах нормы.
Результаты проведенных исследований свидетельствуют о том, что использование неотона в ранние сроки ишемии миокарда оказывает выраженное коррегирующее влияние на ряд интегративных показателей энергообеспечения миокарда - уровень АТФ, креатинфосфата, активность СДГ, ЛДГ [4].
Спустя 72 часа с момента развития ишемии в гомогенатах миокарда возникало прогрессирующее снижение уровня АТФ (р<0.01), креатинфосфата (р<0.01). Активность АсАТ (р<0.001) и СДГ (р<0.01) гомогенатов миокарда оставалась сниженной, как и в предыдущей период наблюдения, а активность ЛДГ гомогенатов миокарда (р<0.001) - снижалась по сравнению с показателями контроля. Активность АсАТ (р<0.001) и ЛДГ (р<0.001) сыворотки крови возрастала.
Таким образом, в сравнительных сериях экспериментов с введением неотона в аналогичные периоды наблюдения в ишемизированном миокарде и сыворотки крови отмечены следующие метаболические сдвиги: возрастание уровня АТФ и креатинфосфата, активности АсАТ (р<0.001) , СДГ (р<0.01) и ЛДГ (р<0.001) в гомогенатах миокарда (р<0.01) по сравнению с таковыми показателями группы животных с ишемией миокарда без медикаментозной коррекции. Активность АсАТ (р<0.001, рис.4) и ЛДГ (р<0.001) сыворотки крови в указанной группе наблюдения заметно снижалась, что указывает на относительную стабилизацию мембран кардиомиоцитов и подавление синдрома цитолиза.
Обнаруженные нами закономерности метаболических расстройств при экспериментальной ишемии миокарда, а также положительное коррегирующее влияние цитофлавина и неотона на процессы энергообеспечения ишемизированного миокарда позволяют сделать следующие выводы:
- 1. В динамике экспериментальной ишемии миокарда возникает прогрессирующее снижение уровня АТФ и креатинфосфата в миокарде, сочетающееся с подавлением активности СДГ, ЛДГ, АсАТ.
- 2. Подавление активности СДГ опережает по времени снижение активности ЛДГ. Последнее имеет место лишь на поздних стадиях ишемии миокарда.
- 3. Достигнута положительная коррекция метаболических сдвигов в ишемизированном миокарде, более выраженная на поздних стадиях ишемии миокарда при использовании комплексного препарата цитофлавина, включающего янтарную кислоту, никотинамид, рибоксин и рибофлавин.
- 4. Цитофлавин обеспечивает противоишемический эффект за счет активации сукцинатдегидрогеназного окисления, окислительно-восстановительных процессов, поскольку никотинамид является простетической группой ферментов - кодегидрогеназы I (НАД) и кодегидрогеназы II (НАДФ) - переносчиков водорода.
- 5. Усиление энергообеспечения ишемизированного миокарда на фоне введения цитофлавина достигается и за счет рибоксина - предшественника АТФ, активатора ряда ферментов цикла Кребса, а также за счет рибофлавина мононуклеотида. Последний, как известно, входит в состав ферментов, регулирующих окислительно-восстановительные процессы.
- 6. Достигнута определенная коррекция метаболических расстройств ишемизированного миокарда на фоне введения неотона.
- 7. Неотон является не только донатором макроэргических связей, но и одновременно активизирует ЛДГ - фермент, катализирующий взаимопревращение лактата и пирувата, а также СДГ - фермента цикла Кребса и АсАТ, обеспечивающей переаминирование аминокислот.