
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

Сологуб Т. В., Романцова М. Г., Кремень Н. В., Александрова Л. М., Аникина О. В., Суханов Д. С., Коваленко А. Л., Петров А. Ю., Ледванов М. Ю., Стукова Н. Ю., Чеснокова Н. П., Бизенкова М. Н., Понукалина Е. В., Невважай Т. А.,
2.3.1. О влиянии цитофлавина и пирацетама на процессы энергообеспечения структур головного мозга в условиях экспериментальной ишемии
Несмотря на достаточно современную систему регуляции мозгового кровообращения, его нарушения возникают довольно часто под влиянием различных патогенных факторов экзогенной, или эндогенной природы и приводят к тяжелым расстройствам структуры и функции головного мозга. Это обусловлено в значительной степени метаболическими особенностями нервной ткани, ее высокой чувствительностью к гипоксии и ишемии.
Характерными особенностями метаболизма нервных клеток являются высокая интенсивность аэробных процессов и соответственно чрезвычайная чувствительность к развитию гипоксии, особенно клеток коры головного мозга.
Установлено, что нейрон коры головного мозга потребляет 250 - 450 мкл О2/ мин, в то время как гепатоциты - лишь около 60 мкл О2/мин. Снижение потребления кислорода мозгом всего лишь на 20 % приводит к потере сознания. Уже в первые минуты ишемии мозга возникает исчезновение импульсной активности нейронов. Как показали результаты проведенных нами ранее исследований [3] ишемия головного мозга приводит к резкому нарушению его энергообеспечения, активации процессов липопероксидации.
Полное восстановление функций мозга возможно лишь в тех случаях, когда длительность ишемии не превышает 5-6 мин. Хотя следует отметить, что филогенетически наиболее старые структуры более устойчивы к гипоксии. Показано, что нейроны дыхательного и сосудодвигательного центров способны функционировать при гипоксии в течение 30 мин [14, 20].
К общим закономерностям метаболических расстройств в органах и тканях, в том числе и нервной, при гипоксии различного генеза относятся активация анаэробных процессов, развитие метаболического ацидоза, интенсификация процессов липопероксидации, дестабилизация биологических мембран, в частности, цитоплазматической, митохондриальной, лизосомальной. При этом нарушаются электролитный баланс клеток, уровень их поляризации и возбудимости. Вследствие набухания митохондрий разобщаются процессы окислительного фосфорилирования и дыхания, подавляются все энергозависимые реакции. Следствием активации лизосом является развитие цитолиза и деградации соединительнотканных элементов [49].
Обращает на себя внимание тот факт, что резкое усугубление метаболических расстройств возникает в процессе реперфузии мозга в связи с избыточным поступлением в предварительно ишемизированные структуры ионов Са2+, кислорода, глюкозы, воды. При этом возникает дальнейшая активация процессов липопероксидации за счет образования активных форм кислорода, усиливаются гликолитические реакции в связи с набуханием митохондрий, блокадой цикла трикарбоновых кислот, разобщением процессов окислительного фосфорилирования и свободного дыхания.
Несмотря на довольно четкие представления о динамике метаболических сдвигов в условиях острой ишемии различных органов и тканей, в том числе и нервной, до настоящего момента остаются малоизученными характер и механизмы восстановления метаболических сдвигов в нервной ткани в условиях реперфузии. Последнее делает очевидным факт целесообразности патогенетического обоснования способов фармакологической коррекции, направленной на депотенцирование вторичных метаболических расстройств, в структурах центральной нервной системы при острых нарушениях локального, регионарного кровотока или системной гемодинамики.
Целью настоящей работы явилось изучение интенсивности гликолитических реакций и активности сукцинатдегидрогеназы - важнейшего фермента цикла Кребса при острой ишемии мозга, а также в динамике его реперфузии в сравнительных экспериментах с использованием различных способов медикаментозной коррекции расстройств метаболизма, в частности, с применением цитофлавина и пирацетама.
Эксперименты поставлены на 60 беспородных белых крысах - самцах массой 250 - 300г. Ишемическое повреждение мозга моделировали частичным пережатием общих сонных артерий.
Изучение метаболических сдвигов проведено в тканях коры головного мозга спустя 90 мин. с момента развития ишемии мозга, а также в условиях реперфузии головного мозга спустя 24 и 72 часа после снятия зажимов.
Состояние энергетических процессов в мозге оценивали по содержанию лактата и пирувата (Marbach E.P. et al., 1967), а также по активности ферментов лактатдегидрогеназы (ЛДГ) и сукцинатдегидрогеназы (СДГ), определяемых по методу Ещенко Н.Д., 1982 [17, 18].
В сравнительных сериях экспериментов на белых крысах с аналогичным моделированием ишемии мозга проведено исследование метаболических эффектов пирацетама и цитофлавина. Цитофлавин вводили внутрибрюшинно в дозе 1.5 мг/кг 2 раза в сутки. В качестве препарата сравнения изучен пирацетам (1.5 мг/кг 20 % раствор внутрибрюшинно 2 раза в сутки). Действие препаратов изучено спустя 24 часа и 72 часа после начала реперфузии.
Как и следовало ожидать, в условиях ишемии мозга (90 мин. ишемии) возникала активация анаэробных гликолитических реакций, о чем свидетельствовало резкое возрастание уровня лактата (почти в 3 раза) в гомогенатах мозга (р<0.001), при одновременном уменьшении уровня пирувата (р<0.001), и резкое возрастание коэффициента лактат / пируват по сравнению с таковыми показателями ложнооперированных животных. Одновременно имело место резкое возрастание активности ЛДГ гомогенатов мозга (р<0.001).
Как известно, ЛДГ катализирует обратимую реакцию взаимопревращения лактата и пирувата, не относится к лимитирующим ферментам гликолиза в связи с высокой активностью:
Лактат + NAD+↔ Пируват + NADH+ + Н+
В условиях недостаточной оксигенации мозга и высокой активности ЛДГ возрастает скорость поглощения пирувата и трансформации его в лактат, что и определяет обнаруженное нами увеличение содержания лактата в условиях экспериментальной ишемии мозга.
Спустя 90 мин. ишемии мозга возникало резкое подавление активности СДГ (р<0.001, рис. 4). Как известно, СДГ - один из важнейших ферментов цикла Кребса - флавопротеин, прочно связанный с внутренней митохондриальной мембраной, катализирующий дегидрирование сукцината с образованием фумарата.
Таким образом, как показали результаты проведенных нами исследований, СДГ является довольно чувствительным ферментом к ишемии мозга, обрывая цикл трикарбоновых кислот при гипоксических состояниях. Аналогичный факт обнаружен нами и в условиях экспериментальной ишемии миокарда [3, 4]
Спустя 1 сутки с момента реперфузии содержание лактата в гомогенатах мозга снижалось (р<0.01) по сравнению с предыдущим периодом наблюдения (90 мин. ишемии), превышая, однако, показатели интактных животных. В то же время еще более снижалось содержание пирувата по сравнению с показателями группы интактных животных (р<0.001), возникало дальнейшее возрастание показателя - лактат
/ пируват.
Спустя сутки с момента развития реперфузии мозга активность ЛДГ (р<0.001) оставалась высокой, а СДГ - низкой по сравнению с таковыми показателями группы неишемизированных животных. В то же время активность СДГ несколько возрастала (р<0.001) по сравнению с соответствующими показателями предыдущего периода наблюдения (90 мин. ишемии).
В последующих экспериментах проведена сравнительная оценка метаболических эффектов пирацетама и цитофлавина в динамике реперфузии мозга.
Как известно, пирацетам - ноотропное средство, широко используется в клинической практике при гипоксических состояниях, интоксикациях, нарушениях мозгового кровообращения и т.д. Пирацетам улучшает микроциркуляцию в ишемизированных зонах мозга, подавляет активированную агрегацию тромбоцитов, усиливает утилизацию глюкозы и т.д. [32].
Как оказалось, пирацетам проявлял положительные эффекты на изучаемые нами метаболические процессы в ишемизированном мозге спустя 1 сутки после его реперфузии. При этом установлено, что содержание лактата в гомогенатах мозга (р<0.001) снижалось по сравнению с показателями контрольной группы, где использовали плацебо, не достигая, однако, показателей группы ложнооперированных животных. В то же время уровень пирувата возрастал (р<0.001), а показатель лактат / пируват заметно снижался.
При этом достоверно возрастала активность СДГ (р<0.001), а ЛДГ (р<0.001) снижалась по сравнению с показателями соответствующей группы наблюдения (1 сутки реперфузии) без медикаментозной коррекции.
Таким образом, результаты проведенных исследований позволили выявить новые метаболические эффекты пирацетама при реперфузии ишемизированного мозга на клеточном уровне, свидетельствующие об активации аэробного окисления под влиянием указанного препарата и усилении вовлечения продуктов гликолитических реакций в цикл трикарбоновых кислот.
В последующих наблюдениях проведена сравнительная оценка метаболических эффектов цитофлавина в условиях реперфузии ишемизированного мозга.
Сравнительные серии наблюдений, проведенные спустя 1 сутки после реперфузии ишемизированного мозга, позволили выявить положительные метаболические эффекты цитофлавина более выраженные, чем у пирацетама по некоторым изучаемым показателям.
Так, на фоне использования цитофлавина возникало резкое повышение активности СДГ (р<0.001), превышающее даже показатели контрольной группы неишемизированных животных.
В то же время при введении цитофлавина спустя 1 сутки реперфузии мозга происходила достаточно выраженная нормализация гликолитических реакций, на что указывали выраженное снижение уровня лактата (р<0.001), возрастание уровня пирувата (р<0.001), снижение коэффициента лактат / пируват, снижение активности ЛДГ (р<0.001) по сравнению с аналогичными показателями группы сравнения с использованием плацебо. Однако вышеуказанные показатели не достигали таковых в группе контроля (без ишемии мозга).
Далее предоставлялось целесообразным проследить в динамике реперфузии ишемизированного мозга (спустя 3 суток) характер нарушений метаболического статуса в гомогенатах мозга и дать оценку биологическим эффектам пирацетама и цитофлавина.
Как оказалось в указанный период наблюдения еще не возникало полной нормализации гликолитических реакций и реакций аэробного окисления.
В опытах с введением плацебо отмечено, что уровень лактата в гомогенатах мозга (р<0.001), отношение лактат / пируват превышали таковые показатели в группе контроля (ложнооперированные, без экспериментальной ишемии). В то же время активность ЛДГ и СДГ практически нормализовалась (р<0.001).
Состояние метаболизма в гомогенатах мозга на фоне введения пирацетама в этот период наблюдения свидетельствовали о выраженной тенденции к нормализации.
При этом уровень пирувата (р<0.001) достигал показателей контроля (ложнооперированные, без экспериментальной ишемии), нормализовалась активность ЛДГ (р<0.001). Активность СДГ (р<0.001, рис. 6) была несколько снижена, а коэффициент лактат / пируват повышался по сравнению с показателями контроля, как и в группе животных без медикаментозной коррекции.
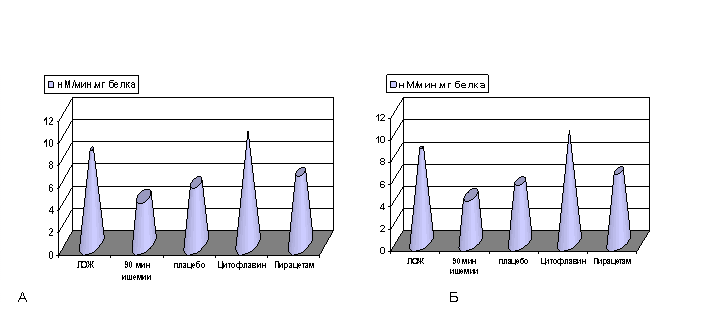
Рисунок 6. Влияние медикаментозной коррекции на активность СДГ в гомогенатах ишемизированного мозга и на фоне его реперфузии
Примечание: А - реперфузия 1 сутки, Б - реперфузия 3 суток. ЛОЖ - ложнооперированные животные. Степень достоверности полученных данных указаны в тексте.
Эффекты цитофлавина на гликолитические реакции в мозге были более выраженными, чем эффекты пирацетама, о чем свидетельствовала нормализация уровня лактата и активности ЛДГ. Эффекты цитофлавина на активность СДГ и уровень пирувата в гомогенатах мозга были аналогичными таковым в группе животных с использованием пирацетама: активность СДГ, как и в опытах без медикаментозной коррекции была несколько ниже показателей контроля (ложнооперированные, без экспериментальной ишемии), а содержание пирувата в гомогенатах мозга нормализовалось.
Резюмируя результаты проведенных исследований, необходимо заключить, что в динамике развития экспериментальной ишемии мозга и его реперфузии возникают следующие метаболические сдвиги:
- 1. Одномоментная активация гликолитических реакций и подавление цикла трикарбоновых кислот, на что указывают возрастание уровня лактата, активация ЛДГ при одновременном снижении содержания пирувата и активности СДГ в гомогенатах ишемизированного головного мозга белых крыс.
- 2. Спустя 1 сутки с момента реперфузии мозга не отмечается нормализации метаболизма в гомогенатах мозга предварительно ишемизированных животных.
- 3. Спустя 3 суток с момента реперфузии имеют место нормализация активности ЛДГ, возрастание активности СДГ, в то же время уровень лактата превышал, а пирувата - оставался сниженным по сравнению с показателями контроля.
- 4. Пирацетам и цитофлавин оказывают депотенцирующий эффект на метаболические расстройства, возникающие при реперфузии предварительно ишемизированного мозга.
- 5. Спустя 3 суток с момента реперфузии ишемизированного мозга обнаруживаются более выраженные эффекты цитофлавина по сравнению с пирацетамом на интенсивность гликолитических реакций гомогенатов мозга, о чем свидетельствовало большее снижение содержания лактата и его нормализация по сравнению с таковыми показателями, на фоне введения пирацетама.