
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
1.1. Вариабельность ритма сердца
Для оценки риска развития неблагоприятных сердечных событий широко используется анализ вариабельности ритма сердца (ВРС), которая представляет собой временные колебания интервалов между последовательными ударами сердца (интервалов RR) и рассматривается как маркер активности вегетативной нервной системы (ВНС) [206]. ВРС – количественное выражение, мера синусовой аритмии. В последние годы возрос интерес к изучению ВРС как показателя, отражающего автономную регуляцию сердца и определяющего риск внезапной сердечной смерти [100, 226, 228]. В настоящее время ВРС признана наиболее информативным и доступным методом оценки вегетативной регуляции сердечного ритма и является неотъемлемой частью обследования кардиологических больных [227].
Несмотря на большое количество исследований, свидетельствующих о взаимосвязи симпатики, парасимпатики, барорефлекса, системы терморегуляции, гуморальных влияний с определенными временными и спектральными показателями ВРС, к настоящему времени накоплен большой фактический материал, не позволяющий однозначно рассматривать ВРС как метод оценки вагосимпатического баланса. Так, эксперты клиники Мэйо (США), проанализировав работы за 20-летний период в области ВРС, отметили, что, учитывая множественный характер эндо- и экзогенных факторов, влияющих на формирование структуры ритма сердца, параметры ВРС не отражают истинное состояние ВНС у больных с кардиоваскулярной патологией.
Основной целью исследования ВРС при суточном мониторировании ЭКГ (на длительных промежутках времени) является оценка функционального состояния пациента. Функциональное состояние пациента – это способность и готовность организма выполнять различные функции (по И.К. Анохину, 1975) [5], в частности – поддержание его гомеостаза и интеллектуального состояния [11]. Общей мерой для всех этих функций можно считать энергию, затраченную на их выполнение. Живой организм при взаимодействии с внешней средой стремится достигнуть полезного результата с наименьшими энергетическими затратами.
Одним из показателей нормального функционирования систем является нормальная ВРС. Высокая ЧСС, снижение ВРС и синусовой аритмии являются неблагоприятными факторами при оценке функционального состояния пациента [4, 123, 224]. Преобладание симпатической активности характерно для состояния стресса и неблагоприятно сказывается на деятельности сердечно-сосудистой системы, приводит к развитию тахикардии, сердечных аритмий, ишемии миокарда, гипертонических кризов [28, 113, 222, 223]. У пациентов с АГ и цереброваскулярными заболеваниями имеются изменения ВРС с преобладанием активности симпатической нервной системы [108]. Снижение ВРС связано с возрастом [21, 87].
Инсульт приводит не только к повышению уровня катехоламинов плазмы, но и изменениям автономной регуляции сердечно-сосудистой системы, нарушению ВРС, что может негативно влиять на электрическую нестабильность миокарда, провоцировать аритмии, которые могут ухудшать гемодинамику и негативно влиять на репаративные процессы в зоне церебральной ишемии [36, 145, 184]. При развитии ишемического инсульта отмечалась положительная корреляция между частотными показателями ВРС и уровнями систолического и диастолического АД в дневные и ночные часы, что свидетельствует о едином механизме, участвующем в регуляции работы сердечно-сосудистой системы, и его нарушении у больных в остром периоде ИИ [24]. Дисфункция вегетативной регуляции сердечно-сосудистой системы влияет на выживаемость после инсульта [193, 264].
В острейшем периоде ИИ происходит угнетение вегетативной регуляции сердца со снижением всех параметров ВРС и циркадного
индекса (ЦИ) ЧСС. Выявлена прямая связь между суммарной вегетативной активностью (SDNN) и тяжестью неврологического дефицита в начале и по окончании острого периода [114]. Риск возникновения инсульта коррелирует с низкими показателями SDNN ночью [176]. При наличии депрессии у больных с инсультом SDNN был зна-
чительно ниже [246].
При инсульте наблюдалось большее, чем у пациентов с гипертоническим кризом, снижение временных показателей ВРС и ЦИ [23, 128]. Отмечено снижение ВРС у больных с АГ в острейшем периоде ИИ [23]. К концу острого периода увеличивается выраженность вегетативного дефицита у больных ХСН, что обусловлено диффузными изменениями сердечной мышцы, приводящими к перестройке внутрисердечного вегетативного аппарата [115].
При наличии выраженного неврологического дефицита по окончании раннего восстановительного периода инсульта у больных хронической сердечной недостаточностью I-II ФК в динамике, по сравнению с острым периодом (7–10-й день болезни), выявлено статистически значимое снижение ВРС, нарастание активности симпатико-адреналовой системы. Регресс неврологической симптоматики в раннем восстановительном периоде ишемического МИ сопровождается уменьшением вегетативной дисфункции по данным ВРС [51].
Лакунарный инсульт в остром периоде сопровождается изменениями ВРС [37]. Сниженная парасимпатическая активность коррелирует с неблагоприятным ранним прогнозом у лиц с атеротромботическим
инсультом [182].
В остром периоде инсульта происходит снижение ВРС, обусловленное поражением определенных мозговых структур [210, 211]. К концу острого периода максимальный дефицит вегетативных влияний на ритм сердца сохраняется у больных с инсультом в вертебрально-базилярной системе и при большом очаговом поражении [114]. Проспективное наблюдение на протяжении 1 года состояния вегетативного статуса у больных после инсульта в вертебрально-базилярном бассейне указывает на значительную стойкость выявленных нарушений ВРС [133]. Cнижение ВРС более выраженно при правосторонней локализации церебрального поражения. При этом самые низкие значения ВРС регистрировались при вовлечении в патологический очаг правого островка [265]. При правосторонней локализации инсульта независимо от поражения островковой доли имеется стойкий дефицит вегетативной регуляции, в большей степени за счет парасимпатической составляющей, что может быть связано с более неблагоприятным прогнозом [115].
В острейшем периоде ИИ у больных с преимущественным поражением каротидного бассейна с образованием больших и средних по размеру очагов отмечается стойкое нарушение сердечно-сосудистой автономной регуляции.
Выявлены взаимосвязи церебральной и центральной гемодинамики в остром периоде вертебробазилярного инсульта ишемического генеза, выражающиеся в снижении мозгового кровотока не только в бассейне позвоночных артерий, но и в целом, при одновременном увеличении показателей насосной функции сердца в первые сутки мозговой катастрофы и с последующим её снижением к концу 3-й недели; при этом падение сердечного индекса менее 1,8 являлось прогностически неблагоприятным [42].
К концу острого периода инсульта увеличивается выраженность вегетативного дефицита у больных с хронической сердечной недостаточностью (ХСН), что обусловлено диффузными изменениями сердечной мышцы, приводящими к перестройке внутрисердечного вегетативного аппарата [116]. Регресс неврологической симптоматики в раннем восстановительном периоде ИИ сопровождается уменьшением вегетативной дисфункции по данным ВРС [51].
ЦИ ЧСС характеризует изменчивость ритма в течение суток и является важной характеристикой патологического процесса. Циркадные колебания частоты кардиальных кризов тесно связаны с биоритмами изменений электрофизиологических свойств в миокарде [187]. В первые сутки ИИ отмечается существенное снижение ЦИ, сохраняющееся на протяжении последующих трех недель. При локализации очага в вертебро-базилярной системе снижение ЦИ носит стойкий характер и свидетельствует о стабильности нарушений функциональных резервов сердечно-сосудистой системы, поражение в каротидной системе сопровождается адекватной реакцией ЦИ в процессе восстановления [145]. У больных с различным течением инсульта встречаются разные варианты изменений вегетативной регуляции и неодинаковая степень их выраженности, что позволяет использовать оценку изменений обоих отделов ВНС для прогнозирования тяжести и исхода заболевания [173, 181, 183, 212].
Наиболее информативные критерии ВРС, которые с вероятностью 70–82 % ассоциируются с высоким риском летального исхода при инсульте: SDNN < 60 мс, SDANN < 45 мс, rMSSD < 15 мс [128]. Выдвинута гипотеза о том, что параметры ВРС наряду с клиническими характеристиками могут быть предикторами прогрессирующего клинического течения ИИ [38].
У пациентов с тяжелым ИИ при анализе ВРС в первые трое суток заболевания выявлены более низкие показатели SDNN [82]. У больных с тяжелым течением инсульта (включая летальные исходы) повышается активность симпатического отдела ВНС, при этом на ЭКГ регистрируются признаки повреждения или ишемии субэндо- или субэпикарда [9]. Примерно за день до смерти у больных с неблагоприятным, несмотря на проводимую терапию, течением заболевания еще больше снижалась ВРС, что свидетельствовало о практически полном прекращении вегетативного контроля за функциями сердечно-сосудистой системы [128].
Согласно литературным данным нарушения ВРС при среднетяжелом и тяжелом инсульте стойкие, тогда как при легком инсульте данные о динамике ВРС противоречивы. При легком течении инсульта напряжение симпатического отдела вегетативной нервной системы, как правило, отмечается только в первые сутки болезни с последующим преобладанием тонуса парасимпатического отдела. Изменения на ЭКГ у таких больных обычно не встречаются [49]. У больных с малыми по размеру ишемическими очагами появление автономной дизрегуляции проявляется лишь к концу острого периода [142].
1.1.1. Вариабельность ритма сердца в острейшем периоде инсульта
В проведенном исследовании ВРС оценивали в соответствии с рекомендациями [12, 27, 110, 113].
Оценивали следующие временные показатели:
♦ SDNN (мс) – стандартное (среднеквадратичное) отклонение полного массива последовательных интервалов RR (NN), которое представляет суммарный эффект вегетативной регуляции сердца;
♦ SDNNi (мс) – индекс SDNN, среднее значение стандартных отклонений последовательных 5 минутных участков суточной записи RR интервалов, отражающее вариабельность с цикличностью 5 минут;
♦ RMSSD (мс) – квадратный корень средней суммы разностей последовательных пар интервалов RR или среднеквадратичная разница между соседними интервалами RR, отражающий активность парасимпатического звена вегетативной регуляции;
♦ pNN50 (%) – количество последовательных интервалов RR, различие между которыми превышает 50 мс выраженное в процентах к общему числу кардиоинтервалов, отражающий степень преобладания парасимпатического звена регуляции над симпатическим.
Циркадный профиль частоты сердечных сокращений оценивали по циркадному индексу. ЦИ рассчитывали как отношение средней дневной ЧСС к средней ночной ЧСС. Циркадный профиль считали правильным при ЦИ от 1,24–1,42, ригидным – при ЦИ < 1,2, усиленным – при ЦИ > 1,45 (Макаров Л.М., 2011). Незначительное отклонение циркадного профиля от нормы (пограничное значение) считали при значении ЦИ в пределах 1,2–1,23.
Кроме временных показателей ВРС использовали метод «анализа коротких участков» [110]. Интегральное заключение по ВРС проводилось по доле участков с малой вариабельностью: если больше 60 %, то «Резко снижена», от 30 до 60 % – «Умеренно снижена», меньше
30 % – «Норма».
С помощью исследования ВРС можно получить новые дифференциально-диагностические критерии дисфункции сердечно-сосудистой системы, в том числе и в результате сосудистого церебрального поражения. ВРС представляет собой объективный и чувствительный индикатор церебральной функции при инсульте.
В табл. 1.1.1 представлена сравнительная характеристика ЧСС, показателей ВРС и ЦИ пациентов, включенных в исследование. Средняя ЧСС в исследуемых группах была примерно одинаковой. Максимальное снижение SDNN отмечено у пациентов ОГ: на 11,36 % (P < 0,01) ниже, чем в ГК и на 18,07 % (P < 0,001) ниже, чем в ГЗК. SDNNi в ОГ был минимальным, однако разница была статистически незначима. Межгрупповых различий показателей rMSSD и pNN50 не было. Известно, что показатели SDNN и SDNNi отражают суммарный эффект вегетативной регуляции сердца, поэтому их снижение свидетельствует об ослаблении вегетативной регуляции сердечно-сосудистой системы в целом (как симпатической, так и парасимпатической) и снижении адаптационных возможностей сердечно-сосудистой системы, что является неблагоприятным фактором.
ЦИ у больных ОГ был самым низким и составил 1,12: ниже, чем в ГК – на 5,08 % (P < 0,001) и ниже, чем в ГЗК – на 11,11 % (P < 0,001). При индивидуальной оценке ЦИ оказалось, что у больных ОГ ригидный циркадный профиль ритма встречался на 28,78 % чаще (Р < 0,001), чем в ГК (в 85,19 % случаев против 56,41 %) и на 61,86 % чаще (P < 0,001), чем в ГЗК (в 85,19 % случаев против 23,33 %).
Циркадная изменчивость параметров сердечного ритма является оригинальным проявлением ВРС и отражает функциональные резервы сердечно-сосудистой системы при адаптации к суточному циклу дневной активности.
Существенное снижение ЦИ у пациентов ОГ свидетельствует о выраженном нарушении центрального и вегетативного звена регуляции ритма сердца, что может ассоциироваться с неблагоприятным прогнозом и высоким риском аритмогенных синкопальных состояний и внезапной смерти.
Таблица 1.1.1
Вариабельность ритма сердца (М ± m; n, %)
|
Показатели |
ОГ (n = 108) |
ГК (n = 78) |
ГЗК(n = 30) |
|
ЧСС за сутки |
69,21 ± 0,98 |
69,61 ± 1,12 |
71,10 ± 1,45 |
|
SDNN, мс |
112,00 ± 3,45 |
126,35 ± 4,21 P1 < 0,01 |
136,70 ± 5,58 P1 < 0,001 |
|
SDNNi, мс |
48,81 ± 1,67 |
49,82 ± 2,06 |
51,27 ± 1,94 |
|
rMSSD, мс |
27,53 ± 1,42 |
27,71 ± 1,91 |
25,83 ± 1,63 |
|
pNN50, ٪ |
6,18 ± 0,73 |
6,47 ± 0,82 |
5,70 ± 1,09 |
|
ЦИ |
1,12 ± 0,01 |
1,18 ± 0,01 P1 < 0,001 |
1,26 ± 0,01 P1 < 0,001; P2 < 0,001 |
|
Интегральная оценка ВРС (n, ٪) |
|||
|
Нормальная |
39 (36,11 ٪) |
31 (39,74 ٪) |
15 (50 ٪) |
|
Умеренно снижена |
26 (24,07 ٪) |
27 (34,62 ٪) |
12 (40 ٪) |
|
Резко снижена |
43 (39,82 ٪) |
20 (25,64 ٪) P1 < 0,05 |
3 (10 ٪) Р١ < 0,001; Р٢ < 0,001 |
|
Синусовая аритмия |
35 (32,41 ٪) |
44 (56,41 ٪) P1 < 0,002 |
28 (90,33 ٪) P1 < 0,001; P2 < 0,001 |
Примечание. P1 – ошибка достоверности различий в сравнении c ОГ; P2 – с ГК.
При оценке ВРС методом «анализа коротких участков» снижение вариабельности у больных ОГ и ГК было более заметным. Так в ОГ количество пациентов с резко сниженной ВРС было в 1,55 раза больше (P < 0,05), чем в ГК и в 3,98 раза больше (P < 0,001), чем в ГЗК.
Интересным наблюдением было то, что с уменьшением ВРС уменьшалась распространенность синусовой аритмии в ОГ и ГК в сравнении с практически здоровыми пациентами, причем частота выявления синусовой аритмии в ОГ была меньше в 1,74 раза (P < 0,002), чем в ГК и в 2,79 раза (P < 0,001), чем в ГЗК.
Синусовая аритмия присуща как здоровым, так и больным людям. У здоровых синусовая аритмия связана с актами дыхания. Дыхательная аритмия свидетельствует о нормальном функционировании вегетативной нервной системы и расценивается как благоприятный фактор, а исчезновение дыхательной аритмии и вообще синусовой аритмии обусловлено снижением функции вегетативной нервной системы и имеет неблагоприятный прогноз [43].
Результаты исследования показали, что в острейшем периоде ИИ снижаются ВРС и ЦИ ЧСС, уменьшается распространенность синусовой артмии, что свидетельствует о снижении механизмов адаптации организма и является неблагоприятным прогностическим фактором.
1.1.2. Вариабельность ритма сердца в зависимости от тяжести и локализации очага инсульта
Клинико-демографическая характеристика больных ОГ в зависимости от тяжести представлена в табл. 1.1.2.1. Пациенты с тяжелым инсультом были тяжелее по степени АГ и распространенности среди них СД.
Таблица 1.1.2.1
Сравнительная характеристика больных в зависимости
от тяжести ИИ (n, %; М ± m) (n = 108)
|
Характеристика больных |
Тяжесть инсульта |
||
|
Легкая (n = 20) |
Средняя (n = 80) |
Тяжелая (n = 8) |
|
|
Средний возраст, годы |
57,46 ± 2,71 |
62,16 ± 1,27 |
62,63 ± 4,41 |
|
АГ, I степень АГ, II степень АГ, III степень |
9 (45 ٪) 9 (45 ٪) 2 (10 ٪) |
13 (16,25 ٪) P1 < 0,02 41 (51,25 ٪) 26 (32,5 ٪) P1 < 0,005 |
1 (12,5 ٪) P2 < 0,05 4 (50 ٪) 3 (37,5 ٪) |
|
Стенокардия напряжения Инфаркт миокарда в анамнезе СД 2 тип |
4 (30,7 ٪) 1 (7,7 ٪) 1 (7,7 ٪) |
43 (49,4 ٪) 10 (11,5 ٪) 19 (21,8 ٪) |
2 (25 ٪) 0 4 (50 ٪) P1 < 0,05 |
|
Окружность талии (ОТ), см |
94,25 ± 5,31 |
102,26 ± 2,42 |
99,23 ± 6,31 |
|
ИМТ, кг/м2 |
26,93 ± 0,81 |
29,41 ± 0,69 P1 < 0,05 |
25,26 ± 1,94 |
|
Глюкоза крови натощак, ммоль/л |
4,88 ± 0,33 |
5,94 ± 0,24 P1 < 0,01 |
7,68 ± 1,04 P1 < 0,02 |
|
ОХС, ммоль/л |
4,21 ± 0,38 |
5,47 ± 0,22 P1 < 0,01 |
4,42 ± 0,37 |
|
ХС ЛПВП, ммоль/л |
1,17 ± 0,39 |
0,97 ± 0,09 |
0,81 ± 0,10 |
|
ТГ, ммоль/л |
1,13 ± 0,28 |
1,36 ± 0,16 |
0,87 ± 0,17 P2 < 0,05 |
|
ХС ЛПНП, ммоль/л |
1,91 ± 0,38 |
4,15 ± 0,47 P1 < 0,001 |
4,20 ± 0,42 P1 < 0,001 |
|
Калий, ммоль/л |
4,2 ± 0,50 |
4,22 ± 0,09 |
4,63 ± 0,61 |
|
Магний, ммоль/л |
0,86 ± 0,06 |
0,90 ± 0,01 |
0,93 ± 0,02 |
Примечание. Ошибка достоверности различий в сравнении с показателями при инсульте: Р1 – легком, Р2 – средней тяжести.
Уровни липидов плазмы у пациентов с легким инсультом были нормальными. С увеличением тяжести инсульта липидный спектр имел более проатерогенный сдвиг: уровень ХС ЛПНП при средней тяжести и тяжелом инсульте был в 2,2 раза выше (P < 0,001), чем при легком. Уровень ХС ЛПВП снижался с увеличением тяжести инсульта. ИА при средней тяжести и тяжелом инсульте был соответственно
в 3 (P < 0,001) и 2, 1 (P < 0,02) раза выше, чем при легком.
Параллельно увеличению количества больных с СД и тяжести инсульта увеличивался и уровень глюкозы крови натощак. Уровни калия и магния при различной тяжести инсульта были примерно одинаковы и находились в пределах нормы.
Тяжесть инсульта прямо и слабо коррелировала с возрастом пациентов (r = 0,188; P < 0,05), уровнем ХС ЛПНП (r = 0,223; P < 0,05), ИА (r = 0,201; P < 0,05), уровнем глюкозы крови (r = 0,273; P < 0,01).
При изучении особенностей ВРС в зависимости от тяжести инсульта (табл. 1.1.2.2) оказалось, что с увеличением тяжести увеличивалась выраженность нарушений ВРС. Так среднесуточная ЧСС при тяжелом инсульте была выше на 13,3 % (P < 0,05) в сравнении с легким и на 11 % выше (P < 0,05) в сравнении с инсультом средней тяжести. Известно, что синусовая тахикардия в состоянии покоя свидетельствует о нарушении автономной регуляции сердца с преобладанием симпатических влияний на сердце [113].
Почти все временные показатели ВРС снижались с увеличением тяжести инсульта, при этом различия между легким и средней тяжести были статистически незначимы, а при тяжелом – снижение показателей было достоверным.
SDNN и SDNNi у пациентов с тяжелым инсультом были снижены соответственно в 1,4 (P < 0,05) и в 1,5 (P < 0,005) раза в сравнении с пациентами с легким инсультом и в 1,2 (P < 0,05) и 1,3 (P < 0,005) раза в сравнении с пациентами средней тяжести. rMSDD и pNN50 при тяжелом инсульте были соответственно ниже таковых в 1,7 (P < 0,01) и 7 (P < 0,02) раз в сравнении с легким инсультом и в 1,7 (Р < 0,001) и 6,4 (Р < 0,001) раза в сравнении с пациентами средней тяжести.
При сравнении временных показателей ВРС ОГ с различной тяжестью инсульта с показателями ГК оказалось, что при легком инсульте показатели существенно не различались, а уже при инсульте средней тяжести было достоверное снижение SDNN на 11,7 % (P < 0,001).
Полученные данные свидетельствуют о значительном снижении ВРС у больных с тяжелым инсультом, как за счет снижения общей вегетативной регуляции, так и об ослаблении парасимпатических влияний на сердце.
Таблица 1.1.2.2
Вариабельность ритма сердца в зависимости
от тяжести инсульта (М ± m; n, %)
|
Показатели |
ГК (n = 78) |
Тяжесть инсульта |
||
|
Легкая (n = 20) |
Средняя (n = 80) |
Тяжелая (n = 8) |
||
|
ЧСС за сутки |
69,61 ± 1,12 |
67,75 ± 2,26 |
68,91 ± 1,1 |
76,50 ± 3,65 P1 < 0,05 Р٢ < 0,05 |
|
SDNN, мс |
126,35 ± 4,21 |
126,0 ± 9,76 |
111,51 ± 3,78 P3 < 0,001 |
91,00 ± 9,22 P1 < 0,05 P2 < 0,05 |
|
SDNNi, мс |
49,82 ± 2,06 |
53,83 ± 4,73 |
48,94 ± 1,86 |
36,83 ± 3,49 P1 < 0,005 P2 < 0,005 P3 < 0,001 |
|
rMSSD, мс |
27,71 ± 1,91 |
27,92 ± 4,08 |
28,25 ± 1,60 |
16,67 ± 1,43 P1 < 0,01 Р2 < 0,001 P3 < 0,001 |
|
pNN50, % |
6,47 ± 0,82 |
7,00 ± 2,40 |
6,44 ± 0,81 |
1,00 ± 0,26 P1 < 0,02 Р٢ < 0,001 P3 < 0,001 |
|
ЦИ |
1,18 ± 0,01 |
1,12 ± 0,03 |
1,13 ± 0,01 P3 < 0,001 |
1,06 ± 0,04 P3 < 0,001 |
|
Интегральная оценка ВРС (n, ٪) |
||||
|
Нормальная |
31 (49,8 ٪) |
9 (45 ٪) |
30 (37,50 ٪) |
0 |
|
Умеренно снижена |
27 (34,6 ٪) |
8 (40 ٪) |
16 (20 ٪) |
2(25,00 ٪) |
|
Резко снижена |
20 (25,6 ٪) |
3 (15 ٪) |
34 (42,50 ٪) P1 < 0,05 P3 < 0,05 |
6 (75,00 ٪) P1 < 0,05 P2 < 0,05 P3 < 0,05 |
|
Синусовая аритмия |
44 (56,4 ٪) |
16 (80,00 ٪) |
19 (23,75 ٪) P1 (P < 0,001) P3 (P < 0,001) |
0 |
Примечание. Ошибка достоверности различий в сравнении с показателями пациентов: P1 – легким инсультом, Р2 – инсультом средней тяжести, Р3 – с ГК.
ЦИ при легком инсульте имел тенденцию к снижению, а при средней тяжести и тяжелом был ниже, чем в ГК на 5,1 % (P < 0,001) и на 10,2 % (P < 0,001) соответственно.
Анализ ВРС по интегральной оценке методом «анализа коротких участков» также показал увеличение распространенности резко сниженной ВРС с увеличением тяжести инсульта. При тяжелом инсульте резко сниженная ВРС встречалась чаще на 60 % (P < 0,05) в сравнении с легким и на 32,5 % в сравнении с инсультом средней тяжести (P < 0,05). Кроме этого, при инсульте средней тяжести отмечалось достоверное уменьшение распространенности выраженной синусовой аритмии в сравнении с пациентами ГК и легким инсультом (на 32,65 %; P < 0,001 и 56,25 %; P < 0,001 соответственно) и ее исчезновение у пациентов с тяжелым инсультом.
Сравнительный анализ ВРС по интегральной оценке больных ОГ с ГК показал, что при легком инсульте показатели существенно не различались, а при инсульте средней тяжести было достоверное снижение количества больных с нормальной ВРС – 37,5 % против 49,8 % (P < 0,05) и увеличение количества пациентов с резко сниженной ВРС – 42,5 % против 25,6 % (P < 0,05).
Изложенное показывает, что снижение ВРС в острейшем периоде инсульта зависит от его тяжести: при легком инсульте ВРС не снижается, при средней тяжести и особенно тяжелом – существенно снижается, что является неблагоприятным фактором. Учитывая отсутствие различий практически всех, используемых нами показателей ВРС у больных с легким инсультом с ГК, появление различий показателей SDNN, ЦИ и интегрального заключения методом анализа «коротких участков» в сравнении с показателями ГК при средней тяжести инсульта, мы предположили, что эти три показателя обладают наибольшей чувствительностью в оценке ВРС. При нарастании тяжести снижения ВРС (при тяжелом инсульте) снижались (реагировали) все, используемые нами показатели.
Известно, что в регуляции сердечного ритма участвует центральная и вегетативная нервная система, поэтому поражение различных мозговых структур может оказывать влияние на биоэлектрическую активность сердца, то есть локализация инсульта может оказывать собственное влияние на параметры вегетативной регуляции и прогноз заболевания. Поэтому был проведен анализ ВРС в зависимости от локализации очага инсульта.
С целью изучения влияния локализации очага инсульта на биоэлектрическую активность сердца больные ОГ с инсультом средней тяжести были разделены на 3 подгруппы: с правосторонней локализацией в каротидной системе – 34 (42,50 %), левосторонней – 36 (45 %) и в вертебрально-базилярной системе – 10 (12,5 %). Пациенты указанных подгрупп были примерно сопоставимы по полу, возрасту, давности и тяжести АГ, сопутствующей патологии, тяжести метаболических нарушений и принимаемым препаратам.
В табл. 1.1.2.3 представлены показатели ВРС и ЦИ в зависимости от локализации очага инсульта. Средняя ЧСС при различной локализации очага была примерно одинакова. Временные показатели ВРС существенно не различались, однако при правосторонней и вертебрально-базилярной локализации очага инсульта отмечалась тенденция к снижению показателей, отражаюших общую ВРС таких, как SDNN (до 107,38 ± 5,68 и 103,50 ± 6,76 мс соответственно против 118,47 ± 6,29 мс при левосторонней локализации) и SDNNi (до 46,91 ± 2,91 и 45,75 ± 3,51 мс соответственно против 51,92 ± 3,05 мс).
Таблица 1.1.2.3
Вариабельность ритма сердца в зависимости от локализации очага инсульта (n = 80) (М ± m; n, %)
|
Показатели |
Каротидная система |
Вертебрально-базилярная система (n = 10) |
|
|
Справа (n = 34) |
Слева (n = 36) |
||
|
ЧСС за сутки |
69,53 ± 1,77 |
68,87 ± 1,83 |
67,00 ± 1,53 |
|
SDNN, мс |
107,38 ± 5,68 |
118,47 ± 6,29 |
103,50 ± 6,76 |
|
SDNNi, мс |
46,91 ± 2,91 |
51,92 ± 3,05 |
45,75 ± 3,51 |
|
rMSSD, мс |
27,09 ± 2,01 |
27,00 ± 2,07 |
30,33 ± 5,33 |
|
pNN50, ٪ |
5,74 ± 1,14 |
6,82 ± 1,25 |
7,17 ± 2,75 |
|
ЦИ |
1,12 ± 0,01 |
1,12 ± 0,01 |
1,09 ± 0,02 |
|
Интегральная оценка ВРС (n, ٪) |
|||
|
Нормальная |
11 (32,35 ٪) |
14 (38,89 ٪) |
5 (50 ٪) |
|
Умеренно снижена |
10 (29,41 ٪) |
5 (14,70 ٪) |
1 (10 ٪) |
|
Резко снижена |
13 (38,24 ٪) |
17 (47,22 ٪) |
4 (40 ٪) |
|
Синусовая аритмия |
9 (26,47 ٪) |
8 (22,22 ٪) |
2 (20 ٪) |
ЦИ у больных с вертебрально-базилярной локализацией очага был самым низким и составил 1,09 ± 0,02, тогда как при левосторонней и правосторонней – незначительно выше – 1,12 ± 0,01.
При оценке ВРС по интегральному заключению, оказалось, что количество больных с нормальной ВРС было незначительно ниже при правосторонней локализации – 11 (32,35 %) в сравнении с левосторонней и вертебрально-базилярной локализацией – 14 (38,89 %) и 5 (50 %) соответственно. Выявляемость выраженной синусовой аритмии была примерно одинакова.
По данным литературы [36, 114] низкие показатели ВРС выявляются при правосторонней локализации церебрального поражения,
и в вертебрально-базилярной системе, особенно при поражении правого островка (островка Рейля) [265].
Наши данные не подтверждают данные литературы, вероятно, вследствие недостаточного количества больных с тяжелым инсультом в проведенном исследовании, при котором нарушения ВРС более выраженные.
Таким образом, в острейшем периоде ИИ при легком течении инсульта ВРС и ЦИ существенно не снижаются, при среднетяжелом и тяжелом – снижение ВРС и ЦИ, уменьшение распространенности синусовой аритмии нарастают с увеличением тяжести инсульта. Существенного влияния локализации очага инсульта на ВРС и ЦИ не выявлено, отмечена лишь тенденция к снижению ВРС при правосторонней локализации и снижению ЦИ – при вертебрально-базилярной локализации, что не позволяет однозначно высказаться о влиянии локализации очага инсульта на ВРС.
1.1.3. Корреляционный анализ
При корреляционном анализе выявлена статистически значимая связь показателей ВРС с тяжестью инсульта, возрастом, уровнями глюкозы и калия крови, ИМТ и ОТ (табл. 1.1.3).
Таблица 1.1.3
Коэффициенты корреляции показателей ВРС с тяжестью инсульта, возрастом, глюкозой крови, ИМТ, ОТ и уровнем калия сыворотки крови (r) (n = 108)
|
Показатели |
SDNN |
SDNNi |
rMSSD |
pNN50 |
ВРС по интегральной оценке |
|
Тяжесть инсульта |
–0,203 P < 0,05 |
–0,184 |
–0,099 |
–0,118 |
0,189 Р < 0,05 |
|
Возраст |
–0,184 |
–0,231 P < 0,02 |
0,141 |
0,105 |
0,285 Р < 0,005 |
|
Глюкоза крови |
–0,388 P < 0,001 |
–0,415 P < 0,001 |
–0,280 P < 0,005 |
–0,239 P < 0,02 |
0,271 Р < 0,005 |
|
ИМТ |
–0,313 P < 0,002 |
–0,167 |
0,237 |
0,051 |
–0,009 |
|
ОТ |
–0,395 P < 0,001 |
–0,372 P < 0,001 |
–0,133 |
–0,162 |
0,251 Р < 0,05 |
|
Калий (n = 40) |
0,274 |
0,400 Р < 0,05 |
0,310 Р < 0,05 |
0,294 |
–0,377 Р < 0,02 |
SDNN отрицательно и слабо коррелировал с тяжестью инсульта (r = –0,203; P < 0,05), умеренно – с уровнем глюкозы крови (r = –0,388; P < 0,001), ИМТ (r = –0,313; P < 0,002) и ОТ (r = –0,395; P < 0,001).
SDNNi отрицательно и слабо коррелировал с возрастом (r = –0,231; P < 0,02), умеренно – с уровнем глюкозы крови (r = –0,415; Р < 0,001), ОТ (r = –0,372; P < 0,001), положительно и умеренно – с уровнем калия сыворотки крови (r = 0,400; P < 0,05).
rMSSD слабо коррелировал с уровнем глюкозы (r = –0,280; P < 0,005), положительно и умеренно – с уровнем калия (r = 0,310; P < 0,05), pNN50 отрицательно и слабо – с уровнем глюкозы (r = –0,239; P < 0,02).
Тяжесть снижения ВРС по интегральной оценке методом анализа «коротких участков» коррелировала положительно с тяжестью инсульта (r = 0,189; P < 0,05), возрастом (r = 0,285; P < 0,005), уровнем глюкозы крови (r = 0,271; P < 0,005), ОТ (r = 0,251; Р < 0,05) и отрицательно и умеренно с уровнем калия сыворотки крови (r = –0,377; P < 0,02).
Обращает внимание, что все показатели ВРС коррелировали с уровнем глюкозы. В проведенном исследовании 25 (23,2 %) больных с инсультом имели сопутствующий СД 2 типа. Вероятно, эта связь опосредована через катехоламины, выброс которых увеличивается при стрессе в первые сутки инсульта, которые увеличивают уровень глюкозы крови, ЧСС и снижают ВРС. Не исключается и наличие у больных дибетической кардиальной нейропатии, приводящей к снижению автономной регуляции (снижению вагусных и относительному преобладанию симпатических влияний на сердце).
Прямая взаимосвязь уровня глюкозы крови и ОТ (r = 0,472; P < 0,001) была более высокой, чем взаимосвязь уровня глюкозы и ИМТ (r = 0,224; P < 0,05), что подтверждает данные литературы о большем значении висцерального жирового депо в развитии толерантности тканей к глюкозе в сравнении с подкожным жировым депо.
Достоверной связи показателей ВРС с липидами плазмы крови не было, вероятно, вследствие того, что острый период инсульта, являясь стрессом, может приводить к снижению липидов.
Изложенное показывает, что наряду с тяжестью инсульта дополнительными факторами риска снижения ВРС являются возраст, метаболические нарушения такие, как гипергликемия и абдоминальное ожирение, а также снижение уровня калия сыворотки крови.
1.1.4. Динамика вариабельности ритма сердца
Через 10 дней лечения тяжесть снижения ВРС увеличилась, как по данным временных показателей, так и по интегральному заключению.
Среднесуточная ЧСС существенно не изменялась. Достоверно снижались: SDNNi – на 9,62 % (Р < 0,001), свидетельствующий об ослаблении регулирующего влияния ВНС на синусовый узел, rMSSD – на 10,96 % (P < 0,02), свидетельствующий об уменьшении вагусных влияний на сердце (рис. 1.1.4.1). Показатель, отражающий степень преобладания вагуса (pNN50), имел отчетливую тенденцию к снижению
на 21,13 % (Р < 0,1).
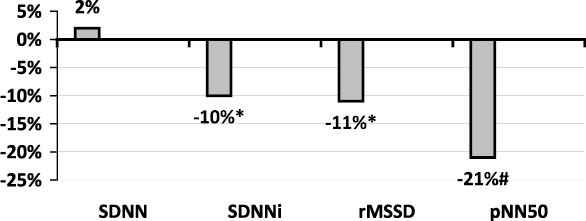
Рис. 1.1.4.1. Динамика временных показателей ВРС (∆, %)
Примечание. Достоверность динамики показателя: * – P < 0,05; # – P < 0,1.
Динамика ВРС по интегральной оценке была сходна с таковой по временным показателям ВРС. Отмечалась достоверная отрицательная динамика: количество больных с нормальной ВРС уменьшилось на 16,30 % (P < 0,02), а количество больных с умеренно сниженной и резко сниженной ВРС увеличилось соответственно на 10,87 и 5,43 % (рис. 1.1.4.2).
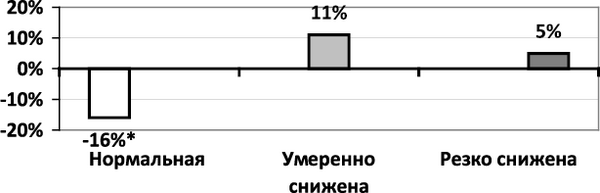
Рис. 1.1.4.2. Динамика ВРС по интегральной оценке (∆, %)
Примечание. * Достоверность динамики показателя (P < 0,02).
Несмотря на снижение показателей ВРС, ЦИ имел положительную динамику (рис. 1.1.4.3), увеличился на 1,79 % (Р < 0,01) (с 1,12 ± 0,01 до 1,14 ± 0,01), оставаясь при этом существенно ниже чем в ГК (1,14 ± 0,01 против 1,18 ± 0,01) (Р = 0,005), что свидетельствует о начинающем
восстановлении адаптации организма к циклу дневной активности
через 10 дней лечения

Рис. 1.1.4.3. Динамика ЦИ (∆, %)
Примечание. Достоверность различий: * – в сравнении с показателем ОГ (2-е сутки) (P < 0,01), # – в сравнении с показателем ОГ (12-е сутки) (P < 0,005)
По данным литературы нарушения ВРС могут сохраняться по окончании острого периода инсульта [138, 193].
Можно предположить, что отрицательная динамика ВРС обусловлена увеличением патологического влияния очага инсульта на синусовый узел или снижение ВРС имеет отсроченный характер. Вероятно, показатели ВРС в острейшем периоде инсульта у больных с сохраненными адаптационными возможностями (у больных с нетяжелым инсультом) существенно не меняются за счет повышения напряженности механизмов адаптации регуляторных систем, а через 10 дней происходит истощение механизмов адаптации, что и приводит к снижению ВРС, то есть снижение ВРС у этих больных имеет отсроченный характер, а проводимая терапия не в силах предотвратить отрицательную динамику. У больных же, с тяжелым инсультом или больных с исходно низкими адаптационными возможностями (больных старшего возраста, с СД) механизмы адаптации истощаются раньше (еще в острейшем периоде инсульта) и на фоне проводимой 10-дневной терапии сниженная ВРС сохраняется.
Для подтверждения данного предположения была проанализирована динамика ВРС и ЦИ в зависимости от тяжести инсульта (рис. 1.1.4.4).
Наибольшая отрицательная динамика временных показателей ВРС была при легком инсульте. Достоверно изменялись следующие показатели: снижались SDNNi и rMSDD на 19,57 (Р = 0,031) и 30,89 % (Р = 0,042) соответственно, прослеживалась отчетливая тенденция к снижению pNN50 – на 64,45 % (Р = 0,054). Увеличивалась среднесуточная ЧСС на 14,37 % (с 65,67 ± 2,35 до 75,11 ± 3,73 в мин) (Р = 0,034), что, вероятно, связано с активацией симпатико-адреналовой системы.
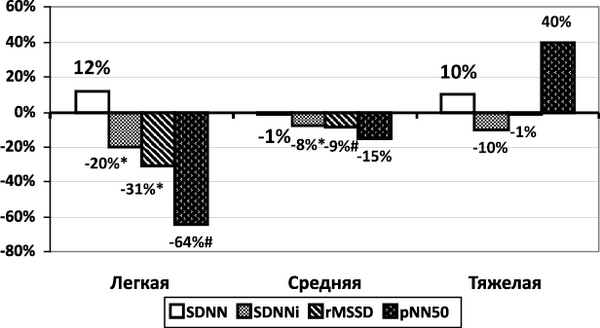
Рис. 1.1.4.4. Динамика временных показателей ВРС в зависимости от тяжести инсульта (∆, %)
Примечание. Достоверность динамики показателя: * – P < 0,05; # – P < 0,1.
При инсульте средней тяжести отрицательная динамика была менее выраженной, чем при легком. SDNNi снижался на 8,24 % (Р = 0,001), отмечалась отчетливая тенденция к снижению rMSDD на 8,84 % (Р = 0,064). pNN50 снижался на 14,86 %, однако разница была статистически незначимой. Среднесуточная ЧСС увеличилась незначительно – на 1,36 % (с 69,27 ± 1,09 до 70,21 ± 1,22 в мин).
При тяжелом инсульте достоверно динамики временных показателей ВРС не было, что свидетельствует о стойкости нарушений ВРС у этой категории больных.
Отрицательная динамика ВРС по временным показателям совпадала с таковой по интегральной оценке: при легком инсульте количество больных с нормальной ВРС уменьшилось на 33 % (c 44,44 до 11,11 %) (P < 0,05), а больных с умеренно сниженной и резко сниженной ВРС – увеличилось соответственно на 11,11 и 22,22 % (рис. 1.1.4.5).
При инсульте средней тяжести отрицательная динамика была менее выраженной, чем при легком. Отмечалось достоверное уменьшение больных с нормальной ВРС на 16,46 % (Р < 0,05), а количество больных с умеренно сниженной и резко сниженной ВРС увеличивалось соответственно на 12,66 и 3,80 %. При тяжелом инсульте динамики ВРС не выявлено.
Через 10 дней сохранялось различие показателей ВРС пациентов в зависимости от тяжести инсульта, хотя и менее значимое: количество больных с резко сниженной ВРС составило 33,33 % при легком течении, 45,57 % – при средней тяжести и 75 % – при тяжелом.
Параллельно снижению ВРС при легком и среднетяжелом инсульте прослеживалась тенденция к уменьшению выявляемости эпизодов синусовой аритмии в динамике соответственно на 92,4 (Р = 0,181) и 66,83 % (Р = 0,085), что может подтверждать нарастающее снижение адаптации организма к 10–12-му дню острого периода инсульта. При тяжелом инсульте эпизоды синусовой аритмии не регистрировались ни в острейшем периоде, ни в динамике через 10 дней лечения, что подтверждает стойкость сниженной ВРС у этих больных.
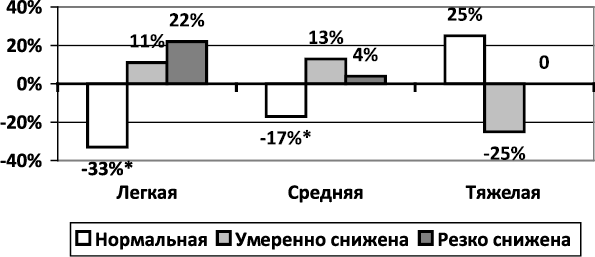
Рис. 1.1.4.5. Динамика ВРС по интегральной оценке
в зависимости от тяжести инсульта (∆, %)
Примечание. Достоверность динамики показателя: * – P < 0,05.
ЦИ достоверно улучшался при любой тяжести инсульта, что свидетельствует о повышении механизмов адаптации организма к циклу дневной активности, несколько лучше – при легком инсульте (рис. 1.1.4.6). Динамика от исходного значения составила 5,31; 1,80 и 2,65 % (Р < 0,05) соответственно нарастанию тяжести инсульта.
Следует отметить, что при легком инсульте ЦИ восстановился до такового показателя ГК, а при средней тяжести и тяжелом оставался
ниже, чем в ГК.
Таким образом, анализ динамики ВРС показал, что при легком и среднетяжелом инсульте нарушения ВРС прогрессируют, а при тяжелом сохраняются и не коррегируются в течение 10 дней лечения. Адаптация организма к циклу дневной активности при легком инсульте восстанавливается, проявляющаяся увеличением ЦИ до такового в ГК, и начинает повышаться у больных инсультом средней тяжести и тяжелом.
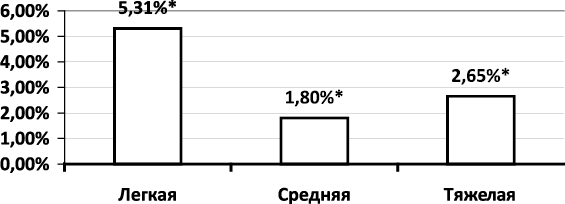
Рис. 1.1.4.6. Динамика ЦИ в зависимости от тяжести инсульта (∆, %)
Примечание. Достоверность динамики показателя: * – P < 0,05.
Проведенное исследование показывает, что в острейшем периоде ИИ снижаются ВРС и ЦИ ЧСС, уменьшается распространенность синусовой артмии, что свидетельствует о снижении механизмов адаптации организма и является неблагоприятным прогностическим фактором.
Тяжесть нарушений зависит от тяжести инсульта. При легком течении ВРС и ЦИ существенно не снижаются, при среднетяжелом и тяжелом – снижение ВРС и ЦИ, уменьшение распространенности синусовой аритмии нарастают с увеличением тяжести инсульта. Существенного влияния локализации очага инсульта на ВРС и ЦИ не выявлено, отмечена лишь тенденция к снижению ВРС при правосторонней локализации и снижению ЦИ – при вертебрально-базилярной локализации, что не позволяет однозначно высказаться о влиянии локализации очага инсульта на ВРС.
Наряду с тяжестью инсульта отмечены дополнительные факторы риска снижения ВРС: возраст, метаболические нарушения такие, как гипергликемия и абдоминальное ожирение, а также снижение уровня калия сыворотки крови.
Продемонстрировано, что в динамике нарушения ВРС прогрессируют при легком и среднетяжелом инсульте, сохраняются сниженными – при тяжелом и не коррегируются в течение 10 дней лечения. Отмечена положительная динамика ЦИ ЧСС. Адаптация организма к циклу дневной активности восстанавливается при легком инсульте, проявляющаяся увеличением ЦИ до такового в ГК, и начинает повышаться у больных инсультом средней тяжести и тяжелом.
Учитывая обратную связь степени отрицательной динамики ВРС с тяжестью инсульта, возможно, что снижение ВРС, как следствие цереброкардального синдрома, при легком и среднетяжелом инсульте имеют отсроченный характер и проявляются к 12-му дню болезни. Не исключается и негативное влияние на ВРС лекарственных препаратов.
