
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
4.1. Синергетика катализа модельной реакции переэтерификации оксидами металлов
Для исследования каталитических свойств наполнителя предварительно выполненная модельная реакция переэтерификации позволила определить каталитическую активность оксидов 14 металлов [1]. Как показали эти исследования, оцениваемая по величине константы скорости реакции первого порядка k1 каталитическая активность широко варьируется – от 0,004х10-4с-1 для ВеО до 8,91х10-4с-1 для СаО, т.е., более чем на три порядка. Для объяснения этого различия был рассмотрен ряд факторов: электронная конфигурация атомов металлов, растворимость оксидов в реакционной среде и т.д. [1]. Тем не менее, получить общего объяснения наблюдаемого эффекта не удалось. Поэтому авторы [2,3]предприняли попытку дать такое объяснение в рамках синергетики наночастиц [4].
Интервал размеров частиц используемых оксидов металлов (220÷700 нм) позволяет отнести их к классу наночастиц (по крайней мере, формально) и использовать для их описания законов синергетики наночастиц. Иванова [4] ввела меру структурной стабильности атома ?р и показала, что этот параметр находится в периодической зависимости от массы атома М, а порог адаптивности структуры атома Am с увеличением М отвечает условию [4]:
![]() ?рm, (4.1)
?рm, (4.1)
где ![]() и
и ![]() - пороговые массы атомов, в пределах которых сохраняется стабильная связь, ?р=f(M), m-показатель периодичности структуры при изменении М, равный m=1 для линейной и m=2 для нелинейной обратной связи.
- пороговые массы атомов, в пределах которых сохраняется стабильная связь, ?р=f(M), m-показатель периодичности структуры при изменении М, равный m=1 для линейной и m=2 для нелинейной обратной связи.
В табл. 4.1 приведены соотношения для расчета ?р как функции М для шести интервалов стабильной связи.
Таблица 4.1.
Формулы для расчета меры структурной стабильности ?р атомов металлов [4]
| Пороговый элемент и его предшественники | Вид стабильной связи между ?р и М |
| Са:1-20 | ?р=1,50х10-2 М |
| Kr:20-36 | ?р=0,55х10-2 М |
| La:36-57 | ?р=0,232+(М-84)х0,423х10-2 |
| Lu:57-71 | ?р=0,232+(М-139)х0,423х10-2 |
| Ac:71-89 | ?р=0,232+(М-175)х0,287х10-2 |
| Db:89-105 | ?р=0,232+(М-227)х0,287х10-2 |
Зависимость k1 от рассчитанных согласно уравнению (4.1) величин Am при условии линейной обратной связи (m=1) в логарифмических координатах приведена на рис.4.1. Как можно видеть, получена примерно линейная корреляция ln k1(Am), аналитически описываемая следующим образом [2]:
ln k1=-17+26,2Am. (4.2)
Таким образом, чем выше адаптивность структуры атома металла, входящего в состав оксида, характеризуемая величиной Am, тем выше его каталитическая активность, характеризуемая величиной k1. При минимальном значении ?р=0,232 (Am=0,232) согласно правилу золотой пропорции для рассматриваемых металлов [4] из уравнения (4.2) получим k1≈0,18х10-4с-1. т.е., величину k1 для реакции переэтерификации без нанонаполнителя [1]. Таким образом, при любом значении ?р<0,232 (Am <0,232 при m=1) реакция переэтерификации будет замедляться [3].
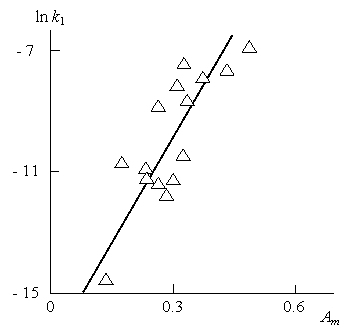
Рис.4.1. Зависимость константы скорости переэтерификации k1 от адаптивности наночастиц оксидов металлов Am в логарифмических координатах [2].
Следовательно, мера стабильности частиц оксидов металлов и их адаптивность находятся в периодической зависимости от массы атома металла. Чем выше адаптивность входящего в состав оксида атома металла, характеризуемая величиной Ам, тем выше его каталитическая активность, характеризуемая константой скорости первого порядка k1 . Эта зависимость является общей для оксидов металлов II – VIIгрупп периодической системы [3].
Структурный анализ показал [5], что фрактальная размерность Df продукта реакции переэтерификации (гептилбензоата) изменяется в случае присутствия указанных оксидов металлов от 1,52 до 2,29. Поэтому авторы [5] исследовали факторы, контролирующие изменение структуры молекулы гептилбензоата и, следовательно, скорости реакции переэтерификации. Расчет фрактальной размерности Df фракталоподобной молекулы гептилбензоата был выполнен с помощью уравнения (2.9).
Как отмечалось выше, уменьшение скорости реакции, характеризуемой величиной k1, обусловлено повышением размерности Df в интервале 1,52÷2,29. Такое изменение Df носит не только количественный, но и качественный характер. Величина Df зависит от механизма агрегации (синтеза) и указанное выше изменение этой размерности означает переход от диффузионно-ограниченной к химически лимитированной агрегации [6]. Было отмечено увеличение Df по мере роста электроотрицательности металлов, входящих в состав оксидов [1]. Как известно [7], относительная электроотрицательность подчиняется общему закону: в периоде она растет с увеличением номера элемента, а в группе периодической системы –уменьшается. Ее значения служат мерой неметалличности элементов. Очевидно, чем больше относительная электроотрицательность, тем сильнее элемент проявляет неметаллические свойства [7].

Рис.4.2. Зависимость фрактальной размерности Df молекулы гептилбензоата от величины отношенияNпер/Nгр для оксидов металлов. Горизонтальная штриховая линия показывает максимальную величину Dfфракталоподобной молекулы [5].
Используя указанные общие тенденции, можно построить зависимость Df от наиболее общего показателя относительной электроотрицательности – отношения номера периода Nпер к номеру группы Nгр.Такая зависимость показана на рис. 4.2. Как можно видеть, получена достаточно хорошая линейная корреляция, демонстрирующая увеличение Df по мере роста отношения Nпер/Nгр, т.е., увеличения степени электроотрицательности элемента, входящего в состав оксида. На рис. 4.2 также показана горизонтальной штриховой линией максимальная величина Df фракталоподобных молекул, равная 2,28 [8]. Эта величина Dfхорошо согласуется с фрактальной размерностью молекулы гептилбензоата, полученной в процессе реакции переэтерификации в присутствии ВеО. Отметим, что полученная в рамках синергетического подхода мера структурной стабильности атома ?р (уравнение (4.1)) также является функцией относительной электроотрицательности, выраженной отношением Nпер/Nгр (рис.4.3). Как можно видеть, значение ?р снижается по мере увеличения относительной электроотрицательности от максимальной величины ?р = 0,618 и при Nпер/Nгр≈1,25 достигает асимптотического минимального значения ?р = 0,232 [4]. Последняя величина означает минимальную адаптивность оксида, т.е., его минимальную каталитическую активность, что и приводит к величинам k1=0,004÷0,13х10-4с-1 (напомним, что в случае присутствия СаО k1=8,91х10-4с-1 [1]).
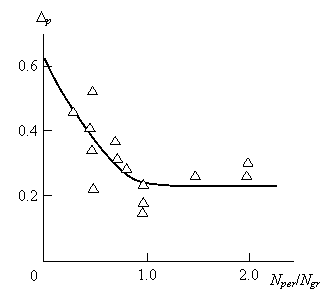
Рис.4.3. Зависимость меры структурной стабильности ?р от величины отношения Nпер/Nгр для оксидов металлов [5].
В свою очередь, как показано в работе [9], снижение ?р приводит к уменьшению растворимости оксида металла смет в метилбензоате. Эта зависимость аналитически выражается следующим образом [9]:
![]() ?р, (4.3)
?р, (4.3)
где смет выражена в мольных %.
Рассмотрим синергетику растворимости оксидов металлов несколько подробнее. Для оценки степени растворимости соединения металлов их прогревали с метилбензоатом или гептанолом-1 при тех же температурных и временных условиях, что и в кинетических условиях. После прогревания жидкость отфильтровывали от не растворившегося оксида и в фильтрате определяли содержание металла рентгенофлуоресцентным методом. Было показано [1], что при 443К в метилбензоате растворяются только те оксиды, которые являются лучшими катализаторами, а в гептаноле -1 все исследуемые соединения металлов практически не растворялись. Поэтому на рис. 4.4 приведена зависимость содержания металла (в моль. % от реагента – метилбензоата) смет как функция Аm для шести исследованных оксидов. Как следует из приведенного графика величина ![]() (квадратичная форма зависимости выбрана для ее линеаризации) является возрастающей функцией Аm, как и k1 (см. рис.4.1). Аналитически соотношение между смет и Аmдается следующим эмпирическим уравнением [9]:
(квадратичная форма зависимости выбрана для ее линеаризации) является возрастающей функцией Аm, как и k1 (см. рис.4.1). Аналитически соотношение между смет и Аmдается следующим эмпирическим уравнением [9]:
![]() , (4.4)
, (4.4)
где смет снова дается в моль. % от реагента.

Рис.4.4. Зависимость содержания металла смет в метилбензоате от его адаптивности Аm [9].
Таким образом, повышение степени адаптивности металла Аm приводит к росту его растворимости в метилбензоате. Это оказывает определенное влияние на величину k1 реакции переэтерификации. Однако следует заметить, что это влияние не является определяющим, поскольку увеличение смет по мере повышения Аm происходит медленнее, чем рост функцииk1(Аm) (см. уравнение (4.2)). Так, увеличение Аm от 0,3 до 0,5 приводит к росту k1 примерно в 190 раз, тогда как повышение смет составляет только ~11 раз. При минимальной (согласно правилу золотой пропорции [4]) величине Аm=0,213 смет=0, т.е., металл в реакционной среде не растворяется [9].
Далее авторы [5] выполнили теоретический расчет фрактальной размерности ![]() , используя предложенную в работе [10] методику. В указанной работе выполнен анализ агрегации коллоидных частиц золота и показано, что увеличение концентрации добавляемого пиридина приводит к снижению Df и изменению механизма агрегации от химически лимитированного к диффузионно-ограниченному. Для объяснения этого эффекта была рассмотрена природа энергии взаимодействия ближнего порядка. Статистическая вероятность (стерический фактор) ρ слипания двух частиц (в нашем случае-реакции молекул метилбензоата и гептанола -1) определяется следующим образом [10]:
, используя предложенную в работе [10] методику. В указанной работе выполнен анализ агрегации коллоидных частиц золота и показано, что увеличение концентрации добавляемого пиридина приводит к снижению Df и изменению механизма агрегации от химически лимитированного к диффузионно-ограниченному. Для объяснения этого эффекта была рассмотрена природа энергии взаимодействия ближнего порядка. Статистическая вероятность (стерический фактор) ρ слипания двух частиц (в нашем случае-реакции молекул метилбензоата и гептанола -1) определяется следующим образом [10]:
![]() , (4.5)
, (4.5)
где ЕВ- энергетический барьер отталкивания кулоновского происхождения, R-универсальная газовая постоянная, Т-температура реакции (Т=443К).
Энергия связей, образуемых при реакции >>RT, поскольку образование молекул гептилбензоата необратимо. Растворяемые в метилбензоате ионы металла снижают величину ЕВ и поэтому непосредственно влияют на значение ρ. Следовательно, величину ЕВ можно рассматривать как отношение [5]:
![]() , (4.6)
, (4.6)
где I-энергия ионизации атома металла, Е-энергия сродства к электрону.
Сумма энергий (I+Е) была рассчитана согласно методике, цитированной в работе [7]. В качестве эталонной величины принималась суммарная энергия (I+E) для лития, равная 5,61 Эв, имеющего относительную электроотрицательность ХLi≈1,0. Далее согласно литературным данным [7] можно получить величину Х для произвольного металла и рассчитать для него значение (I+Е ) как произведение 5,61Х в Эв [7]. Затем согласно уравнению (4.5) рассчитывалась величина ρ[5]. Характерно, что при переходе от СаО к ВеО наблюдается снижение ρ от 0,857 до 0,057, т.е., как отмечалось выше, реализуется переход от диффузионно-ограниченного механизма агрегации (синтеза) к химически лимитированному [11]. И, наконец, теперь можно рассчитать теоретическое значение фрактальной размерности ![]() молекулы гептилбензоата, используя уравнение (2.41).
молекулы гептилбензоата, используя уравнение (2.41).
На рис. 4.5. приведено сравнение величин Df и ![]() , рассчитанных согласно уравнениям (2.9) и (2.41), соответственно. Как можно видеть, между этими размерностями получено хорошее соответствие (среднее расхождение Df и
, рассчитанных согласно уравнениям (2.9) и (2.41), соответственно. Как можно видеть, между этими размерностями получено хорошее соответствие (среднее расхождение Df и ![]() составляет 6%), подтверждающее предложенную выше трактовку каталитической активности оксидов металлов.
составляет 6%), подтверждающее предложенную выше трактовку каталитической активности оксидов металлов.

Рис.4.5. Сравнение рассчитанных согласно уравнениям (2.9) Df и ![]() (2.41) величин фрактальной размерности молекулы гептилбензоата [5].
(2.41) величин фрактальной размерности молекулы гептилбензоата [5].
Следовательно, рассмотренные выше результаты показали, что каталитическая активность наночастиц оксидов металлов определяется их относительной электроотрицательностью. Чем выше этот параметр, тем выше растворимость металла в метилбензоате. Это приводит к повышению энергетического барьера отталкивания молекул метилбензоата и гептанола-1, что уменьшает стерический фактор и приводит к росту фрактальной размерности молекулы гептилбензоата. Последний фактор резко замедляет реакцию переэтерификации.
Важно отметить, что синергетический эффект оксидов металлов сохраняется и при формировании высокомолекулярных макромолекул в реакции полипереэтерификации. При исследовании синтеза полибутилентерифтолата (ПБТ) реакцией полипереэтерификации в присутствии шести оксидов металлов (СаО, РbО, ВаО, ZnО, СоО и MgO) было обнаружено существенное увеличение характеристической вязкости [η] по сравнению с реакцией без наночастиц [1]. Так, последняя реакция дает ПБТ с [η]=0,06 дл/г, тогда как присутствие 10 мас. % оксидов металлов позволяет получать величины [η] в интервале 0,15¸0,68 дл/г. Таким образом, в случае использования в качестве нанонаполнителей оксидов металлов можно получить более высокомолекулярные полимеры. Авторы [1] предположили, что одной из причин этого эффекта может быть нарастание по мере протекания реакции переэтерификации вязкости системы и перехода реакции из кинетической в диффузионную область, где преобладающим фактором становится не активность катализатора, а подвижность его активных центров. Однако по поводу такого объяснения следует отметить, что в силу одинакового содержания оксидов в реакционной среде ее вязкость должна быть выше, чем в их отсутствие (см. уравнение (3.11)), но примерно одинаковой для указанных оксидов, тогда как величина [η] для них различается примерно в пять раз. Авторы [12] предложили объяснение наблюдаемого эффекта в рамках синергетики наночастиц [4].
Как показано выше, чем больше адаптивность структуры атома металла, входящего в состав оксида, характеризуемая величиной Аv, тем выше его каталитическая активность, характеризуемая величиной k1. Отметим, что в работе [1] было получено увеличение [η] по мере роста k1. Поэтому на рис. 4.6 приведена корреляция между характеристической вязкостью [η] для ПБТ и величиной Аm в случае использования шести оксидов металлов, указанных выше. Как можно видеть, получена примерно линейная корреляция, демонстрирующая рост [η] по мере увеличения Аm. Эту корреляцию аналитически можно описать следующим эмпирическим уравнением [12]:
[η] =2,03 (Аm-0,213), (4.7)
где [η] дается в дл/г.

Рис.4.6. Зависимость характеристической вязкости [η] от меры адаптивности Аm оксидов металлов для реакции полипереэтерификации (ПБТ) [12].
Характерно, что экстраполяция зависимости [η](Аm) к [η]=0 дает величину Аm=0,213, т.е., минимально возможную меру адаптивности металла согласно правилу золотой пропорции [4]. Уравнение (4.7) также позволяет оценить максимально достижимое в процессе реакции полипереэтерификации значение [η] для ПБТ: при Аm≈1,0 эта величина [η] примерно равна 1,6 дл/г. Однако, максимальная реальная величина Аm при m=1 составляет 0,618 [4] и соответствующая ей величина [η]= 0,822 дл/г, что близко к полученной в присутствии СаО величине [η]= 0,68 дл/г. Отметим, что нелинейная обратная связь, т.е., m=2, позволяет увеличить [η]: так, в этом случае для СаО получим Аm= 0,718 и [η]=1,025 дл/г. Таким образом, предложенная трактовка позволяет прогнозировать величину [η] для реакции полипереэтерификации ПБТ.
