
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
Молекулярно-генетические и молекулярно-цитогенетические исследования синдрома умственной отсталости, сцепленной с ломкой хромосомой Х
Поскольку фенотипические проявления синдрома FRAXA не являются высокоспецифичными, то для диагностики заболевания используются различные лабораторные методы: цитогенетические, молекулярно-цитогенетические, биохимические и молекулярно-генетические методы.
Цитогенетический метод основан на выявлении ломкости хромосомы Х в лимфоцитах периферической крови больных после культивирования в условиях недостатка фолиевой кислоты. Метод позволяет выявить полную мутацию, однако непригоден для выявления премутации. Кроме того, велика вероятность ложного отрицательного результата, если пациент принимает препараты, содержащие фолиевую кислоту. Метод занимает значительное время у исследователя. При молекулярно-цитогенетическом исследовании с целью увеличения эффективности выявления ломких хромосом Х для их маркирования в кариотипе предлагалось осуществлять мечение при помощи флюоресцентной гибридизации in situ (FISH) с применением околоцентромерного ДНК зонда для хромосомы Х [Соловьев и др., 1995; Soloviev et al., 1994, 1997; Юров и др., 2005 а]. В силу своей трудоемкости и малой эффективности эти методы в настоящее время используются редко. Биохимический метод выявления белка FMRP используется в единичных лабораториях для оценки его экспрессии [Kumari et al., 2015]. Использование метода целесообразно для определения экспрессии FMRP у больных с необычной клинической картиной.
Молекулярно-генетическое тестирование гена FMR1 осуществляется с использованием полимеразной цепной реакции, блот-гибридизации по методу Саузерна, анализа метилирования или секвенирования. Метод Саузерна состоит в проведении гибридизации разделенных электрофорезом фрагментов ДНК, содержащих ген FMR1, с радиоактивными зондами, специфически связывающимися с участком, содержащим
увеличенное число CGG-повторов. Метод пригоден для определения полной мутации и премутации с большим числом CGG-повторов, но случаи премутации с небольшим числом тринуклеотидных повторов не могут быть выявлены. Данный метод используется редко, поскольку он трудоемкий и требует большого количества ДНК для анализа, а также небезопасен для исследователя. Полимеразная цепная реакция является чувствительной для определения числа триплетных повторов, но эффективна только для выявления нормального числа повторов или премутации. Выявить с помощью неё полную мутацию сложно из-за проблем амплификации участка с большим количеством CGG-повторов. В этих случаях полимеразную цепную реакцию комбинируют с блот-гибридизацией по Саузерну. Комбинация этих двух методов позволяет выявлять экспансию тринуклеотидных повторов в гене FMR1 в 99 % случаев. Такой диагностический подход к идентификации используют для носителей полной мутации и премутации. Для 1 % детей, имеющих делеции и точковые мутации в кодирующей области гена FMR1, необходимо секвенирование [Garber et al., 2008].
В наших исследованиях число CGG-повторов в гене FMR1 определялось у 114 детей, отобранных из группы больных с недифференцированной умственной отсталостью при использовании шкалы количественной оценки клинических признаков синдрома FRAXA. Анализ числа тринуклеотидных повторов осуществлялся методом ПЦР с последующим капиллярным электрофорезом. Экспансия тринуклеотидных повторов была обнаружена у 46 (40 %) из 114 обследованных мальчиков, что превышает (в более чем 10 раз) частоту подтверждения диагноза при использовании наших клинических шкал по сравнению с различными, в том числе и зарубежными генетическими центрами. Так, согласно данным других исследователей, диагноз синдрома FRAXA у детей, направляемых на молекулярно-генетическое обследование, подтверждается только в 2–3,8 % случаев [Stevenson, Schwartz, 2009]. Это можно объяснить малой специфичностью симптомов синдрома FRAXA и отсутствием в клинической практике адекватной системы оценки фенотипа, помогающей сделать его клиническую диагностику более эффективной. Полученные нами данные указывают на эффективность отбора больных с помощью разработанной количественной клинической шкалы. На рис. 22 представлен анализ числа CGG- повторов в промоторе гена FMR1 у мальчика с синдромом FRAXA.
Следует отметить, что при капиллярном электрофорезе в полиакриламидном геле сложно определить фрагмент ДНК, если количество триплетных повторов значительно больше 235. В таких случаях используется электрофорез в агарозном геле, при котором этот фрагмент можно идентифицировать, однако, с меньшей точностью определения количества CGG-повторов (рис. 23).
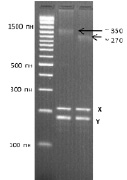
Рис. 23. Анализ результатов исследования числа тринуклеотидных повторов в промоторе гена FMR1 методом ПЦР с последующим электрофорезом в агарозном геле. У пробандов определена полная мутация гена с количеством
CGG-повторов ~ 350 и ~ 270
В случае, если фрагмент ДНК, соответствующий CGG-повторам в гене FMR1, не определялся из-за большого их числа при электрофорезе ни в агарозном, ни в полиакриламидном геле, то для подтверждения диагноза дополнительно проводилось молекулярно-цитогенетическое исследование ломкости хромосомы Х с помощью метода флюоресцентной гибридизации in situ (FISH) при использовании хромосомоспецифичной ДНК пробы, созданной в лаборатории цитогенетики и геномики Научного центра психического здоровья [Юров и др., 2000; 2001; Soloviev et al., 1995а,б; Yurov et al., 1996; 2002; 2010 а]. На рис. 24 представлены результаты молекулярно-цитогенетического исследования ломкости хромосомы Х у 2-х больных. Экспрессия ломкости участка fra(X)(q27.3) исследовалась у 12 детей с синдромом FRAXA (имеющих мутацию гена FMR1) и 12 детей контрольной группы с недифференцированной умственной отсталостью без мутации гена FMR1. Результаты представлены в табл. 17. Экспрессия ломкости выражалась в проценте клеток с ломкой хромосомой Х по отношению к общему количеству проанализированных метафаз. Показана эффективность молекулярно-цитогенетического метода диагностики, поскольку экспрессия ломкости участка fra(X)(q27.3) у детей с мутацией гена FMR1 составила в среднем 11,8 %, в то время как у больных без мутации была на порядок ниже – 1,3 %.
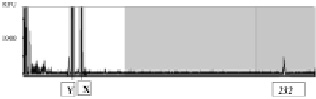
Рис. 22. Анализ количества тринуклеотидных повторов в промоторе гена FMR1 у ребенка с синдромом FRAXA. По оси абсцисс на электрофореграммах указана длина фрагментов ДНК (пн), по оси ординат – интенсивность флюоресцентного сигнала в относительных единицах флюоресценции – relevant fluorescent units (RFU). Фрагменты ДНК на электрофореграммах соответствуют хромосомам Y и X,
а также триплетным повторам в гене FMR1. Определено ~ 232 CGG-повтора (полная мутация гена FMR1)
Таким образом, сочетание молекулярно-генетического и молекулярно-цитогенетического методов являлось эффективным для диагностики синдрома FRAXA у детей (Вехова и др., 1992; Соловьев и др., 1995; Ворсанова и др., 1998 а; 2006). Большинство исследователей, применявших метод полимеразной цепной реакции для диагностики синдрома FRAXA, также комбинировали его с дополнительным методом, позволяющим подтвердить диагноз. В качестве дополнительного метода, как правило, использовали радиоактивную блот-гибридизацию по Саузерну [Tassone et al., 2008].
После того как у 46 мальчиков, среди которых было три пары сибсов, с помощью молекулярно-генетического и молекулярно-цитогенетического методов был подтверждён синдром FRAXA, возникла необходимость обследования их родственников.
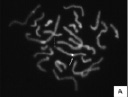

Рис. 24. Молекулярно-цитогенетическое выявление ломкости хромосомы Х с помощью метода FISH. ДНК проба pYAM 10–40 позволяла специфически маркировать хромосому Х (показана стрелками), что повышало эффективность исследования ломкого участка fra(X)(q27.3) (показан другими стрелками),
позволяя анализировать метафазы с неполным количеством хромосом (А) и хромосомы Х в наложении (Б)
Среди доступных для обследования родственников пациентов по материнской линии мутации и премутации гена FMR1 были выявлены у 43 из 51 индивидуума. У всех из 30 обследованных матерей была определена премутация гена FMR1. Обнаружены полные мутации гена FMR1 у 5 родных и 1 двоюродной сестры пробандов, у 1 тёти, 4 бабушек и 3 дедов по линии матери выявлены премутации. Восемь обследованных родственников пробандов (2 брата, 3 сестры, 2 деда и 1 бабушка) имели нормальное число повторов в гене FMR1.
Таблица 17
Экспрессия ломкости участка fra(X)(q27.3) у детей с мутацией гена FMR1 и детей с нормальным числом CGG-повторов
|
Дети с мутацией гена FMR1 |
Дети с нормальным числом повторов в гене FMR1 |
||
|
№ обследуемого |
Экспрессия ломкости участка fra(X)(q27.3) |
№ обследуемого |
Экспрессия ломкости участка fra(X)(q27.3) |
|
1 |
9 % |
1 |
1 % |
|
2 |
30 % |
2 |
1 % |
|
3 |
2 % |
3 |
2 % |
|
4 |
7 % |
4 |
0 % |
|
5 |
12 % |
5 |
1 % |
|
6 |
16 % |
6 |
2 % |
|
7 |
18 % |
7 |
0 % |
|
8 |
6 % |
8 |
2 % |
|
9 |
3 % |
9 |
2 % |
|
10 |
8 % |
10 |
0,8 % |
|
11 |
24 % |
11 |
2 % |
|
12 |
7 % |
12 |
1,5 % |
Наименьшим известным числом триплетных повторов у матери, которое могло привести к возникновению мутации у потомства за одно поколение, является 56 [Fernandez-Carvajal et al., 2009]. Наблюдавшееся нами наименьшее количество CGG-повторов у матери, которое привело к возникновению полной мутации у пробанда, равнялось 62. Необходимо подчеркнуть, что те родственники больных по материнской линии, у которых определена экспансия тринуклеотидных повторов в гене FMR1, имели высокий риск рождения детей с умственной отсталостью и высокую вероятность развития таких заболеваний, как синдромы тремора и атаксии и преждевременного нарушения функции яичников. Высокая эффективность выявления индивидуумов с мутацией и премутацией гена FMR1 в семьях больных мальчиков подтвердила мнение о необходимости проведения так называемого «каскадного скрининга» на мутации гена FMR1 среди родственников больных с синдромом FRAXA [Pembrey et al., 2001].
