
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
В.В. Максимов, Т.С. Николаева, А.А. Матеров, Э.Э. Мирзоев. ОПРЕДЕЛЕНИЕ СОСТАВА ОСАДКА,ВЫХОДА МЕДИ И РАЗМЕРА ЧАСТИЦ МЕДИ, ПОЛУЧЕННЫХ ГИДРОКАРБОНИЛЬНЫМ МЕТОДОМ
В.В. Максимов, Т.С. Николаева, А.А. Матеров, Э.Э. Мирзоев
ОПРЕДЕЛЕНИЕ СОСТАВА ОСАДКА,ВЫХОДА МЕДИ
И РАЗМЕРА ЧАСТИЦ МЕДИ, ПОЛУЧЕННЫХ ГИДРОКАРБОНИЛЬНЫМ МЕТОДОМ
Калужский филиал Московского государственного технического
университета им. Н.Э. Баумана, Калуга, Россия
E-mail: maksimov_w@mail.ru
Показано наличие смеси продуктов в осадке, а также определен выход чистой меди, полученных в результате процесса каталитического восстановления меди (II) – меди (I) из хлоридно-сульфатных растворов гидрокарбонильным способом и дальнейшим редоксораспадом продуктов по технологической схеме. Приведено исследование гранулометрического состава порошков меди лазерным анализатором частиц «Ласка-1К».
Одним из методов получения металлов в дисперсном состоянии является химическое восстановление их соединений при использовании в качестве восстановителя монооксида углерода. Реакция восстановления Cu (II) до Cu (I), при атмосферном давлении и комнатной температуре, под действием CO протекает лишь в присутствии катализаторов, в частности солей Pd (II) [6–9]:
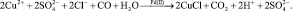 (1)
(1)
При t = 25 °C по реакции (1) нами был получен и выделен белый, перламутрового оттенка, пластинчатый осадок. По результатам дальнейшего исследования осадка, гравиметрически было определено содержание Cl– ионов избытком нитратом серебра в растворе азотной кислоты (табл. 1).
Таблица 1
Результаты определения ионов Cl– в карбонилхлориде меди (I)
|
№ п/п |
|
|
|
|
|
|
1 |
0,37 |
10 |
0,45 |
0,1113 |
0,00314 |
|
2 |
0,37 |
10 |
0,52 |
0,1286 |
0,0036 |
|
3 |
0,35 |
10 |
0,48 |
0,1167 |
0,00334 |
Далее вторая часть осадка была переведена в раствор по средством окисления ионов Cu+ до Cu2+ концентрированной азотной кислотой и дальнейшим йодометрическим титрованием (табл. 2).
Таблица2
Результаты определения ионов Cu2+ в карбонилхлориде меди (I)
|
№ п/п |
|
Vаликвоты, мл |
VHCl, мл |
VKI, мл |
|
|
|
|
1 |
0,37 |
10 |
2 |
10 |
33,3 |
0,21312 |
0,00333 |
|
2 |
0,35 |
7 |
2 |
10 |
19 |
0,1916 |
0,00299 |
|
3 |
0,13 |
10 |
2 |
10 |
11,3 |
0,14351 |
0,00224 |
После пересчета результатов аналитического исследования на одинаковое по массе количество взятого карбонилхлорида меди (I) была получена его брутто-формула (содержание CO считалось по разности массы осадка за вычетом массы ионов Cu+ и Cl–, где  ). По данным анализа получились мольные соотношения Cu:CO = 1:1, что вероятно указывает на смесь CuCOCl + 2CuCl (возможно CuCOCl + [CuCl2]–) или образование кластерного соединения состава Cux(CO)yClx, где y < x [2–5]:
). По данным анализа получились мольные соотношения Cu:CO = 1:1, что вероятно указывает на смесь CuCOCl + 2CuCl (возможно CuCOCl + [CuCl2]–) или образование кластерного соединения состава Cux(CO)yClx, где y < x [2–5]:
CuCl + [CuCl2]– + CO ? CuCOCl3,
что наглядно доказывает ИК-спектр (рис. 1).
На спектре (рис. 1) прослеживаются характеристические частоты карбонильных групп, координированных с атомами металла, при этом 2320 отвечает однокоординированной карбонильной группе, а 2360 – мостиковой. Это подтверждает образование кластеров Cu–CO–Cu, содержащих мостиковые CO группы.

Рис. 1. ИК спектр полученного осадка гидрокарбонильным способом
Полосы 1380, 1460, 1600 соответствуют валентным колебаниям связей Cu–Cl, а 2850, 2900, 2950 – обертонам колебаниям связей Cu–Cl. Интенсивный наплыв 3300–3600 соответствует колебаниям молекул кристаллизационной воды, что может соответствовать смеси продуктов CuCOCl?2H2O и CuCl (или [CuCl2]–) [3].
Анализ полученных экспериментальных результатов позволяет предположить, что при гидрокарбонильном каталитическом восстановлении CuII ? CuI происходит образование осадка, состоящего из смеси продуктов реакции – хлорида меди (I), карбонилхлорида меди CuCOCl?2H2O. При протекании реакции (1) образующаяся Cu (I) может находиться в разных формах в зависимости от концентрации хлорид – ионов и температуры [8–10].
Далее хлорид меди (I) подвергался гидролитическому разложению в щелочной среде. Переработка CuCl на Cu2O проходила при постоянном помешивании и температуре близкой к кипению – 70–90 °С:
2CuCl + 2OH– = Cu2O + H2O + 2Cl–.
При щелочном гидролизе хлорида меди (I) образовывался кристаллический осадок оксид меди (I) красно-коричневого цвета, который отфильтровывался и шел на дальнейшую переработку. Остаточное
содержание хлорид-ионов в оксиде меди (I) составило 0,085 % [7–9]. После чего полученный осадок оксида меди (I) растворялся в серной кислоте:
Cu2O + H2SO4 = Cu + CuSO4 + H2O. (2)
Процесс (2) протекает быстро и приводит к дополнительной очистке меди.
Выход меди по технологической схеме:
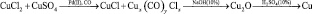
составил приблизительно 80 %. Можно отметить, что процесс является практически безотходным, т.к. оставшийся после гидрокарбонилирования раствор можно использовать повторно, тем самым свести потери меди и отходы к минимуму. Остаточное количество меди (II) можно удалить из раствора:
Cu2+ + Cu0 + 2Cl– = 2CuCl.
Анализ полученных результатов позволяет судить об экономической выгодности и экологической чистоте данного процесса (раствор CuSO4 может быть переработан повторным гидрокарбонилированием или электролизом с нерастворимым анодом, что на половину снизит расход электроэнергии на общую массу получаемой меди и повысит чистоту
катодной меди) [4]. Полученный порошок меди исследовался на лазерном анализаторе «Ласка-1К».

Рис. 2. Результаты гранулометрических показателей порошка меди
Результаты гранулометрического расчёта представлены на рис. 2, где по оси абсцисс зафиксированы диаметры частиц D в мкм, а по оси ординат – доля данных частиц Q в %, (интегральный гранулометрический состав).
При этом функция суммарного объемного распределения частиц по размерам выражается несколькими квантилями распределения – D10, D25, D50, D75, D90 с соответствующими им диаметрами. Полученный результат говорит о максимальном содержании частиц с определённым размером: D75 = 5,982 мкм – 75 % и D90 = 8,950 мкм – 90 %. Среднеквадратическое отклонение, 2,509 мкм [1].
Полученные результаты исследования позволяют предположить, что полученный гидрокарбонильным способом порошок меди по размеру частиц относятся к весьма тонким с размером частиц от 0,5–10 мкм и по количеству лимитирующих примесей соответствует марке М0 [8, 9]. Данные качества полученной меди, в перспективе, определяют широкий спектр ее применения в порошковой металлургии.
ЛИТЕРАТУРА
1. Максимов В.В., Николаева Т.С. Определение размера частиц порошков меди полученных гидрокарбонильным способом // Международная научно-практическая конференция «Фундаментальные и прикладные научные исследования», Уфа, 13 июня 2015 г. Изд.: Общество с ограниченной ответственностью «ОМЕГА САЙНС», С. 11-14.
2. Максимов В.В., Матеров А.А., Мирзоев Э.Э. Определение выхода меди полученной гидрокарбонильным способом // Наука XXI века: Теория, Практика и Перспективы. Изд-во: ООО «ОМЕГА САЙНС» (Уфа), 08. 04. 2015, С. 23-26.
3. Максимов В.В., Чаусов Ф.Ф. Определение состава осадка при каталитическом восстановлении Cu(II) ? Cu(I) гидрокарбонильным способом // Сб. тр. Sworld (Одесса), 2014, т. 32, № 3, С. 9-12.
4. Максимов В.В, Герасимова Н.С., Матеров А.А., Мирзоев Э.Э. Определение состава осадка и выхода меди, полученных гидрокарбонильным способом // Интеллектуальный потенциал XXI века: Ступени Познания. Изд-во: ООО «Центр развития научного сотрудничества» Новосибирск, 2014, № 24, С. 114-118.
5. Максимов В.В., Федосеев И.В. Использование гидрокарбонильного процесса в технологии получении // Наука и Современность Издво: ООО «Центр развития научного сотрудничества» (Новосибирск), 2011, № 14, С. 262-264.
6. Спицын В.И., Федосеев И.В., Пономарев А.А., Елесин А.И. Кинетика и механизм каталитического восстановления Cu(II) окисью углерода в присутствии хлорида Pd(II) // Журн. неорг. химии, 1978, т. XXIII, вып. 2, С. 454-456.
7. Федосеев И.В. Гидрокарбонильный процесс обезмеживания растворов // Цветные металлы, 2005, № 8, C. 22-25.
8. Федосеев И.В., Максимов В.В. Селективное выделение меди при гидрокарбонилировании сульфатно-хлоридных растворов цветных металлов // Цветные металлы, 2010, № 12, C. 39-40.
9. Федосеев И.В., Максимов В.В. Использование гидрокарбонильного процесса в совершенствовании технологии производства меди // Цветные металлы, 2012, № 9, C. 21-24.
10. Федосеев И.В., Максимов В.В., Логинова А.Ю. Механизм гидрокарбонильного процесса каталитического восстановления Cu(II) ? Cu(I). // Сборник научных трудов Sworld (Одесса), 2012, т. 32, № 3, C. 56-61.

 , г
, г , мл
, мл , г
, г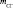 , г
, г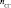 , моль
, моль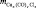 , г
, г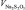 , мл
, мл , г
, г , моль
, моль