
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания
К.Т. Ткаченко, Е.Е. Гончаренко, И.И. Юрасова. ОСОБЕННОСТИ КАТАЛИТИЧЕСКОЕ РАЗЛОЖЕНИЕ ПЕРОКСИДА ВОДОРОДА С УЧАСТИЕМ БИХРОМАТА КАЛИЯ
К.Т. Ткаченко, Е.Е. Гончаренко, И.И. Юрасова
ОСОБЕННОСТИ КАТАЛИТИЧЕСКОЕ РАЗЛОЖЕНИЕ ПЕРОКСИДА ВОДОРОДА С УЧАСТИЕМ БИХРОМАТА КАЛИЯ
Московский государственный технический университет им. Н.Э. Баумана, Москва, Россия
E-mail:glotovaii@mail.ru
Получены данные по изменению рН в ходе разложения пероксида водорода с участием бихромата калия в кислотной среде. Полученная зависимость подчеркивает влияние характера среды на механизм процесса. Предложен наиболее простой из возможных механизмов, позволяющий с использованием методов формальной кинетики описать полученные кинетические кривые и определить фундаментальные константы данной системы.
Чистый раствор пероксида водорода может сохраняться неограниченное время в емкостях из инертного материала. При использовании сверхчистых растворов Н2О2 с массовыми долями 20, 40, 70 и 90 % скорость разложения пероксида не зависит от первоначальной концентрации последнего. Реакция разложения подчиняется точно нулевому порядку относительно концентрации пероксида и идет без индукционного периода [1]. Однако малейшие примеси, имеющиеся в воде, ведут к возникновению индукционного периода и изменению скорости разложения в широких пределах.
В общем виде процесс разложения Н2О2 является суммой трех различных процессов:
1) гетерогенное разложение Н2О2 на поверхности контакта твердой и жидкой фаз – стенках реактора;
2) гомогенное разложение в жидкой фазе; 3) гетерогенное разложение на границе контакта жидкой и газовой фаз, т.е. паров перекиси над поверхностью жидкости.
Из литературных источников известно, что на долю 1 и 3 процессов приходится примерно 0,005–0,001 % в час (при 50 °С) от общего количества разложившегося пероксида при использовании стекла из пирекса [2].
Последние исследования показали, что стабильность Н2О2 уменьшается при добавлении к нему как кислот, так и щелочей. При этом скорость разложения повышается тем сильнее, чем ниже концентрация последнего в исходном растворе. Минимум скорости разложения приходится на рН = 4,0–4,5 [1]. В гомогенной фазе катализаторами процесса разложения служат ионы металлов переменной валентности, хроматы, молибдаты, вольфраматы и ванадаты, а в гетерогенной –
преимущественно оксиды, гидроксиды, энзимы (в биологических системах). Радиохимическим анализом установлено, что выделяющийся при каталитическом разложении пероксида кислород входил первоначально в молекулу Н2О2 [3]. Механизм процесса до конца не выяснен, но качественно все исследованные случаи можно отнести к одному из двух типов реакций:
1. Катализатор образует с пероксидом (без изменения валентности) нестабильный пероксид, разлагающийся с отщеплением кислорода и регенерацией катализатора.
2. Восстановленная форма катализатора КВФ, способного окисляться, переводится пероксидом в высшую степень окисления КОФ, которая далее окисляет Н2О2 до воды и кислорода:
КВФ + Н2О2 ? КОФ + Н2О;
КОФ + Н2О2 ? КВФ + О2 + Н2О.
Отмечено, что в присутствии хроматов процесс разложения перекиси протекает по первому механизму [3]. При этом изменение цвета окраски раствора катализатора с оранжевой до коричневой и обратно (после завершения реакции) свидетельствует о том, что степень окисления катализатора изменяется. Такое изменение степени окисления катализатора отмечается в ряде работ, посвященных этой теме [4–5]. На рисунке показана полученная нами кривая изменения рН в процессе разложения пероксида. В начале процесса при исходной концентрации 22 М величина рН раствора пероксида составил 2,3. Такое низкое значение не соответствует данным по константе диссоциации чистого пероксида водорода:
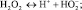 Кд = 2,4?(10–1)2.
Кд = 2,4?(10–1)2.
В процессе изготовления пероксида используется серная кислота [6]. Вероятно, избыток последней отвечает за кислотный характер раствора. рН бихромата калия (0,4 М) составил 4,1, что так же можно связать с избытком кислоты, так как ион бихромата устойчив в кислой среде. При смешивании растворов было замечено, что вместе с мгновенным изменением окраски с оранжевой до коричневой наблюдался быстрый рост рН до значений 5,3–5,4.
Такое поведение реакционной системы свидетенльствует, что на первой стадии процесса идет изменение степени окисления хромат – иона, и одновременно либо поглощаются протоны, либо выделяются гидроксогруппы. Объяснить это можно с помощью предложенного Габером и Вейсом [7] механизма для реакции разложения пероксида с участием ионов Fe2+:
1. Н2О2 + Fe2+ ? НО- + Fe3+ + НО–.
Как отмечено эта стадия протекает очень быстро, даже при малых концентрациях реагентов. Выделяющиеся гидроксогруппы понижают кислотность раствора.
Если предположить, что бихромат-ион превращается в ион пероксидихромовой кислоты 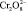 (по аналогии с пероксидисерной кислотой Н2S2O8, образующейся при производстве пероксида водорода). Формально степень окисления хрома в этом ионе равна + 7. Тогда первую стадию процесса можно записать как:
(по аналогии с пероксидисерной кислотой Н2S2O8, образующейся при производстве пероксида водорода). Формально степень окисления хрома в этом ионе равна + 7. Тогда первую стадию процесса можно записать как:
1. Н2О2 + Cr+6 ? НО- + Cr+7 + НО–.
Дальше реакция может протекать по цепному механизму с участием свободных радикалов:
2. Cr+6 + НО- ? Cr+7 + НО–;
3. 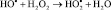 ;
;
4. 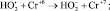
5. 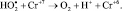
Реакции (2) и (4) можно исключить, так как в нашем случае концентрация перекиси значительно превышала концентрацию бихромата калия. Тогда механизм процесса включит три основные стадии: зарождение цепи, развитие цепи и ее обрыв:
1. Н2О2 + Cr+6 ? НО- + Cr+7 + НО–;
2. 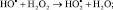
3. 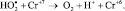
Кинетическую кривую, характеризующую первую и третью стадии процесса, мы получили, измеряя рН в ходе реакции. Составив систему дифференциальных уравнений и решив ее относительно скорости образования газообразного кислорода можно получить теоретическую кинетическую кривую выделения кислорода. Сравнение с экспериментальной кривой поможет определить константы предложенных реакций.
Выводы
1. Наглядность эксперимента, многофазность реакции позволяют моделировать данный процесс в широком диапазоне стадийности.
2. Неослабевающий интерес химиков к системе каталитического разложения пероксида водорода открывает возможности для обсуждений с целью более глубокого выяснения различных механизмов протекания реакций.
ЛИТЕРАТУРА
1. Беренблит В.М., Бурдин В.В., Вишняков В.М., и др. Химия и технология перекиси водорода / Под ред. Г.А. Серышева. – Л.: Химия, 1984. – 200 с.
2. Шамб У., Сеттерфилд Ч., Вентворс Р. Перекись водорода: Пер. с англ. / Под ред. А.И. Горбанева. М.: Ил, 1958, 578 с.
3. Ahbar M. – J. Am. Chem. Soc., 1961, Vol. 83, p. 2031.
4. Гончаренко Е.Е., Бадаев Ф.З., Голубев А.М. Химическая кинетика и катализ. Методические указания. М.: Изд-во МГТУ им. Н.Э. Баумана, 2012, 48.
5. Коровин Н.В., Камышов В.К., Удрис У.Я. Общая химия. Лабораторный практикум. М.: Кнорус, 2015, 334.
6. Бродский А.И., Франчук В.И. ДАН СССР, 1958, т. 123, с. 117
7. Долгоплоск Б.А., Тинякова Е.И. Окислительно-восстановительные системы как источники свободных радикалов. М.: Наука, 1972, с. 240.
