
Научная электронная библиотека
Монографии, изданные в издательстве Российской Академии Естествознания

ЦИТОГЕНЕТИЧЕСКИЕ, МОЛЕКУЛЯРНЫЕ И КЛИНИЧЕСКИЕ ОСНОВЫ ГЕНЕТИЧЕСКИ ОБУСЛОВЛЕННЫХ БОЛЕЗНЕЙ
Юров И. Ю., Ворсанова С. Г., Воинова В. Ю., Чурносов М. И., Юров Ю. Б.,
7.2.2. Молекулярно-цитогенетические методы
Среди самых распространенных молекулярно-цитогенетических методов известны: флюоресцентная гибридизация in situ (fluorescence in situ hybridization – FISH) и сравнительная геномная гибридизация (comparative genomic hybridization – CGH). Как несложно заметить, оба эти метода основаны на процессе гибридизации нуклеиновых кислот. Гибридизация in situ основана на взаимодействии однонитевых последовательностей экзогенной ДНК, меченной флюорохромами (флюоресцирующими веществами) – ДНК пробы, и исследуемой ДНК. Разрешающая способность молекулярно-цитогенетических методов определяется минимальным размером последовательности хромосомной ДНК (количеством нуклеотидов), которую возможно регистрировать с помощью микроскопа или другой системы детекции. В качестве стандарта при молекулярно-цитогенетическом анализе используются цитогенетические методы.
Схема проведения FISH представлена на рисунке 19. Первой стадией FISH является денатурация – процесс получения однонитевых последовательностей ДНК. Следующей стадией является гибридизация – реакция воссоединения однонитевых последовательностей ДНК зонда и ДНК, находящейся на цитологическом препарате в составе метафазных хромосом и интерфазных ядер, с образованием двунитевых молекул ДНК. В результате появляется возможность анализа флюоресцирующих последовательностей ДНК на предметном стекле с помощью флюоресцентного микроскопа.
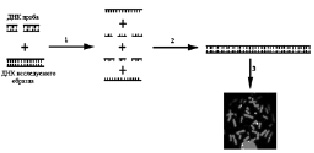
Рис. 19. Схематическое изображение метода FISH:
1 – смесь ДНК пробы и ДНК исследуемого образца денатурируется при температуре 72–75 °С, в результате чего получается смесь однонитевых последовательностей ДНК; 2 – гибридизация ДНК пробы и исследуемого образца: меченая ДНК проба встраивается в ДНК исследуемого образца на препарате хромосом; 3 – детекция меченой ДНК in situ с помощью флюоресцентного микроскопа
Идентичный принцип лежит также в основе метода HR CGH, схема которого представлена на рисунке 20. Отличие заключается лишь в том, что в случае CGH гибридизация на хромосомах in situ проводится с использованием смеси меченых одним флюорохромом геномной ДНК пациента и другим флюорохромом ДНК донора (при исследовании численных хромосомных аномалий) или геномной ДНК пациента и ДНК какой-то конкретной хромосомы донора (при исследовании структурных хромосомных аномалий). Затем с помощью цифрового анализа производится сравнительная оценка интенсивности суперпозиции сигналов двух разных флюорохромов, в результате чего становится возможным определение приобретения или потери последовательностей ДНК у пациента в строго определенных хромосомах. На рисунке 21 показан результат проведения классической метафазной сравнительной геномной гибридизации (HR CGH) ребёнку с умственной отсталостью и МАР.

Рис. 20. Схематическое изображение метода классической CGH на метафазных хромосомах: гибридизация двух меченых разными красителями образцов тотальной ДНК (пациента и донора) происходит так, как и в случае FISH. Затем, соотношение интенсивностей результатов гибридизации ДНК пациента и донора на метафазных хромосомах анализируется с помощью компьютера. Соотношение 1:1 соответствует норме; 1 (донор):0,5 (пациент) – делеции; 1 (донор):1,5 (пациент) – дупликации
В настоящее время известен целый комплекс модификаций FISH. Практически все разновидности метода FISH являются взаимодополняющими при диагностике хромосомных аномалий, поскольку существует достаточно большое количество флюорохромов с различными свойствами. Имеется возможность детекции множества последовательностей ДНК на цитологическом препарате за счет того, что каждая из ДНК проб будет мечена определенным цветом (многоцветовая FISH или MFISH). Тем не менее, одноцветовая FISH является одним из основных среди всех молекулярно-цитогенетических методов. Спектр применения данного метода в значительной степени широк: от диагностики самых распространенных численных хромосомных аномалий (например, синдром Дауна и его мозаичные формы) до идентификации редких структурных хромосомных перестроек при недифференцированных формах наследственной патологии. Особое внимание заслуживает одноцветовая FISH с использованием ДНК проб, маркирующих полностью пару гомологичных хромосом. Этот метод применяется преимущественно для идентификации сложных хромосомных перестроек, реже он используется для определения численных хромосомных аномалий.

Хромосома 18
Рис. 21. Результаты проведения HR CGH ребенку с умственной отсталостью и МАР: А – цитогенетическое исследование [кариотип: 47,XY,+mar]; Б – молекулярно-цитогенетическое исследование: обнаружено увеличение числа копий последовательностей ДНК (трипликация) короткого плеча хромосомы 18 [ish cgh enh(18)(p11.1pter)*]. *запись результата в соответствии с международной номенклатурой ISCN 2013
MFISH основывается на создании смеси ДНК проб, меченных различными флюорохромами, которые одновременно вводятся в исследуемый препарат с последующей совместной гибридизацией. Изначально данный метод разрабатывался для идентификации хромосомных аномалий при отсутствии клинического диагноза из-за значительной экономии затрачиваемого экспериментального времени на анализ. Помимо этого, данный метод является эффективным для определения структурных хромосомных аномалий за счет одновременной визуализации нескольких участков хромосом. На базе ранних разработок MFISH были созданы такие высокоразрешающие методы идентификации хромосомных аномалий, как 24-цветовая FISH и спектральное кариотипирование (SKY– spectral karyotyping). Данные методы используют комбинацию из 24-х ДНК проб, меченных разными флюорохромами, которые соответствуют каждой гомологичной аутосоме и половым хромосомам. Различие их заключается в том, что для SKY используются специальные спектральные системы детекции, а для 24-цветовой FISH применяется цифровой анализ изображения, целью которого является создание соответствующей комбинации цветов, в результате чего каждая хромосома имеет свою характерную окраску. Использование технологий, основанных на микроманипуляции микроскопическими объектами, позволило создать коллекцию ДНК проб, маркирующих одновременно участки хромосом, соответствующие полосам G-окрашивания. Подобные коллекции обычно состоят из нескольких сотен проб и их применение позволяет получить разноцветное сегментное окрашивание всех хромосом с высоким разрешением. MCB FISH (multicolor banding FISH) представляет собой высокоэффективный метод диагностики сложных структурных хромосомных перестроек и микроаберраций.
В настоящее время существует целый ряд модификаций CGH, применение которых рассматривается в качестве оправданных при ряде диагностических процедур. Как уже было сказано, применение методов зависит от их разрешающей способности, оценивающейся числом последовательностей ДНК, которая представлена в таблице 8. Классический CGH анализ был внедрен в молекулярно-цитогенетическую практику для анализа хромосомного набора в клетках тканей, культивирование которых затруднено или невозможно. Среди основных ограничений CGH необходимо отметить невозможность диагностики хромосомного мозаицизма и сбалансированных структурных хромосомных перестроек. Разработка и модификации метода CGH была направлена на создание протоколов для высокоразрешающей идентификации хромосомных микроаберраций (микроделеций и микродупликаций). В результате этого были созданы методы серийного CGH анализа (серийная CGH или arrayCGH). Серийный CGH анализ основан не на гибридизации тотальной геномной ДНК донора и пациента, а на применении в качестве ДНК донора специфических последовательностей ДНК (наночип), соответствующих определенным участкам хромосом. Схема проведения arrayCGH (молекулярного кариотипирования) представлена на рисунке 22. CGH проводится несколькими сериями с использованием цифровых систем детекции и анализа сравнительной интенсивности сигналов. Методы, основанные на серийной CGH, позволяют проводить идентификацию хромосомных микроаберраций, а также генных мутаций, затрагивающих последовательности ДНК, размер которых больше 50 пн. На рисунках 23, 24, 25 и 26 показаны результаты проведения arrayCGH детям с различными геномными аномалиями: дополнительным материалом на хромосоме 1 (рис. 23), дополнительным материалом на хромосоме 13 (рис. 24), дополнительным материалом на хромосоме Х (рис. 25) и кольцевой хромосомой 11 (рис. 26).
Одним из наиболее используемых методов молекулярно-цитогенетической диагностики является интерфазная FISH на препаратах культивированных и некультивированных клеток. Данный метод нашел широкое применение в идентификации хромосомных аномалий при различных заболеваниях, многие из которых сопровождаются нарушением психики. Среди преимуществ данного метода следует отметить высокую эффективность определения регулярных и мозаичных форм фактически любой хромосомной патологии. Дополнительным преимуществом этого метода является возможность проведения анализа непосредственно на предметном стекле, которое можно было использовать при классическом цитогенетическом анализе (культивирование клеток исследуемой ткани, дифференциальное окрашивание хромосом, исследование кариотипа с помощью светового микроскопа). Однако невозможность культивирования большинства клеток тканей человека ограничивает FISH анализ на метафазных хромосомах. В результате чего был разработан метод FISH на интерфазных ядрах или интерфазная FISH. Этот метод также в значительной степени более эффективен по сравнению с FISH анализом метафазных хромосом при идентификации мозаичных форм численных хромосомных аномалий, поскольку позволяет легко изучить большое число клеток (до нескольких десятков тысяч). Недостатком этого метода является сложность в определении структурных хромосомных аномалий. На рисунке 27 показан пример использования метода FISH на интерфазных клетках.
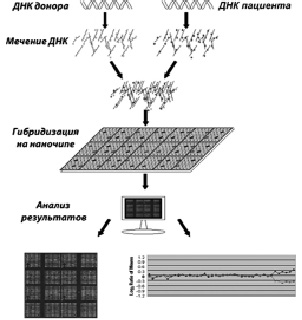
Рис. 22. Схематическое изображение метода arrayCGH: ДНК пациента и донора метятся разными флюорохромами; затем проводится гибридизация на наночипе, далее результаты сканируются и анализируются с помощью специальных систем – «лазерный сканер + компьютер»

Хромосомы 1 16
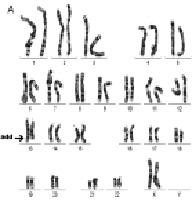
Рис. 23. Результаты молекулярно-цитогенетического исследования дополнительного материала неизвестного происхождения на длинном плече хромосомы 1: А – цитогенетический анализ [кариотип ребёнка: 46,XX,add(1)(q4?4)]; Б – исследование методом arrayCGH участка длинного плеча хромосомы 1 и хромосомы 16. Обнаружены делеция длинного плеча хромосомы 1 (размер 2 825742 пн) и дупликация короткого плеча хромосомы 16 (размер 14 443283 пн)
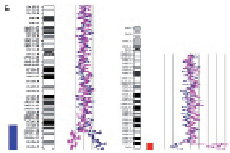
Хромосомы 10 13
Рис. 24. Результаты исследования дополнительного материала на длинном плече хромосомы 13: А – цитогенетический анализ [кариотип ребёнка: 46,XX,add(13)(q33)]; Б – исследование методом arrayCGH хромосомы 10 и 13. Обнаружена дупликация длинного плеча хромосомы 10 (размер 23 108414 пн) и делеция длинного плеча хромосомы 13 (размер 5 720171 пн)

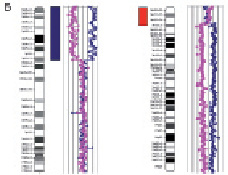
Хромосомы 3 Х
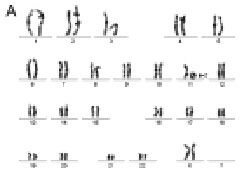
Рис. 25. Результаты исследования дополнительного хромосомного материала на коротком плече хромосомы Х: А – цитогенетический анализ [кариотип: 46,X,add(X)(?::p?22qter),16qh-]; Б – исследование методом arrayCGH коротких плеч хромосомы 3 и хромосомы Х. Обнаружена дупликация короткого плеча хромосомы 3 (размер 36 350871 пн) и делеция короткого плеча хромосомы X (размер 7 392677 пн)
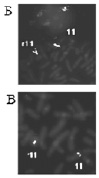

Хромосома 11
Рис. 26. Результаты исследования кольцевой хромосомой 11: А – цитогенетический анализ [кариотип: 46,XX,r(11)(p15.?5q23.?3)]; Б, В – использование метода FISH с ДНК пробами на различные участки длинного плеча хромосомы 11; Г – исследование хромосомы 11 методом arrayCGH. Обнаружена делеция длинного плеча хромосомы 11 (размер 13 505195 пн)
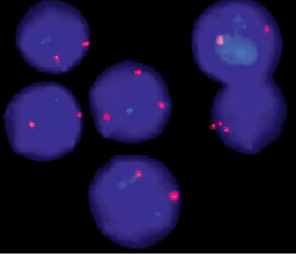
Рис. 27. Пример использования метода FISH, демонстрирующий наличие двух хромосом Х в клетке (норма) и трёх хромосом Х (трисомия хромосомы Х). Видны: три сигнала в клеточном ядре, соответствующие трём хромосомам Х (трисомия) и два сигнала – двум хромосомам Х (норма)
Как уже отмечалось, одним из основных направлений развития методологических подходов к разработке новых вариантов FISH является создание ДНК проб с различными свойствами, связанными с их молекулярным составом и локализацией на хромосомах. Среди ДНК проб для метода FISH можно выделить следующие: ДНК пробы, состоящие из высокоповторяющихся последовательностей ДНК; ДНК пробы, состоящие из уникальных последовательностей ДНК генов; WCP ДНК пробы (whole chromosome probe – проба, маркирующая хромосому полностью) и 24-цветовая FISH/SKY (набор из 24-х WCP ДНК проб); ДНК пробы, состоящие из участков хромосом (MCB FISH) для MFISH. Наиболее частая процедура в клинической практике – FISH с использованием ДНК проб, состоящих из высокоповторяющихся последовательностей ДНК, для идентификации численных хромосомных аномалий. FISH с применением ДНК проб, состоящих из уникальных последовательностей ДНК, является методом идентификации и локализации структурных хромосомных аномалий и определения изменения ДНК на субхромосомном уровне (выявление точек разрыва). FISH с использованием WCP ДНК проб и 24-цветовая FISH/SKY (набор из 24-х WCP ДНК проб) являются дополнительными методами диагностики структурных хромосомных аномалий. Эти методы, в основном, используются для уточнения диагноза при наличии перестройки с участием нескольких хромосом. Они также могут быть использованы при диагностике транслокаций небольших участков хромосом. MCB FISH является высокоэффективным методом идентификации сложных структурных хромосомных перестроек и хромосомных микроаберраций.
CGH анализ нашел своё применение в области онкоцитогенетики и диагностики хромосомных микроаберраций у детей с умственной отсталостью. Помимо этого, серийный CGH анализ позволяет с высокой эффективностью определить потерю (делеции) или приобретение (дупликации) последовательностей хромосомной ДНК размером менее одного миллиона пн (геномные аномалии).
Необходимо знать, что при постнатальной диагностике хромосомных аномалий молекулярно-цитогенетические технологии являются дополнительными к классическим цитогенетическим методам. Инициирующей стадией диагностики хромосомных аномалий обычно является классический цитогенетический анализ, включающий в себя культивирование исследуемых клеток с целью получения метафазных пластинок с последующим применением методов дифференциального окрашивания хромосом по длине и исследованием кариотипа с помощью светового микроскопа. Данный метод позволяет идентифицировать или предположить наличие хромосомной аномалии. При необходимости, исходя из возможных цитогенетических предположений, применяется молекулярно-цитогенетическая диагностика. При этом выбирается участок хромосомы, последовательности ДНК которого маркирует соответствующая проба. После этого проводится молекулярно-цитогенетический анализ. Следует отметить и то, что сложные хромосомные перестройки требуют применения нескольких модификаций молекулярно-цитогенетических методов.
Особого внимания заслуживает молекулярно-цитогенетическая диагностика субтеломерных хромосомных микроаберраций. Частота данных хромосомных аномалий может достигать 5–25 % в группах детей с недифференцированными формами умственной отсталости и других нарушений психики. До создания коллекций ДНК проб, маркирующих соответствующие участки хромосом, диагностика этой патологии оставалась невозможной. Получение набора ДНК проб, маркирующих все субтеломерные участки, позволило с высокой эффективностью обнаружить данную форму хромосомной патологии. Другой возможностью идентификации хромосомных микроаберраций является применение различных вариантов метода CGH. Многие исследователи отмечают и то, что метод серийной CGH (молекулярного кариотипирования) является в значительной степени эффективным для диагностики субтеломерных хромосомных микроаберраций. Альтернативным методом диагностики субтеломерных хромосомных микроаберраций, предложенным отечественными исследователями, является FISH с ДНК пробами, маркирующими субтеломерные участки хромосом. В настоящее время известны многие клинические характеристики пациентов с субтеломерными микроаберрациями различных хромосом. Благодаря этому, становится возможным теоретически выделить ту хромосому, в которой с наибольшей вероятностью расположена микроаберрация, в результате исчезает необходимость одновременного использования нескольких проб и анализ производится с использованием лишь одной субтеломерной ДНК пробы.
Заключение. Таким образом, генетические нарушения, выявляемые у индивидуумов, достаточно гетерогенны, поэтому для их определения требуется применение различных методов. Причинами этих нарушений нередко могут быть различные хромосомные (геномные) микроперестройки, которые невозможно выявить с применением стандартных цитогенетических методов из-за не слишком высокого уровня разрешения этой классической технологии. С разработкой современных технологий многие учёные считают, как говорилось выше, что субтеломерные и интерстициальные перестройки могут являться причиной более 5–10 % случаев недифференцированной умственной отсталости при условии их выявления с использованием высокоразрешающего сканирования генома методом arrayCGH (с разрешением не менее 100 тысяч пн). Они также предполагают, что применение высокоразрешающих методов сканирования генома увеличивает удельный вес субтеломерных и интерстициальных перестроек при умственной отсталости и аутизме в 1,5–2 раза. Показано, что исследования больных с недифференцированными формами умственной отсталости, проведенные с помощью современных молекулярно-цитогенетических методов, способствуют более корректному определению структурных особенностей генома и при определении генетических причин позволяют классифицировать недифференцированные формы. Кроме того, подобные исследования имеют практическую значимость, а именно, благодаря им определены показания для проведения молекулярного кариотипирования (arrayCGH), определяется тактика проведения молекулярно-цитогенетических исследований (см рекомендуемую литературу), что в дальнейшем способствует эффективному медико-генетическому консультированию (см главу 8), а в отдельных случаях и пренатальной диагностике.
Суммируя результаты исследований наших лабораторий, можно сказать, что мы обследовали более 2500 пациентов с недифференцированными формами умственной отсталости различными методами (цитогенетическими и молекулярно-цитогенетическими). Учитывая данные, полученные с помощью цитогенетических исследований и подтвержденные с использованием FISH и MCB, различные хромосомные аномалии были выявлены в 10,6 % случаев. Принимая во внимание наличие у некоторых детей хромосомной нестабильности в виде анеуплоидии аутосом и гоносом, хромосомных перестроек (транслокаций, делеций, сайтов ломкости и т. д.), можно сказать и о том, что мозаичные хромосомные аномалии, включая низкопроцентный мозаицизм и хромосомную нестабильность, имеют относительно повышенную частоту среди детей с умственной отсталостью, ВПР и/или МАР, и этим пациентам требуется проведение исследования с использованием нескольких методов, а именно цитогенетических и молекулярно-цитогенетических технологий (FISH, МСВ, HR CGH и arrayCGH). Обсуждая данные, полученные в наших лабораториях ранее при использовании HR CGH, сделано заключение о том, что этот метод является эффективным для выявления хромосомных микроаномалий (эффективность более 40 %), и может быть использован для анализа геномных перестроек, связанных с умственной отсталостью. Однако в связи с такими ограничениями этого метода, как невозможность подтверждения (исключения) низкопроцентного мозаицизма, сбалансированных транслокаций, а также в случаях микроделеционных синдромов, когда размер перестройки является ниже разрешения HR CGH метода, применяется метод arrayCGH. При использовании этого метода микроаномалии хромосом (генома) обнаружены в 48 % случаев, а в 37 % случаев были выявлены вариации числа копий последовательностей ДНК (CNV). Методом arrayCGH также были подтверждены и/или уточнены точки разрыва, предположенные с помощью цитогенетических и других молекулярно-цитогенетических методов. Микроаномалии и/или вариации числа копий последовательностей ДНК затрагивали все хромосомы и довольно большое число генов, которые могут быть ассоциированы с недифференцированными формами умственной отсталости и аутизма. Нами был сделан вывод о том, что патогенез умственной отсталости связан со многими генами и, практически, со всеми хромосомами, и заболевание следует рассматривать в плане геномных сетей и генных взаимодействий, т. е. как связанное со специфическим комплексом процессов, в которые вовлекаются от нескольких десятков до нескольких тысяч генов. Единичные аномалии у индивидуумов с наследственными недифференцированными формами (например, с умственной отсталостью) указывают, скорее всего, на одно из звеньев патогенетического каскада, а не на специфическую перестройку, характерную для заболевания. Вероятно, к изучению многих недифференцированных форм предположительно наследственных заболеваний следует подходить с точки зрения персонифицированной геномной медицины, т. е. основываясь на идентификации индивидуальных особенностей вариаций генома на молекулярном и клеточном уровнях (см рекомендуемую литературу). Таким образом, следует подходить к клиническому анализу больного персонализировано, используя все современные геномные и клеточные технологии в диагностике. Становится всё более и более очевидным, что патогенез наследственных заболеваний, связанный со многими генами, необходимо рассматривать в плане геномных сетей и геномных взаимодействий. Предлагаемый биоинформатический (in silico) подход к анализу геномых перестроек позволяет определить возможные гены-кандидаты и молекулярные «процессы-мишени», связанные с патогенезом наследственных нервных и психических заболеваний. Анализируя наиболее известные методы поиска этиологических факторов недифференцированных форм, можно сделать вывод о том, что сочетание высокоразрешающих молекулярно-цитогенетических методов и in silico анализа может считаться наиболее удачной комбинацией для поиска генетических причин недифференцированных форм наследственных заболеваний.
Кроме того, применение цитогенетических и молекулярно-цитогенетических методов, направленных на идентификацию хромосомных (геномных) микроаномалий, позволяет не только выявлять те или иные численные и структурные изменения генома, но также картировать гены-кандидаты данной формы нарушения психики. Таким образом, анализ геномных вариаций и микроаномалий хромосом (генома), обнаруженных современными молекулярно-цитогенетическими методами, представляет несомненный интерес для выявления причин заболеваний и фактически дифференцирования изучаемых форм, определения их генетических маркеров, а также дальнейшего поиска генетических и эпигенетических механизмов патологии головного мозга.
В заключение следует также отметить значимость современных технологий молекулярной цитогенетики в изучении уже дифференцированных форм. В частности, авторы Юров И.Ю., Ворсанова С.Г. и Юров Ю.Б. предлагают оригинальную гипотезу классификации генетических заболеваний, для которых уже известен тип наследования, в журнале Molecular Cytogenetic (Молекулярная цитогенетика) (Iourov I.Y., Vorsanova S.G., Yurov Y.B. Pathway-based classification of genetic diseases. Mol Cytogenet. 2019; 12:4). Приводим краткое изложение этой гипотезы. Известно, что в медицинской генетике заболевания классифицируются в соответствии с их природой («гипотетической природой»), основанной на характере генетических нарушений. Эту классификацию можно представить как «генно-ориентированную» и «факторно-ориентированную»: болезнь может быть моногенной, олигогенной или полигенной/мультифакторной, приводя к догме о том, что гены и их взаимодействие со средой являются единственными параметрами, необходимыми для описания заболевания с генетической природой. В этой связи следует отметить, что даже моногенные заболевания могут быть ассоциированы с целым каскадом молекулярных и клеточных изменений, проявляя вариабельность в фенотипических проявлениях и патологических механизмах. Поскольку патогенетические механизмы (геномные сети) в свете современных геномных исследований оказывают большее влияние на понимание возникновения и течения болезни, чем генетические дефекты как таковые, то существует необходимость классификации болезней, отражающей как генетические причины, так и молекулярно-клеточные механизмы. В данной статье авторы предлагают расширение общепринятой классификации заболеваний, основанной на выявленных геномных нарушениях с последующим биоинформатическим анализом при приоритизации генов и определении процессов-кандидатов. Дополнительная классификация болезни должна также фокусироваться и на специфических для болезней «молекулярных путях». Авторы предлагают, следуя традиции при создании биомедицинских терминов, использовать древнегреческие слова и приставки, а также применить слово «грифос» для обозначения типа болезни. Древнегреческое слово «грифос» одновременно означает «сеть» и «головоломку по типу мозаики» (пазл) и, соответственно, довольно удачно символизирует термин «путь» в контексте молекулярной биологии и медицины. Объединив слова «грифос» и греческие префиксы, можно предложить следующие типы обозначения болезней:
моногрифный – изменение одной геномной сети может привести к соответствующим фенотипическим проявлениям;
дигрифный, тригрифный – изменение двух или трех геномных сетей может также приводить к фенотипическим проявлениям;
олигогрифный – изменение нескольких геномных сетей может приводить к соответствующим фенотипическим проявлениям;
полигрифный – изменение многих геномных сетей может приводить к многочисленным фенотипическим про- явлениям;
гомеогрифный – изменение общих геномных сетей может также приводить к соответствующим фенотипическим проявлениям при коморбидных заболеваниях.
Чтобы показать применение предлагаемой авторами классификации заболевания, приведем конкретные примеры:
1) фенилкетонурия – болезнь, вызванная мутациями в гене PAH, кодирующем фенилаланингидроксилазу, катализируя реакцию гидроксилирования фенилаланина в тирозин. Эту болезнь следует обозначить как моногенно–моногрифное заболевание;
2) синдром Ретта – заболевание, вызванное генетическими нарушениями в гене MECP2, этот ген участвует в нескольких геномных сетях, главным образом, регулирующих активность генома. По предлагаемой классификации его можно обозначить как моногенно-полигрифный синдром;
3) атаксия-телеангиэктазия – синдром хромосомной нестабильности, вызванный генетическими нарушениями в гене АТМ. Этот ген участвует во множестве путей регулирования поддержания стабильности генома, клеточного цикла, запрограммированной гибели клеток и т. д. По предложенной классификации эту болезнь следует также обозначить как моногенно-полигрифное заболевание;
4) случай, описанный авторами этого пособия (Iourov et al., Mol Cytogenet. 2015; 8:82. doi: 10.1186/s13039-015-0185-9), делеции короткого плеча хромосомы 3 (3p22.1p21.31) с выявленными нарушениями двух геномных сетей. По предложенной классификации эти нарушения следует обозначить как хромосомное дигрифное заболевание;
5) синдром Вильямса – заболевание, при котором точно неизвестно, сколько генных/геномных сетей нарушено, но известно, что их число не менее 3-х, но и не больше 20-ти. Этот синдром можно отнести к хромосомным олигогрифным заболеваниям;
6) синдром Неймегена (Nijmegen breakage syndrome) и атаксию-телеангиэктазию следует рассматривать, как моногенные гомеогрифные заболевания, т. к. гены, мутации в которых с ними ассоциированы, входят в одну генную/геномную сеть, но эти болезни клинически различны.
Авторы полагают, что представленная классификация имеет право на существование в свете достижений в медицинской генетике и геномике за последние десятилетия, связанных с разработкой и применением в фундаментальных исследованиях и клинической практике современных геномных и цитогеномных технологий.